肠道菌群、炎症因子和幼儿身体活动与BMI的关联性初探
2019-09-20赵广高全明辉曹振波张涵彬张佳仪张金铭孙顺利何梓豪陈佩杰
赵广高,王 茹,全明辉,曹振波,张涵彬,张佳仪,张金铭,孙顺利,何梓豪,陈佩杰*
(1.南昌大学,江西 南昌330031;2.上海体育学院,上海200438;
3.泰山医学院,山东 泰安271016)
儿童肥胖已发展成为广泛蔓延的全球性疾病。包括幼儿在内的儿童青少年(2~19 岁)群体调查结果显示,1980-2013年间发达国家男性与女性的超重肥胖率分别上升了6.9%与6.4%,发展中国家分别上升了4.8%与5.0%,至2013年我国男性的超重肥胖率(29.9%)甚至超过发达国家水平(23.8%)(Ng et al.,2014)。跟踪研究表明,儿童时期的肥胖会显著增加成年后肥胖的概率(Freedman et al.,2005;Singh et al.,2008),而肥胖又是引起成人高血压、糖尿病、心血管疾病等慢性病产生的重要危险因素(Hu et al.,2004;Reaven,2011),这就意味着未来我国成人患慢性病的风险可能会增加。研究表明,合理的身体活动可有效减轻肥胖程度和降低肥胖发生风险,而成年后的肥胖也与儿童时期建立的身体活动习惯密切相关。因此,如何开展我国儿童身体活动与肥胖的相关研究,是当前我国学者面临的重要问题。2017年以来,国内已有涉及幼儿身体活动与肥胖关系的研究报道(王晓飞,2018;赵广高 等,2017)。
根据前期研究报告,肥胖的发生可能与肠道菌群失调密切相关。如2006年在《自然》(Nature)上发表的动物实验(Turnbaugh et al.,2006)与人体实验(Ley et al.,2006)研究提示,拟杆菌门降低、厚壁菌门增加或拟杆菌门/厚壁菌门降低会引发肥胖。有研究认为,肥胖等疾病的病理特征是长期慢性的炎症反应,而肠道菌群参与了炎症的形成过程(Li et al.,2010)。其原因在于,肠道菌群与宿主呈现互利共生状态,它们与宿主细胞之间不断进行信息传递,发挥消耗、存储并重新分布能量的作用。受饮食、运动等因素(Denou et al.,2016;Evans et al.,2014)的影响,宿主的能量正/负平衡会导致肠道菌群发生适应性改变以实现互利共生,并通过“内毒素血症”(Cani et al.,2007)调节炎症反应水平,达到增进或减轻肥胖的作用。
身体活动(包括运动)与肠道菌群的关系研究目前仍处于初级阶段,但已成为学者们研究的热点,目前已涉及各类研究对象:健康成人(蒋兴宇 等,2017;Bressa et al.,2017)、肥胖人群(Allen et al.,2018)、儿童青少年(Bai et al.,2019)、优秀运动员(潘凤伟 等,2019;Clarke et al.,2014),以及健康(Allen et al.,2015;Mika et al.,2015)、肥胖(沙继斌 等,2018;Campbell et al.,2016;Denou et al.,2016;Evans et al.,2014;Kang et al.,2014;Queipo-Ortuno et al.,2013)、高血压(Petriz et al.,2014)、糖尿病(Lambert et al.,2015)动物模型。针对肥胖受试对象的研究方面,现有实验成果显示,运动可明显改善肠道菌群的结构与功能(沙继斌 等,2018;Allen et al.,2018;Campbell et al.,2016),可有效逆转由高脂饮食或自由饮食引起的拟杆菌门与拟杆菌门/厚壁菌门比值降低、厚壁菌门与体重增加(Denou et al.,2016;Evans et al.,2014;Queipo-Ortuno et al.,2013),提示运动减轻肥胖的过程可能与调节肠道菌群的作用有关。研究发现,儿童时期的肥胖也与肠道菌群的失调密切相关(Kalliomaki et al.,2008;Vael et al.,2011),而肠道菌群失调又可引发慢性炎症反应而导致肥胖(Cani et al.,2008)。有研究发现,6 周的自主转轮运动可显著提升幼年大鼠(24 天龄)拟杆菌门丰度,并显著降低厚壁菌门丰度(Mika et al.,2015)。然而,目前鲜见基于人体生命早期——幼儿的相关实验报道。从肠道菌群与炎症视角开展幼儿群体研究,不仅可丰富幼儿肥胖干预的生物学机制,还可为制定幼儿身体活动干预方案提供理论支撑,对减轻幼儿肥胖危害具有现实意义。
基于以上问题,本研究以学龄前儿童为受试对象,采用Bressa 等(2017)在研究身体活动与成年女性肠道菌群关系中所采用的横断面设计与加速度传感器测量工具,期望在证实身体活动与幼儿肥胖关系的基础上,研究肠道菌群、炎症因子在身体活动影响幼儿肥胖中的中介作用,尝试探讨身体活动影响幼儿肥胖的可能机制,为后续相关干预与机制研究提供参考。
1 研究材料与方法
1.1 受试对象
本课题组前期在上海市杨浦区、宝山区8 所幼儿园建立了“孩童体质健康”科研基地,并将该8 所幼儿园作为受试对象的募集范围。本研究共募集幼儿园中班儿童346名,将其中完成身体活动测量、身体形态学指标测量、基本信息调查(问卷)且数据均完整有效的受试幼儿224 名(月龄:47~69 个月)作为受试对象,其中男童126 名,女童98 名。所有受试对象经家长同意参与本研究并签署知情同意书。研究过程中,受试幼儿及其家长可随时作出不继续参加或退出本研究的决定,并要回已签署知情同意书。
1.2 测试指标与方法
1.2.1 身体活动与静坐行为水平测量
采用三轴加速度传感器ActiGraph GT3X+(Actigraph LLC,Pensacola,FL)测试身体活动与静坐行为水平(表1)。测试前建立包括所有幼儿家长和测试人员的微信群,即时提醒家长并解答测试过程中的相关问题。测试过程中仪器的佩戴和去除工作由家长协助完成。工作日期间,测试人员每日早晨前往幼儿园检查幼儿的仪器使用情况。借助Actilife(Version 6.11.5)下载仪器测试数据,数据缺失或不符合要求时,在征得幼儿家长同意的前提下进行补测。
测量参数参考幼儿身体活动测量方法学文献(Cain et al.,2013;Cliff et al.,2009;Pate et al.,2006)设定(表1)。测试指标包括静坐行为(sedentary behavior,SB)、低强度身体活动(light physical activity,LPA)、中-大强度身体活动(moderate to vigorous physical activity,MVPA)。总身体活动(total physical activity,TPA)等于LPA 与MVPA 之和。

表1 ActiGraph GT3X+身体活动与静坐行为水平测试方法与参数设置Table 1 The Measurements and Parameters of Physical Activity and Sedentary Behavior
1.2.2 身体形态学指标测量
测量受试幼儿身高、体重并计算身体质量指数(BMI),BMI=体重/身高2(kg·m-2)。记录幼儿测量日期,同时获取出生日期信息,用于计算月龄与校正线性回归模型。
1.2.3 肠道菌群测试
经受试幼儿家长同意,愿意参加粪便样本的采集并满足以下标准后签署知情同书:1)样本收集前2 周未使用过抗生素;2)样本收集前2 周未发生创伤、严重感染等应激状态;3)无腹痛、腹泻、便秘等胃肠道病变。
1.2.3.1 粪便样本的采集
提前向幼儿家长发放粪便采集盒、医用手套,告知粪便采集流程与注意事项。由家长协助幼儿采集早晨空腹状态下、新鲜大便中段内部的少量样本。采集后立即送至幼儿园或由本研究组成员上门提取,后由研究组成员用装有干冰的泡沫盒移至-80℃冰箱冷冻保存待测。
1.2.3.2 粪便样本DNA 的提取与检测
采用十六烷基三甲基溴化铵法对粪便样本的基因组DNA 进行提取,之后利用琼脂糖凝胶电泳检测DNA 的纯度和浓度。
1.2.3.3 细菌16S rRNA 基因的PCR 扩增
16S V4 区引物为 515F(引物序列:5'-GTGCCAGCMGCCGCGGTAA-3')、806R(引物序列:5'-GGACTACHVGGGTWTCTAAT-3')。采用T100 梯度PCR仪(Biorad,Hercules,CA,USA)进行PCR。
1.2.3.4 PCR 产物的混样与纯化
根据PCR 产物浓度进行等量混样,充分混匀后采用2%浓度的琼脂糖凝胶进行电泳检测,选择主带大小在400~450 bp 之间的序列,割胶回收目标条带。
1.2.3.5 文库构建和上机测序
采用 Illumina 公司的TruSeq®DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库构建,构建好的文库经过Qubit 和Q-PCR 定量,文库合格后,使用HiSeq2500 PE250 进行上机测序。基于测序得到的有效数据进行分类操作单位(OTUs)聚类和物种分类分析,根据OTUs 聚类结果,对每个OTU 的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况,计算拟杆菌门与厚壁菌门的丰度及其所占总细菌的百分比、拟杆菌门与厚壁菌门的比值等。
1.2.4 血液指标测试
经受试幼儿家长同意,愿意参加血液样本的检测并签署知情同意书后,组织幼儿进行血液样本的收集。采血前幼儿空腹12 h,采样时间为早晨7:00-8:00。为增加受试幼儿的配合程度,提前为其准备好早餐并于采血完成后发放。采血前幼儿静坐5 min 以上,采集肘正中静脉血2 ml,置于含有EDTA 抗凝剂的真空采集管中。然后经+4℃、3 500 rpm 低温离心15 min,分离血浆后置于-80℃冰箱储存待测。采用悬液芯片技术检测促炎症因子α-肿瘤坏死因子(TNF-α)、白细胞介素(IL)-2、IL-6、IL-8 与抗炎症因子IL-10 含量。试剂盒采用上海伯乐生命科学有限公司订做的悬液芯片测定试剂盒。
1.2.5 统计学处理
借助SPSS 22.0 软件进行数据处理,对于符和正态分布的数据采用平均数±标准差(M±SD)进行描述,不符合正态分布的数据采用中位数(四分位间距)进行描述。采用独立样本t检验和曼惠特尼U 检验比较不同性别间各测试指标以及高、低BMI 值组间肠道菌群丰度、外周血炎症因子含量的差异。利用线性回归模型分别检测身体活动水平与BMI 值,肠道菌群丰度、炎症因子含量与BMI 值,身体活动水平与肠道菌群丰度、炎症因子含量的关联性。显著性差异水平设定为P<0.05,非常显著性差异水平设定为P<0.01。
2 研究结果
2.1 受试对象基本特征
在本研究募集的 224 名受试幼儿中,共有 20 名(男14、女6)参加粪便样本的采集与检测,其中19名(男14、女5)身体活动水平指标数据完整有效;共有189 名参加血液样本的采集与检测,其中156 名(男86、女 70)身体活动水平、血液样本指标数据均完整有效。
从统计结果来看,不同性别间幼儿身高、体重、BMI值、身体活动水平以及炎症因子含量指标均出现了显著性差异(表2),因此,本研究中的所有线性回归模型均分男童与女童进行。

表2 受试对象基本情况Table 2 The Basic Characteristics of Participants

(续表2)
2.2 身体活动水平与BMI 值
线性回归结果显示,在受试男童中,LPA、MVPA、TPA 与BMI 值均呈正相关关系,SB 与BMI 值呈负相关关系,但均未达到显著差异水平;受试女童中,SB、MVPA、TPA 与BMI 值均呈负相关关系,LPA 与BMI 值呈正相关关系,但均未达到显著差异水平(表3)。

表3 身体活动水平与BMI 值线性回归分析结果Table 3 Results of Linear Regression Analysis
2.3 肠道菌群、炎症因子与BMI 值
线性回归结果显示,男、女童拟杆菌门丰度、拟杆菌门/厚壁菌门比值均与BMI 值呈负相关关系,厚壁菌门丰度与BMI 值呈正相关关系,但均未达到显著差异水平(表4)。男童血促炎症因子含量均与BMI 值呈正相关关系,抗炎症因子含量与BMI 值呈负相关关系,但均未达到显著差异水平,其中,IL-6 含量与BMI 值的关联性接近显著差异水平(P= 0.051);女童血炎症因子含量与BMI 值均无显著关联性(表5)。
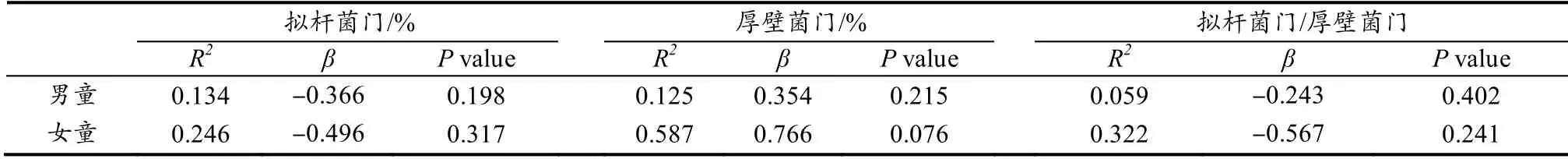
表4 肠道菌群丰度与BMI 值线性回归分析结果Table 4 Results of Linear Regression Analysis

表5 炎症因子含量与BMI 值线性回归分析结果Table 5 Results of Linear Regression Analysis /(pg·ml-1)
根据BMI 值的大小,将肠道菌群测试样本平均分为低BMI 值组、高BMI 值组两组。同样,在炎症因子测试样本中,将男童、女童按样本数量平均分为低BMI 值组、高BMI 值组两组。独立样本t检验结果显示,高BMI 值组拟杆菌门丰度、拟杆菌门/厚壁菌门比值均低于低BMI 值组,其中两组拟杆菌门丰度呈显著性差异(P<0.05);高BMI值组厚壁菌门丰度显著高于低BMI 值组(P<0.05,表6)。男童中高BMI 值组血促炎症因子含量均高于低BMI 值组,抗炎症因子含量低于低BMI 值组,其中两组血TNF-α、IL-6、IL-8 含量的比较呈显著性差异(P<0.05);女童中两组血炎症因子含量均无显著性差异(表7)。

表6 高BMI 值组与低BMI 值组肠道菌群丰度的比较Table 6 Comparison of Gut Microbiota between High-BMI Group and Low-BMI Group (n=10,男7/女3)

表7 高BMI 值组与低BMI 值组外周血细胞因子水平的比较Table 7 Comparison of Plasma Inflammatory Cytokines between High-BMI Group and Low-BMI Group /(pg·ml-1)
2.4 身体活动水平与肠道菌群、炎症因子
线性回归结果显示,男、女童LPA、MVPA、TPA 与拟杆菌门丰度、厚壁菌门丰度、拟杆菌门/厚壁菌门比值均无显著关联性(表8)。除男童中MVPA 与血IL-10 含量显著负相关(P<0.05),女童中LPA、TPA 与血IL-8 含量显著正相关(P<0.05)外,其他身体活动指标与血炎症因子指标间均无显著关联性(表8)。

表8 身体活动与肠道菌群、炎症因子线性回归分析结果Table 8 Results of Linear Regression Analysis
3 分析与讨论
3.1 幼儿身体活动与BMI 的关系
本研究设计原本期望在证实身体活动与幼儿肥胖关系的基础上,研究肠道菌群、促/抗炎症因子在身体活动影响幼儿肥胖中的中介作用,尝试探讨身体活动影响幼儿肥胖的可能机制。依据Baron 等(1986)的条件,肠道菌群丰度、外周血炎症因子要成为中介变量,应同时满足以下3个条件:1)身体活动水平与BMI 值显著相关;2)身体活动水平与肠道菌群丰度、外周血炎症因子含量显著相关;3)肠道菌群丰度、外周血炎症因子含量在校正身体活动水平的前提下,与BMI 值显著相关。然而,本研究结果显示,无论是受试男童还是女童,身体活动水平与BMI 值均无显著相关关系(P>0.05,表3),与同类研究结果并不一致(Jago et al.,2005;Moore et al.,2003;Remmers et al.,2014),即第1 个条件已不满足。因此,本研究结果无法体现肠道菌群与外周血炎症因子在幼儿身体活动与肥胖中的中介作用。尽管如此,本研究继续就幼儿肠道菌群、炎症因子与BMI,身体活动与肠道菌群、炎症因子的关系进行探讨,旨在为后续身体活动影响肥胖的机制研究提供参考。
3.2 幼儿肠道菌群、炎症因子与BMI 的关系
3.2.1 幼儿肠道菌群与BMI 的关系
自2004年Backhed 等(2004)提出“肠道菌群是调节脂肪贮存的一种环境因素”开始,肠道菌群与肥胖的关系就成为学者们研究的热点。有学者汇总了2005-2010年5年间对肥胖与非肥胖动物和人体肠道菌群结构、种属丰度的分子水平研究成果,发现从门水平到种水平上肠道菌群都与肥胖有密切关系(武庆斌 等,2012)。2006年在《自然》(Nature)上发表了两篇有关肠道菌群与肥胖关系的动物实验(Turnbaugh et al.,2006)与人体实验(Ley et al.,2006),结果发现,拟杆菌门降低、厚壁菌门增加或拟杆菌门/厚壁菌门降低与肥胖程度的增加密切相关。在幼儿阶段,肥胖同样与肠道菌群的失调密切相关。Kalliomaki 等(2008)随访研究了儿童从婴儿期到7 岁时肠道菌群的变化情况,结果发现,与体重正常的儿童相比,7 岁时体重超重的儿童在6~12 个月时的肠道菌群分布具有显著差异,并指出,儿童时期肠道菌群结构异常者,随着年龄的增长有肥胖的倾向。
本研究结果显示,无论是在受试男童还是女童中,拟杆菌门丰度、拟杆菌门/厚壁菌门比值均与BMI 值呈负相关关系,厚壁菌门丰度与BMI 值呈正相关关系,但统计结果均未达到显著差异水平(表4)。该结果的趋势与本研究假设一致,但并不具有统计学意义。然而,本研究根据受试幼儿BMI 值的大小将其平均分为低BMI 值组、高BMI 值组两组,结果发现,高BMI 值组拟杆菌门丰度、拟杆菌门/厚壁菌门比值均低于低BMI 值组,其中两组拟杆菌门丰度的比较呈显著性差异(P<0.05);高BMI 值组厚壁菌门丰度显著高于低BMI 值组(P<0.05,表6)。同类研究中,研究者比较了不同肥胖程度的学龄儿童(7~13 岁)肠道菌群的差异,结果发现,肥胖儿童拟杆菌门、拟杆菌门/厚壁菌门比值均显著低于正常体重儿童(P<0.01)(李敏,2011),该研究与本研究结果一致。另一项研究则发现,3~6 岁的单纯性肥胖儿童与正常儿童拟杆菌门、厚壁菌门丰度均无显著性差异(李静 等,2015)。本研究结果提示,在人体生命早期的学龄前儿童阶段,肥胖的发生可能与拟杆菌门的降低、厚壁菌门的增多密切相关。
3.2.2 幼儿炎症因子与BMI 的关系
肥胖等慢性代谢性疾病被认为是一种长期低水平的慢性炎症反应(Wellen et al.,2005),肥胖的发生与TNF-α、IL-6 等促炎症因子的增加有关(Hotamisligil et al.,1993;Weisberg et al.,2003)。肥胖与促炎症因子的关系还体现在幼儿群体中(Costa et al.,2016;Delaney et al.,2018)。
本研究结果显示,无论是在受试男童还是女童中,外周血细胞因子TNF-α、IL-2、IL-6、IL-8 含量与BMI 值均无显著关联性(表5)。该结果提示,某一种促炎症或抗炎症因子并不能对幼儿肥胖产生决定性影响,幼儿肥胖可能是多种促/抗炎症因子综合作用的结果。低BMI 值组与高BMI 值组外周血细胞因子的比较发现,在受试男童中,高BMI 值组外周血促炎症因子血TNF-α、IL-6、IL-8 含量显著高于低BMI 值组(表7),提示受试男童肥胖与炎症作用密切相关。然而,受试女童中却未发现显著差异(表7)。这可能是由于受试女童BMI 值(16.10±1.75)显著低于受试男童(16.79±2.02)(表2),整体肥胖率较低,因此受促炎症因子的影响也较小。
3.3 幼儿身体活动与肠道菌群、炎症因子的关系
3.3.1 幼儿身体活动与肠道菌群的关系
人体从出生时的肠道无菌到生命第1 天出现细菌定植并开始发生变化,2 岁后随着饮食结构的改变,其肠道菌群也发生巨大变化,之后逐渐趋于稳定,接近成人菌群结构(武庆斌 等,2012)。这种发展变化过程受到诸多因素的影响。婴儿出生1年内肠道菌群的变化主要受遗传因素、分娩方式、早期喂养方式、应用抗生素和环境等因素影响(武庆斌 等,2012)。2 岁后人体肠道菌群除受应用抗生素、应激、胃肠道病变等因素影响外,饮食、运动等因素(Denou et al.,2016;Evans et al.,2014)也是影响肠道菌群的重要因素。
近年来的研究发现,身体活动与肠道菌群存在密切关系(刘洋 等,2018;于春霞 等,2018;Campbell et al.,2017;Codella et al.,2018)。有学者发现,自主踏转轮运动大鼠与安静大鼠的肠道菌群组成具有显著差异。此外,运动大鼠粪便中丁酸(具有促进宿主吸收能量、增进肥胖作用)的含量也与安静大鼠具有显著差异(Matsumoto et al.,2008)。肥胖相关实验研究中,研究者发现,高脂(能量比:脂肪60%,碳水化合物20%,蛋白质20%)喂养可使小鼠体重与附睾脂肪垫重显著增加。伴随着这些改变的是肠道拟杆菌门降低、厚壁菌门的增加。而12 周自主无负重转轮运动可逆转这些变化(Evans et al.,2014)。与之相似,Denou 等(2016)发现,6 周高脂喂养可显著降低小鼠盲肠拟杆菌门/厚壁菌门比值,而6 周高强度间歇训练可显著提升高脂喂养肥胖小鼠盲肠拟杆菌门/厚壁菌门比值。另有研究发现,在自由饮食状态下,仅6 天的自主转轮运动就可显著提升拟杆菌门,降低厚壁菌门(Queipo-Ortuno et al.,2013)。相反的研究结果同样存在,有学者发现,4 周的中等强度跑台运动(Petriz et al.,2014)与16 周的电动转轮运动(Kang et al.,2014)引起大鼠/小鼠拟杆菌门显著降低,厚壁菌门显著升高,研究者认为,这可能与运动类型不同有关(Kang et al.,2014)。
在生命的早期身体活动可能对肠道菌群就有一定的影响。基于生命早期受试的动物实验研究方面,Mika 等(2015)发现,6 周的自主转轮运动可显著提升幼年大鼠(24 天龄)拟杆菌门丰度,并显著降低厚壁菌门丰度,但目前仍未见基于人体的相关实验报道。本研究结果显示,在排除应用抗生素、应激、胃肠道病变等因素,受试者保持惯有饮食习惯与生活方式的情况下,无论在受试男童还是女童中,LPA、MVPA、TPA 与拟杆菌门丰度、厚壁菌门丰度与拟杆菌门/厚壁菌门比值均无显著相关关系(表8)。这可能与本研究样本的选择有关。本研究参加粪便样本采集且身体活动水平指标数据完整有效的受试幼儿仅为19名(男 14、女 5)。其中,受试幼儿 MVPA(61.91± 14.75 min·天-1)、TPA(149.58±27.18)均处于较低水平(表2),达到每天至少累积MVPA 60 min 推荐量标准(Tremblay et al.,2012)的仅有11 人,每天至少累积TPA 180 min 推荐量标准(Tremblay et al.,2012)的仅有3 人。受试幼儿较低的身体活动水平可能导致其不足以引起肠道菌群的明显变化。此外,前人对身体活动与肥胖者肠道菌群的阳性研究结果主要来自于运动干预实验研究,而本研究阴性结果的出现还可能与横断面研究的局限性有关。在Bressa 等(2017)的横断面研究中,活动组(体育运动时间≥3 h·周-1,n=21)成年女性加速度传感器所测中强度身体活动时间显著长于安静组(n=19),但两组拟杆菌门丰度、厚壁菌门丰度与拟杆菌门/厚壁菌门比值也均无显著差异。
3.3.2 幼儿身体活动与炎症因子的关系
Walsh 等(2011)认为,习惯性运动可通过发挥抗炎症作用来减轻慢性炎症反应。本研究结果显示,受试男童中,LPA、MVPA、TPA 与促炎症因子TNF-α、IL-2、IL-6、IL-8 含量均无显著关联性,但MVPA 与抗炎症因子IL-10含量呈显著负相关(P<0.05)(表8);受试女童中,LPA、MVPA、TPA 与促炎症因子TNF-α、IL-2、IL-6 含量和抗炎症因子IL-10 含量均无显著关联性,但LPA、TPA 与血IL-8 含量呈显著正相关(P<0.05,表8)。该研究结果提示,中大强度身体活动反而可能起到了抑制受试男童抗炎症作用,低强度身体活动和总身体活动起到了提升受试女童炎症反应的作用,从而使受试幼儿出现肥胖程度增加的诱因。该结果的产生可能与饮食因素的干扰有关。许多研究证实,减少能量摄入与增加身体活动均可有效减轻炎症反应(Walsh et al.,2011)。导致该结果的原因可能是受试幼儿的饮食类型和饮食习惯不同,不同受试幼儿间能量摄入差异较大,导致细胞因子的分泌与身体活动水平的变化并不一致,甚至出现相反的变化趋势。
3.4 研究的局限性
1)横断面设计虽能揭示各变量之间的关联性,但不能说明变量间的因果关系;2)肠道菌群样本较少,可能会影响研究结果的显著差异程度;3)未募集到同时采集肠道菌群与外周血的受试幼儿,导致难以对肠道菌群与外周血细胞因子的关系进行分析探讨。
4 结论
身体活动与幼儿肥胖的关系并不密切,肠道菌群与细胞因子未体现出在幼儿身体活动与肥胖中的中介作用;幼儿肥胖与肠道菌群失调密切相关,与男童炎症因子变化密切相关;幼儿身体活动未表现出有效调节肠道菌群和减轻炎症反应的作用。
