运动通过激活卫星细胞功能延缓和改善骨骼肌衰减症的研究进展
2019-09-20冯祎中陈彩珍
金 晶,冯祎中,黄 伟,冯 燕,陈彩珍,卢 健
(1.浙江农林大学 体育军训部,浙江 杭州311300;2.华东师范大学 体育与健康学院,上海200241)
0 前言
卫星细胞(satellite cell,SC)是骨骼肌的干细胞,位于骨骼肌纤维基底膜和肌膜之间的狭小空隙中(niche 微环境),于1961年被Mauro(1961)发现,其自我复制与定向分化的干细胞特性具有广泛的应用前景与内在价值,因而相关研究受到运动医学、体育科学、再生医学等领域的极大关注(Bengal et al.,2017;Dinulovic et al.,2017;Sampath et al.,2018)。2011年,McCarthy 等(2011)的研究使卫星细胞能否促进骨骼肌肥大问题备受关注,实验利用Pax7-白喉霉素(diphtheria toxin,DTA)创造出新型小鼠模型,该模型可以在添加他莫普芬(tamoxifen)后条件性的消除>90%的卫星细胞。他们认为,卫星细胞与运动诱导骨骼肌肥大没有直接关系。2016年,Egner 等(2016)重复同样的实验,再次论证并确定卫星细胞的干细胞功能,并提出之所以McCarthy 等(2011)未能有阳性结果,是由于损伤程度和肌纤维分析的标准不同。有多种因素均可对卫星细胞产生影响,如运动、低氧条件、氧化应激、骨骼肌损伤等正向促进卫星细胞激活,而衰老、骨骼肌相关疾病、辐射、基因敲除等负调控卫星细胞的激活(Dinulovic et al.,2017;Moal et al.,2017;Rao et al.,2018;Snijders et al.,2017;Sousa-Victor et al.,2016;Szentesi,et al.,2019;Verbrugge et al.,2018;Verdijk et al.,2014)。
衰老,尤其是骨骼肌衰减症(Sarcopenia)会导致骨骼肌质量、数量的减少以及肌力的下降,严重影响老年人生活质量。运动可促进卫星细胞的激活进而刺激骨骼肌增粗/肥大(Nederveen et al.,2016;Snijders et al.,2015,2017),然而Sarcopenia 患者骨骼肌中的卫星细胞出现严重“并发症”:衰老增加卫星细胞激活难度(Bazgir et al.,2017;Qaisar et al.,2016),衰老下调卫星细胞数量(Snijders et al.,2017),衰老弱化卫星细胞重塑能力(Nederveen et al.,2018;Verbrugge et al.,2018)。近期研究表明,运动可调控骨骼肌细胞外基质成分(Lim et al.,2018;Nederveen et al.,2017,2018),促进骨骼肌细胞自噬的发生(Park et al.,2019;Sebastian et al.,2016),降低骨骼肌氧化应激水平(Moal et al.,2017;Szentesi et al.,2019)。这提示,运动可通过激活卫星细胞促进衰老骨骼肌的肥大和提升肌肉力量,从而预防和改善Sarcopenia骨骼肌衰减进程。
1 运动激活卫星细胞的研究进展
1.1 有氧运动对卫星细胞的影响
研究发现,卫星细胞在不同肌纤维上的分布情况与其激活状况存在“不相称”现象。卫星细胞在慢肌中的含量是快肌的2~4 倍(Mackey et al.,2009),同一骨骼肌中I 型肌纤维中的卫星细胞含量显著高于II 型肌纤维(Snijders et al.,2017)。与此相反,有氧运动主要动员I 型肌纤维,抗阻运动则主要动用II 型肌纤维(金晶 等,2017),而卫星细胞的增殖和骨骼肌肥大主要发生在II 型肌纤维上(Nederveen et al.,2018)。
研究普遍认为,中等强度的有氧运动可激活卫星细胞。20世纪80年代,Appell 等(1988)对受试者进行为期6 周,每周4 次,30 min/次的自行车蹬车实验,发现有氧运动可促使卫星细胞被激活同时融入到肌纤维中,并形成新的肌纤维。Smith 等(2001)等对大鼠进行有氧运动干预,同样证明卫星细胞在运动诱导下激活、增殖,融合进入新的骨骼肌中。Mangan 等(2014)采用9 周龄的SD 大鼠进行90 min(速度17 m/min)跑台运动,运动72 h 后观测到腓肠肌和比目鱼肌上白肌中的卫星细胞显著增多。Vyver 等(2012)让受试者进行下坡跑运动(-10°坡度,85%O2max,12 次×5 min/次),试验后第1 天卫星细胞数量增长30%。Fry 等(2014)对6 名男性和17 名女性受试者进行为期12 周的有氧自行车训练,I 型和II 型肌纤维的横截面积均增长,并伴随卫星细胞数量的增长。Shefer 等(2013)采用中等强度的跑台运动(11.5 m/min,30 min/天,6 天/周)改善老年小鼠的骨骼肌质量,发现实验组卫星细胞niche 与对照组相比,有约1.6 倍的增长。
1.2 抗阻运动对卫星细胞的影响
现阶段的研究共识认为,抗阻运动是促进骨骼肌肌力提升和肌肉体积增大的有效方式,并且可通过激活卫星细胞,发挥干细胞特性修复和加强肌纤维的质量(Tierney et al.,2016;Trensz et al.,2015;Verdijk et al.,2014;Yoon,2017)。
1.2.1 长期抗阻运动对卫星细胞激活的影响
Petrella 等(2008)对66 人采用16 周的伸膝阻力训练进行实验,并通过k-mean 聚类分析,股外侧肌活检检测发现卫星细胞数量提升,并观察到分化融入肌纤维中,同时伴随着肌纤维尺寸的显著提升。Petrella 等(2008)还提出:1)未经训练的群体受到运动干预后其卫星细胞的活性更具敏感性;2)可有效扩增卫星细胞池,激活卫星细胞及扩大肌核区域;3)卫星细胞的肌核区域增长存在“上限”,为2 000 μm²。加拿大麦克马斯特大学运动机能实验室的Snijders 教授及其团队在该领域研究10 余年,抗阻运动干预对卫星细胞的激活成果显著。2014年,他们对从出生到老年的人类卫星细胞含量等信息进行全面分析,肌纤维的尺寸从出生到成年有了极大的增长。与I 型肌纤维相比较,II 型肌纤维的横截面积与卫星细胞含量随年龄的增长而显著减小。12 周的抗阻运动可显著改善上述变化,研究认为,抗阻运动是增加卫星细胞含量,逆转II 型肌纤维萎缩的有效策略。2017年两篇文章分别报道为期16 周(Nederveen et al.,2017)和24 周(Snijders et al.,2017)的抗阻运动,均能增加骨骼肌I 型和II 型肌纤维的横截面积、周长,且卫星细胞激活显著提升。Bellamy 等(2014)发现,23 名男性受试者经过16 周抗阻运动,股四头肌的体积和肌纤维横截面积都显著提升。Mackey 等(2011)对12 名男性进行腿部抗阻训练,试图探究极轻的负荷能否对骨骼肌中的卫星细胞产生影响,结果发现,极轻的负荷经过12 周的训练后也能促进卫星细胞的激活。
1.2.2 急性抗阻运动对卫星细胞激活的影响
2004年,Crameri(2004)等首次对活体进行急性抗阻运动干预,观察卫星细胞的激活、增殖情况,为该领域开创了先河。研究认为,单次抗阻运动后,第4、8 天后卫星细胞均发生激活,并进入细胞周期。Bellamy 等(2014)研究发现,急性抗阻运动72 h 后II 型肌纤维上卫星细胞进行扩张。Mackey 等(2009)通过对活检的骨骼肌卫星细胞和肌核进行鉴别过程中发现,健康成年人骨骼肌中激活的卫星细胞数量很少(仅约1.3%),而通过急性抗阻运动后卫星细胞的数量可达7 倍。
Snijders 及其研究团队对急性抗阻运动进行了系列研究:2012年,通过对8 名青年组受试(22±1 岁)进行一次抗阻运动(运动负荷为75%蹬腿和伸膝运动组合,共6组,10 次/组),发现I 型和II 型肌纤维中的卫星细胞含量显著高于运动干预前,此前该研究团队也证明了一次抗阻运动能有效刺激卫星细胞的激活;2014年,研究单次运动后卫星细胞数量和激活状态与年龄是否存在差异性,研究认为,基于年龄因素,老年受试者运动后恢复期随年龄增长而下降;同年,还研究了饮食中蛋白对运动后卫星细胞增殖的影响,结果认为,饮食中蛋白摄入不直接调节运动后卫星细胞的增加,但可以调节肌生成抑制蛋白的表达,间接作用于卫星细胞;2018年,通过对29 名年轻人进行300 次伸膝抗阻运动(角度180°)发现,运动24 h 后显著提升卫星细胞含量和毛细血管密度,激活的卫星细胞与毛细血管的距离显著缩进,提示,肌纤维中毛细血管的改善有助于卫星细胞池的扩张和激活(Snijders et al.,2012,2014a,2014b;Nederveen et al.,2018)。
Nielsen 等(2012)最先探索低强度急性抗阻运动对卫星细胞激活的影响,研究采用20% 1RM 进行伸膝运动,发现卫星细胞被激活,甚至能促进骨骼肌纤维肥大。Wernbom等(2013)也采用低负荷30% 1RM 强度进行单次抗阻运动,结果也证明卫星细胞被激活。综上,目前的研究成果仍未确定抗阻运动的最小强度阈值。
运动可促进骨骼肌卫星细胞的激活,不同运动(有氧/抗阻)对I 型和II 型肌纤维同时起作用,而且活体研究中骨骼肌纤维中同时发生着有氧代谢和糖酵解反应。因而本研究认为,运动强度、时间和频次3 种因素均能影响运动对卫星细胞激活,三者之间是互相联系和共同发生的。相同运动强度随着时间和次数增多机体疲劳程度增加后,相对强度逐步提升,运动时间与频数之间成正相关,因此,三者之间共同影响运动刺激卫星细胞的激活。
2 运动延缓和改善Sarcopenia 卫星细胞的研究进展
2.1 运动激活卫星细胞改善Sarcopenia 骨骼肌的研究进展
Sarcopenia 在世界范围内的发病率显著上升,我国是“老龄化问题”较为严重的国家之一,应予以高度重视。Sarcopenia 的发生主要以骨骼肌量(质量和数量)的丢失和肌肉力量下降为特征,骨骼肌功能的缺失常伴随着跌倒、骨折甚至死亡(Sousa-Victor et al.,2016;Suzman et al.,2015)。骨骼肌进程性的丢失随年龄逐步增加,起始于40 岁并以8%/10年的速率递增,至70 岁后将以15%/10年的速率激增(Sousa-Victor et al.,2016)。研究认为,衰老机体的骨骼肌卫星细胞数量、活性等均下降(Lacraz et al.,2015;Nederveen et al.,2018),是导致增龄性骨骼肌丢失的重要原因。
1)衰老提高卫星细胞激活难度:Snijders 等(2014a)和Dreyer 等(2006)分别对青年组和老年组进行抗阻运动研究发现,老年组卫星细胞的激活情况显著低于青年组,表明,衰老会导致卫星细胞活性的延缓;2)衰老下调卫星细胞数量:Verdijk 等(2014)以0~75 岁的不同人群为研究对象研究发现,卫星细胞的数量随年龄提升而下降,该结论与另一项研究结果一致,老年组的卫星细胞数量显著低于青年组(Snijders et al.,2017)。Motohashi 等(2014)和Lacraz 等(2015)对比老年小鼠和青年小鼠发现,老年小鼠肌纤维中的卫星细胞数量显著下降;3)衰老弱化卫星细胞重塑能力:衰老导致卫星细胞微环境的改变迫使卫星细胞重塑能力弱化,多项独立实验均证实,将年老小鼠的卫星细胞移植进入年轻鼠的微环境中,能恢复卫星细胞的功能(Conboy et al.,2005;Sousa-Victor et al.,2014;Villeda et al.,2011),另有研究发现,青年和老年群体经过急性运动后衰老的卫星细胞重塑能力变弱(Dreyer et al.,2006)。
人体实验研究认为,运动能够影响卫星细胞的数量和功能:Snijders 等(2014b)对老年组(73±1 岁)的蹬腿和伸腿肌群进行运动训练,取股外侧肌作为活检肌肉,发现,运动72 h 后卫星细胞显著增多;Nederveen 等(2016)对老年组(67±4 岁)进行腿部训练,结果显示,一次急性抗阻运动后,老年组的卫星细胞和激活状态的卫星细胞数量显著增多,并发现,年轻组的卫星细胞更接近于毛细血管;Dreyer 等(2006)通过老年受试者进行急性运动观察对卫星细胞的影响,研究发现,老年受试者24 h 后卫星细胞数量增长了51%显著低于青年组的141%;Verdijk 等(2009)发现,经过12 周的抗阻运动后卫星细胞显著性增加,且蹬腿量增加25%~30%,股四头肌的横截面积增加6%~9%。在研究不同肌纤维类型中卫星细胞含量时发现,其分布存在差异性,慢肌(比目鱼肌)中卫星细胞的含量是快肌(胫骨前肌)的2~4 倍(Mackey et al.,2009),并且,在同一肌肉中I 型肌纤维中的卫星细胞含量显著高于II 型肌纤维(Snijders et al.,2017;Yin et al.,2013)。但运动(特别是抗阻运动)在促进卫星细胞数量和肌纤维横截面积增长时,多发生在II 型肌纤维上(Snijders et al.,2017)。Snijders 等(2017)还发现,经过12 周和24 周的抗阻运动后,老年组的II 型肌纤维粗大,并且II 型肌纤维上的卫星细胞数量显著增多,毛细血管丰富组通过锻炼后更有利于II 型肌纤维的肥大、卫星细胞的增多和激活,且经过抗阻运动后具有Pax7 标记的卫星细胞更接近于毛细血管。
衰老机体骨骼肌中卫星细胞激活难度虽然较年轻机体困难许多,但通过一定的运动训练也能提升卫星细胞的效果,尤其是抗阻运动能提升毛细血管的数量、密度,为肌纤维提供必要的氧份和营养物质,最终改善衰老机体的骨骼肌质量、横截面积等(Binder et al.,2005;Bunout et al.,2001;Suetta et al.,2008)。

图1 Sarcopenia 对骨骼肌及卫星细胞功能的影响Figure 1.Effect of Sarcopenia on Skeletal Muscle and Satellite Cell Function
2.2 运动延缓和改善Sarcopenia 卫星细胞的机制
2.2.1 运动可调控骨骼肌细胞外基质成分
为探究干细胞感知与作用于基质弹性和信号传导的机制,Engler 等(2006)通过不同硬度的培养基对细胞间质干细胞(mesenchymal stem cells,MSC)进行分类培养发现,不同底物弹性(刚度)对干细胞的分化组织类型有极高的相关性,硬度从小到大分别为神经细胞(0.1~1 KPa)、成肌细胞(8~17 KPa)和成骨细胞(25~40 KPa)。Boonen等(2009)首次使用生物力学方式对卫星细胞细胞外基质的刚度与卫星细胞重塑过程进行研究,利用可调刚度的培养基对卫星细胞进行离体培养,结果显示,压强在21 kPa时,更有利于骨骼肌卫星细胞的分化作用,研究还认为,存在多聚赖氨酸和层粘连蛋白的培养基中促进骨骼肌的重塑。通过利用刚性可调式的水凝胶,卫星细胞在杨氏模型(young's modulus)刚性强度为12 kPa 时增殖情况最好(Trensz et al.,2015),当强度增加到18 KPa 时(模拟观察到受损衰老肌纤维)卫星细胞进行分化。卫星细胞的微环境由多糖、蛋白聚糖和胶原蛋白等物质构成复杂结构,其中最为广泛的是胶原蛋白、纤连蛋白、整合素及层粘连蛋白等(Yin et al.,2013)。对衰老骨骼肌的基底膜研究发现其改变不规则,且呈现出增厚片层等物质,还发现胶原蛋白家族的显著增多,这对卫星细胞发挥正常功能不利(Brack et al.,2016;Thomas et al.,2015)。卫星细胞的微环境刚度直接驾驭卫星细胞的命运(激活、增殖、分化、融合等),因而卫星细胞的状态与细胞外基质成分极为相关。
1)运动下调细胞外基质中的胶原蛋白。转化生长因子-β(transforming growth factor-β,TGF-β)是通过与Smad作用后促进成肌纤维细胞增殖,诱导I 型胶原蛋白在细胞外基质合成,Czarkowska-Paczek B(2009)的小鼠实验证明,一次急性运动后可下调TGF-β1 mRNA 水平。Emter 等(2010)发现,10月龄的尤卡坦半岛微型猪经过15 周的低强度间歇训练有效改善了心肌功能并抑制线粒体功能障碍,研究认为,该现象是通过增加左心室纤维(23%)和减少胶原蛋白(36%)沉积实现的。Derumeaux 等(2018)发现,8 只6~18月龄小鼠通过4 周的游泳训练后,左心室内膜的胶原蛋白沉积相对于对照组显著下降。Alves 等(2014)对慢性心力衰竭大鼠进行为期8 周的抗阻训练(4次/周,4 组/次,重复次数为10~12 次,运动强度为65%~75% 1 RM),发现运动干预能改善大鼠的心脏功能、力量、胶原蛋白沉积和炎症分布的改善。
2)运动上调基质金属蛋白酶(matrix metalloproteinases,MMPs)。MMPs 又称为解胶酶,是一类依赖于锌和钙的水解蛋白酶主要负责细胞外基质的降解,其主要靶点目标是细胞外基质上的胶原蛋白。MMPs 主要有两个亚型为MMP2和MMP9,最早发现MMP9的提升可导致骨骼肌肥大和Akt/ mTOR 信号通路的上调。Ogasawara 等(2014)采用单次电刺激对SD 大鼠进行骨骼肌训练(共5 组,5 s 时间刺激×5次/组,5 s间隔,组间休息3 min),右腿作为实验组,左腿为对照,研究认为,单次电刺激可显著提升MMP2 和MMP9,并未发现胶原蛋白IV、层粘连蛋白、α7 整合素的改变,有研究发现,3月龄的大鼠进行为期8 周(3 次/周)的低强度和高强度抗阻运动,两种运动强度都能提升MMP2 的表达,且认为MMP2 与血乳酸有强相关性(Deus et al.,2012)。
综上所述,运动后卫星细胞外基质的组成发生变化,胶原蛋白数量下降,可通过激活解胶酶MMP2/9 清除胶原蛋白,扭转衰老所引起的卫星细胞的微环境,进而促进其激活。
2.2.2 运动可促进细胞自噬的发生
随着衰老的不断加剧,啮齿动物和人类骨骼肌的自噬功能逐步消逝。实验研究认为,随着年龄的增加会导致动物线粒体紊乱并出现自噬的进程性下降,包括降低自噬表达和较低的自噬水平(Sebastian et al.,2016)。Demontis 等(2010)认为,在骨骼肌衰老过程保持自噬可以保护果蝇不发生与年龄相关的骨骼肌功能障碍,并可以通过FoxO、4E-BP 信号通路来延长寿命。有研究发现,一次急性的抗阻运动可以提升不同人群(老年和青年)骨骼肌的降解和自噬能力(Fry et al.,2011)。研究显示,阻断自噬将阻碍卫星细胞的激活,自噬极可能提供卫星细胞激活时所需的亚细胞器(Lee et al.,2019;Tang et al.,2014)。
运动可通过促进自噬改善衰老导致的骨骼肌力量和数量丢失。Kim 等(2013)比较老年和青年鼠之间的自噬相关基因7(Autophagy-related gene 7,Atg7)、溶酶体相关膜蛋白等,趾长伸肌和腓肠肌的表达低于青年小鼠,老年小鼠经过8 周跑台运动(16.4 m/min,5°坡度,40 min/天,一周5 次),检测到运动后Beclin-1、Atg7 显著提升,还增加IGF-1/IGF-1R 表达量、腺苷5'-磷酸腺苷活化蛋白激酶(Adenosine 5'-monophosphate-activated protein kinase,AMPK)表达和AMPK 磷酸化和FOXO3a 磷酸化水平。White 等(2016)等探索了骨骼肌衰减症的分子机制,采用C57BL/6J 小鼠15月龄开始抗阻跑轮运动直到23月龄,认为,长期的抗阻运动显著改善了线粒体和自噬体通路的一些标志物,并延缓骨骼肌衰减症状。通过选用24月龄的C57BL/6J 雄性小鼠进行单次游泳运动,研究表明,急性有氧运动上调了衰老小鼠腓肠肌的应激诱导蛋白2(Sestrin2,Sesn2),并诱导多种自噬标志物的包括Atg5、Atg7、p62 和自噬标志物轻链3(light chain 3,LC3)-II 蛋白水平(Lenhare et al.,2017)。构建动物模型也得到运动可促自噬提升的结果,D-半乳糖构建的小鼠衰老模型,通过30 次游泳训练(60 min/天,5 天/周,共42 天)观察到通过训练可减少衰老的萎缩程度,通过电镜观察自噬体增多,噬丝分裂激活等自噬信号增强现象,同时药物结合运动组可通过激活AMPK-FOXO3a 信号通路诱导自噬发生(Fan et al.,2017)。Kwon 等(2015)对注射氯喹制造肌肉降解的模型,进行分组对照组,氯喹注射组和氯喹注射+训练组(每周5 次注射+16 周训练),研究结果认为,氯喹注射+训练组最大携重能力抗阻训练后可以显著的提升,9 周抗阻运动有效阻止肌肉丢失和增强肌力,通过降低LC31/LC3-1比率,减少p62 蛋白水平,增加自噬调节蛋白,包括Beclin-1,ATG5127 和溶酶体。研究认为,利用氯喹诱导自噬能力损害,可通过抗阻运动得到改善,规律性的运动训练可以延缓肌肉衰减的发生,通过p62 蛋白加强自噬水平进而提高肌肉功能和力量。
综上所述,运动可提升动物模型及衰老个体的细胞自噬调节功能,自噬可为卫星细胞提供必需的物质,同时激活卫星细胞并参与增殖、迁徙、融合等过程。
2.2.3 运动可降低骨骼肌氧化应激水平
衰老将导致骨骼肌肌力和肌肉体积的下降,直接指向卫星细胞的老化,其中,损伤蛋白的集聚、线粒体功能失调、表观遗传学的改变、活性氧(Reactive oxygen species,ROS)代谢毒素的积累和DNA 损伤是衰老干细胞的标志(Oh et al.,2014)。Harman(1956)的“衰老自由基理论”认为,衰老导致的退行性疾病是由于细胞和组织持续的受到自由基的攻击造成的。
1)衰老会使卫星细胞ROS 水平增加(Szentesi et al.,2019):Bortoli 等(2003)提取不同年龄人体的卫星细胞进行基因表达分析,认为,不同年龄及不同增殖状态的卫星细胞的基因表达存在很大差异。衰老的卫星细胞中线粒体总量下降,产生的三磷酸腺苷(ATP)整体下降,且线粒体产生的ATP 远多于所需利用的ATP,研究还显示,衰老的卫星细胞增加超氧化物/线粒体质量和过氧化氢/线粒体质量的比率(Minet et al.,2012)。2)衰老的卫星细胞中抗氧化酶的活性下降:衰老导致卫星细胞中ROS 的异常积累,且发现过氧化氢酶和谷胱甘肽转移酶的抗氧化活性较年轻人显著降低(Fulle et al.,2005);Miller 等(2012)也证明,衰老小鼠骨骼肌中ROS 的显著增加,而谷胱甘肽水平下降,核因子E2 相关因子2(NF-E2-related factor 2,Nrf2-/-)抗氧化能力受损。Vettor 等(2009)认为,在衰老导致的高ROS 水平环境下,诱导卫星细胞向脂肪形成的表型转变,解释了Sarcopenia人群中脂肪组织增多的现象。
运动可促进衰老骨骼肌及卫星细胞活性氧的降低。Radak 等(2008)的研究认为,单次抗阻或简单的运动可降低机体中ROS,而中等强度或高强度运动会产生更多的活性氧,同时会刺激抗氧化酶的显著增加,因而总体ROS水平下降。Kuwahara 等(2010)为探索氧化应激对骨骼肌的病理意义,制作了骨骼肌特异性超氧化物歧化酶缺陷SOD2-/-小鼠,突变小鼠受到运动的干扰后,氧化损伤激增,ATP 含量下降现象。Abruzzo 等(2013)对2月龄大鼠进行14 周跑台运动(1 h/天,3 天/周),结果显示,抗氧化酶和氧化酶都显著增加,且发现,中等强度的训练可以诱导小鼠的ROS 适应。另外,离体实验也证明通过外源性抗氧化物的补给,可有效改善衰老卫星细胞的活性,减少线粒体相关的凋亡和细胞老化症状(Betters et al.,2008;Haramizu et al.,2017)。
综上,衰老骨骼肌中较高的ROS 水平将给予卫星细胞的生存和功能等造成不利的外在条件,但运动可以调控卫星细胞及微环境中的氧化和抗氧化水平,一方面运动增加了氧化应激水平,另一方面,运动积极诱导激活更多的抗氧化酶,因而起到下调衰老骨骼肌的ROS/RNS 水平,进而调控衰老骨骼肌。
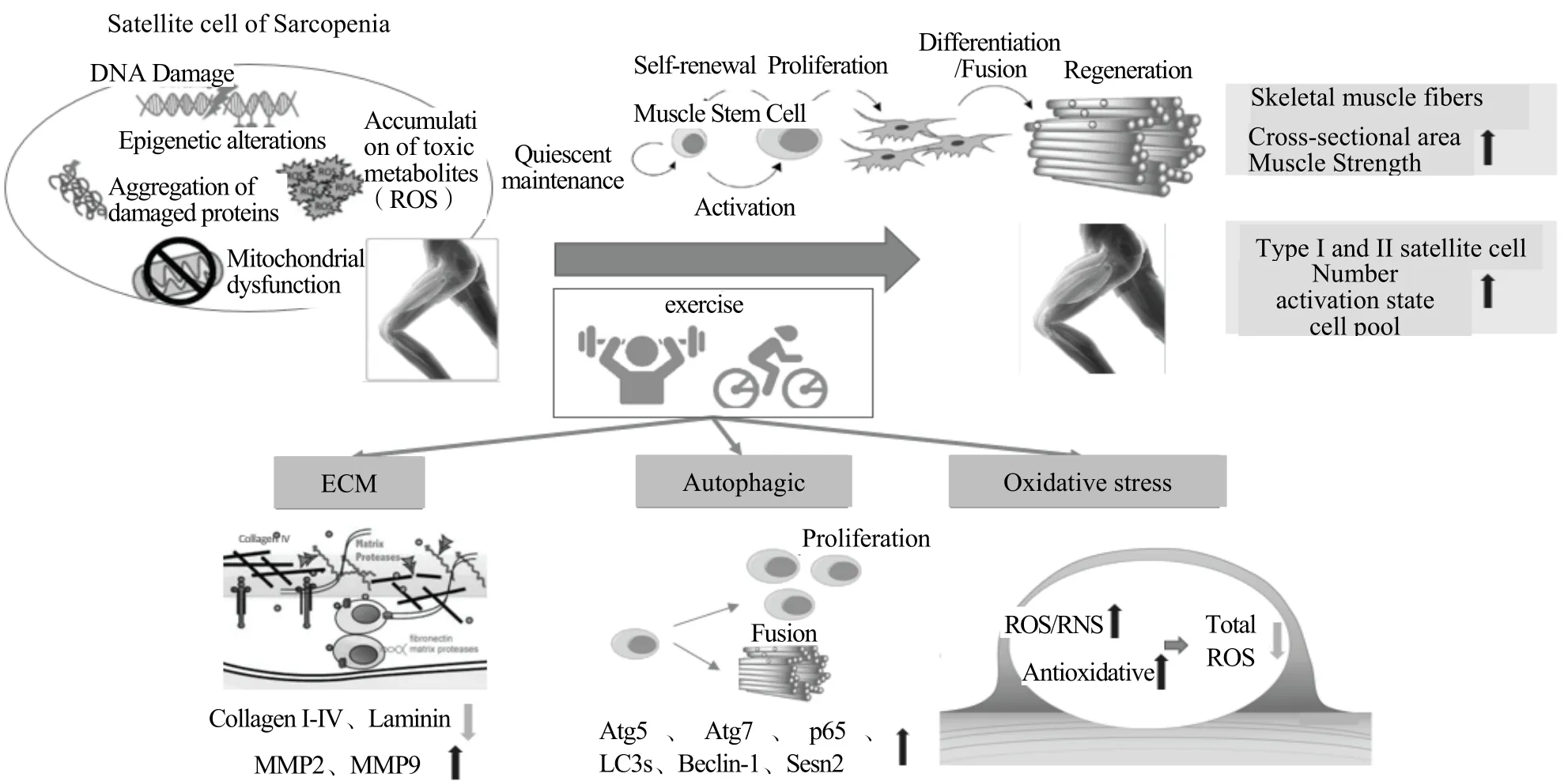
图2 运动通过激活卫星细胞功能延缓和改善Sarcopenia 的机制Figure 2.The Mechanism of Exercise in Delaying and Improving Sarcopenia by Activating Satellite Cell Function
3 小结
Sarcopenia 的主要表征为骨骼肌质量减少和肌力下降,衰老骨骼肌卫星细胞的老化/失活是造成Sarcopenia 的重要原因。运动可通过改善卫星细胞及微环境的变化(氧化还原、细胞外基质、细胞自噬),激活卫星细胞使其发挥自我更新和定向分化的干细胞功能,促进衰老骨骼肌的修复和骨骼肌肥大等现象的发生,最终可延缓和改善衰老机体Sarcopenia 的症状。
研究表明,实验对象年龄太大会导致卫星细胞难以激活,虽然衰老的卫星细胞可通过运动改善Sarcopenia,但过度衰老的动物或人类骨骼肌卫星细胞将出现不可逆转的转变,因此,建议及早进行运动干预,可有效激活卫星细胞预防/延缓和改善Sarcopenia 的症状。
