集胞藻缺氮驯化株的代谢组学分析
2019-09-19刘烨蓉许伟钊胡章立王江新雷安平
胡 浪,刘烨蓉,许伟钊,王 璐,胡章立,王江新,雷安平
深圳大学生命与海洋科学学院,广东深圳 518060
实验室驯化是指生物为适应人工环境而改变其遗传性状的过程[1].实验室驯化可被用来获得特殊的突变体,例如,通过实验室驯化,成功获得了丁醇耐受的蓝藻[2].另一方面,由于实验室条件可控,实验室驯化可以用来研究一些不适合在野外和其他复杂环境中研究的问题,如生物的“双面下注”策略[3]和适合度的动态变化[4].“双面下注”是高等生物在逆境条件下常采用的一种应对策略,它是指当存在灭种风险时,高等生物不会将种群延续的希望全寄托于某一特定类型的后代,而是将希望寄托于多种不同类型的后代[5].例如,一年生植物会产生推迟发芽和立即发芽两种不同类型的种子,立即发芽的种子能更快形成植株,而推迟发芽的种子则可以帮助植物顺利度过逆境时期[5].蓝藻是一类古老的原核生物,但它们能以类似于高等植物光合作用的方式固定二氧化碳[6],这类原核生物在受到胁迫时是否也会使用“双面下注”的策略来确保种群的延续,目前尚不清楚.
蓝藻可分为固氮蓝藻和非固氮蓝藻.氮元素是核酸、蛋白质等生物大分子的组成元素,它调控光合作用、生长与发育等多种生命过程,被称为生命元素[7-8].缺氮会影响农作物产量[9],研究长期缺氮胁迫对生物代谢的影响,对解析缺氮条件下的生物适应机制、开发氮利用率高的农作物具有重要意义.在受到缺氮胁迫时,固氮蓝藻可利用空气中的氮气来缓解缺氮环境带来的压力[10],因此,在研究缺氮胁迫对生物代谢的影响时,固氮蓝藻不能用作研究材料.非固氮蓝藻不能利用空气中的氮气,只能利用环境中的化合态氮,集胞藻Synechocystissp. PCC6803是非固氮蓝藻的模式生物,具有易于培养、繁殖快、遗传背景清晰、遗传操作简单等特点[11-12],是研究缺氮对生物代谢影响的适宜材料[13].然而,尚未见通过实验室驯化来获得能够耐受缺氮胁迫的集胞藻的报道.
代谢组可以提供有关生物代谢网络的信息.由于细胞内酶促反应的速率直接受代谢物浓度的调控,代谢组被认为比其他组学更能反映生物的生理变化[14].气相色谱-质谱(gas chromatography-mass spectrometry, GC-MS)可以同时检测氨基酸、脂肪酸和糖类等多种小分子,具有灵敏性高、选择性好等优点[15],常用于代谢组的检测. WANG等[14]利用GC-MS分析了多个Synechocystissp. PCC6803盐敏感突变体的代谢组,并成功鉴定了每个突变体的特异代谢模块,表明GC-MS能够用于解析蓝藻代谢组的变化.
本研究以非固氮蓝藻集胞藻Synechocystissp. PCC6803为实验材料,通过长达615 d的缺氮实验室驯化获得了8株缺氮驯化株.用GC-MS检测这些驯化株的代谢组,分析它们的代谢模式,以此探究蓝藻在缺氮条件下的进化规律.
1 材料与方法
1.1 藻株与培养条件
集胞藻Synechocystissp. PCC6803由中国科学院水生生物研究所淡水藻种库提供.培养温度为30 ℃,光照强度为30 μmol/(m2s),光暗周期比为12 h∶12 h,正常培养时选用BG11培养基(培养基含1.5 g/L NaNO3)[16],缺氮培养选用1/3 N BG11培养基(NaNO3的质量浓度调整为0.5 g/L)或1/20 N BG11培养基(NaNO3的质量浓度调整为0.075 g/L),无氮培养时选用-N BG11培养基(不含NaNO3).
1.2 缺氮条件下的实验室驯化
从野生型Synechocystissp. PCC6803固体平板上随机挑选1个单克隆,将其接种到液体BG11培养基中扩大培养,培养至对数生长期,将培养物分为9份,分别转移到12孔细胞培养板中培养,每个培养孔的体积为3 mL,其中8个作为缺氮驯化株,1个作为对照株. 缺氮驯化株和对照株来源于同一个单克隆,遗传背景相同.缺氮驯化株采用-N BG11培养基和1/3 N BG11培养基交替培养.培养开始时,730 nm处的光密度D(730)=0.05. 细胞先在-N BG11培养基中缺氮胁迫9 d,离心收集后转入1/3 N BG11培养基中培养6 d,如此反复.对照株始终用BG11培养基培养,转接时间与缺氮驯化株一致.每次转接后取部分样品镜检并用10%的二甲基亚砜冻存保种,若发现污染则舍弃所有当前批次样品,随后的驯化实验以最近一次保种的未受污染的样品继续进行.
1.3 生长曲线和比生长速率
培养时每两天测定一次培养物的D(730), 静置培养至平台期并绘制生长曲线.生长实验设置3个生物学重复.比生长速率的计算公式[17]为
(1)
其中,t2和t1为对数生长期中的两个给定的时间点;N2和N1为t1和t2对应的D(730), 用lnN与t作线性回归分析,回归直线的斜率即为比生长速率.
1.4 基于气相色谱-质谱的代谢组检测
将对照株和驯化株接种到1/3 N BG 11中,起始D(730)为0.05,培养12 d后显微计数,取1×108个细胞提取代谢组,用GC-MS对代谢组进行检测.实验设置3个生物学重复.代谢组的提取方法及GC-MS的检测条件参考文献[18].细胞经4 ℃、8 000 g离心收集,用双蒸水洗涤3次,加入1 mLV(甲醇)∶V(氯仿)∶V(水)=10∶3∶1的混合液,反复冻融5次后4 ℃、 15 000 g 离心3 min,收集上清液.取200 μL上清液与20 μL质量浓度为100 μg/mL的氘标记的琥珀酸(氘标记的琥珀酸用作GC-MS检测时的内标)混合,旋转真空干燥仪干燥后将沉淀溶于20 μL质量浓度为20 mg /mL的甲氧基胺盐酸盐,30 ℃孵育90 min后加入90 μL N-甲基-N-(三甲基硅基)三氟乙酰胺,37 ℃孵育30 min,最后4 ℃、15 000 g离心3 min得到衍生化的代谢物.衍生化的代谢物用配有HP-5MS毛细管柱(30m×250 mm)的7890A-MSD5975C系统检测.样品在230 ℃、无分流模式下进样.载气为氦气,流速控制在1 mL/min.毛细管柱首先在45 ℃恒温2 min,后升温至280 ℃,升温速率为5 ℃/min,最后280 ℃恒温2 min.采用自动质谱处理识别系统(automated mass spectral deconvolution identification system, AMDIS)对质谱峰进行分析.通过将数据与美国标准和技术研究所(national institute of standards and technology, NIST)的质谱库比对,来对化合物进行鉴定,最后去除匹配质量低(得分小于70)的化合物.本研究使用的代谢物分析为相对定量分析,代谢物的响应面积与内标(氘标记的琥珀酸)的响应面积的比值为代谢物的相对响应面积.
1.5 分层聚类分析
根据样品的代谢组用欧氏距离计算样品间的邻近矩阵,使用组间连锁的方法对样品进行分层聚类,分层聚类由SPSS20.0软件完成.
1.6 统计分析
采用Leveve法作方差齐性检验,采用SPSS20.0软件对样品的比生长速率进行单因素方差分析(one-way analysis of variance, One-way ANOVA),两两比较采用Student-Newman-Keuls法.
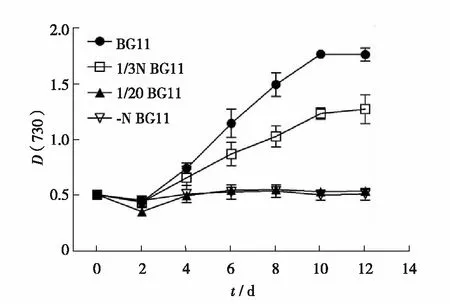
图1 集胞藻Synechocystis sp. PCC6803在不同氮浓度培养基中的生长曲线Fig.1 Growth curves of Synechocystis sp. PCC6803 in mediums with different nitrogen concentrations
2 实验结果及分析
2.1 实验室驯化氮浓度的选择
在进行实验室驯化之前,需要确定合适的氮浓度来进行驯化.野生型Synechocystissp. PCC6803在BG11培养基、1/3 N BG11培养基、1/20 N BG11培养基和-N BG11培养基中的生长曲线见图1.用BG11培养基培养Synechocystissp. PCC6803时,D(730)随培养时间的延长而增加,到12 d 时D(730)达到(1.76±0.06).当用1/20 N BG11培养基和-N BG11培养基培养时,D(730)不随培养时间的延长而增加,表明Synechocystissp. PCC6803不能在这两种培养基中生长.当用1/3 N BG11培养基培养Synechocystissp. PCC6803时,D(730)也随培养时间延长而增加,但增加幅度小于用BG11培养基培养.用1/3 N BG11培养基培养12 d 时,D(730)仅为(1.27±0.13),表明在1/3 N BG11培养基中,Synechocystissp. PCC6803能够生长,但生长受到抑制.为保证实验室驯化中Synechocystissp. PCC6803既能生长,又受到缺氮抑制,本研究选用1/3 N BG11培养基和-N BG11培养基交替培养藻细胞.
2.2 驯化株与对照株在缺氮胁迫条件下的生长
经过615 d的实验室驯化,获得了8株缺氮驯化株(NS1~NS8)和1株对照株(CT).为研究长期缺氮对集胞藻生长的影响,比较了驯化株和对照株在缺氮条件下(1/3 N BG11培养基)的生长(图2),对照株和驯化株在培养初期均没有明显的滞后期,它们均在第16 d达到各自的最大D(730). 图3显示了驯化株和对照株在1/3 N BG11培养基中的比生长速率,样品上方含相同字母表明样品间比生长速率无显著差异,不含相同字母表明样品间比生长速率差异显著.对照株在1/3 N BG11培养基中的比生长速率为0.23±0.01 /d,对照株与驯化株的比生长速率差异不显著(p>0.05). 驯化株的比生长速率在(0.22~0.24)/d,其中,NS1、NS2、NS3、NS7和NS8的比生长速率相对较高,NS4、NS5和NS6的比生长速率相对较低.驯化株NS1、NS7和NS8的比生长速率显著高于NS4、NS5和NS6(p<0.05), 驯化株NS6的比生长速率显著低于NS1、NS2、NS7和NS8(p<0.05)(图3).
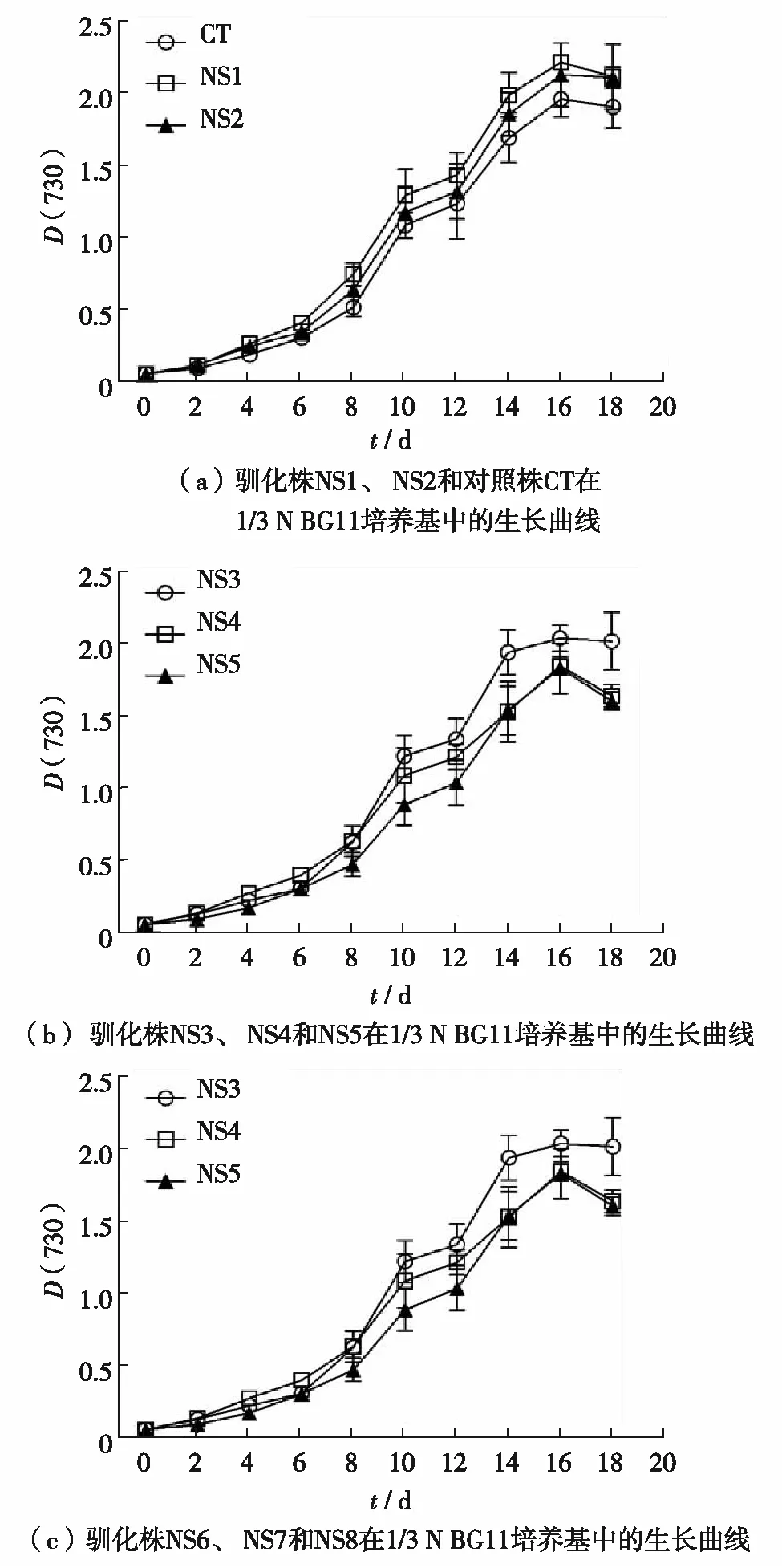
图2 驯化株(NS1-NS8)和对照株(CT)在1/3 N BG11培养基中的生长曲线Fig.2 Growth curves of nitrogen deficiency-generated strains (NS1-NS8) and control strain (CT) in 1/3 N BG11 medium
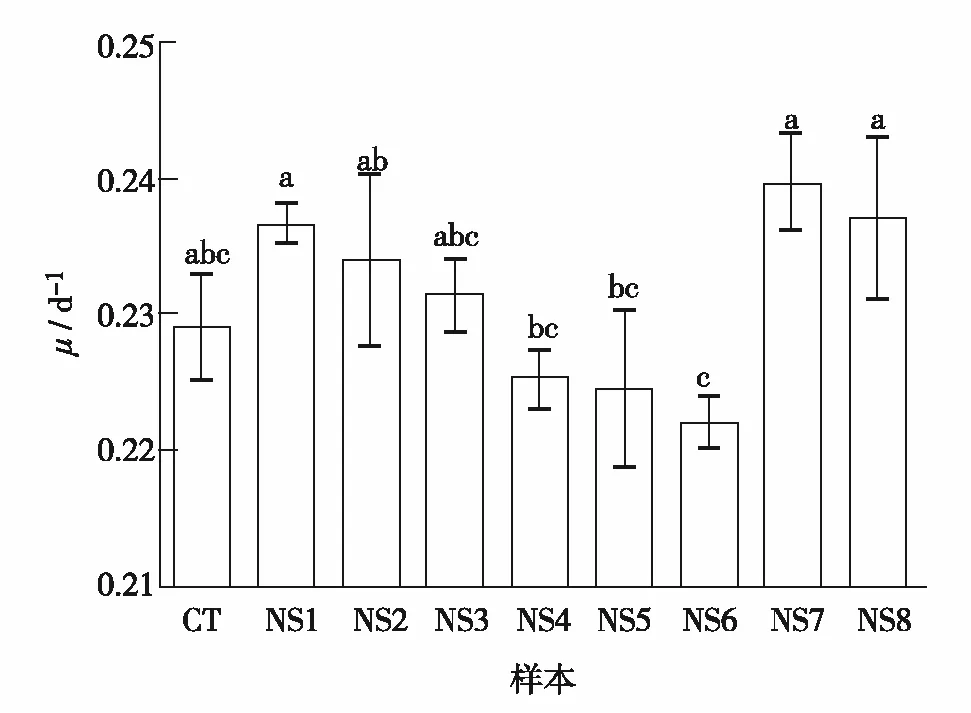
图3 驯化株(NS1-NS8)和对照株(CT)在1/3 N BG11培养基中的比生长速率(μ)Fig.3 Specific growth rates (μ) of nitrogen deficiency-generated strains (NS1-NS8) and control strain (CT) in 1/3 N BG11 medium
2.3 基于气相色谱-质谱的代谢组检测及分层聚类分析
为了研究长期缺氮对藻株代谢组的影响,利用GC-MS对这些藻株的代谢物进行了检测,共鉴定到52种代谢物,主要为氨基酸、脂肪酸、糖及其衍生物(代谢物的相对响应面积请扫描论文末页右下角二维码).对这些藻株进行分层聚类分析,以揭示藻株代谢组的相似性(图4).图4中样品用“-”把藻株和生物学重复间隔开,例如,CT-1代表对照株CT的第1个生物学重复,NS6-2代表驯化株NS6的第2个生物学重复.结果显示样品聚集形成3个聚类,其中比生长速率较高的驯化株NS1、NS2、NS3、NS7和NS8形成一个聚类(A簇),比生长速率较低的驯化株NS4、NS5和NS6形成一个聚类(B簇),对照株形成另外一个聚类(C簇),这些结果表明实验室驯化产生了两种代谢模式不同的驯化株.
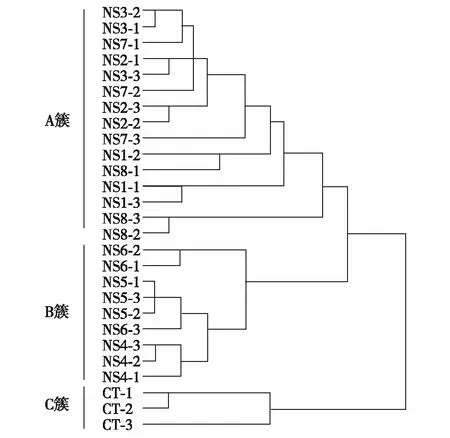
图4 以代谢组为基础的样品分层聚类Fig.4 Hierarchical cluster of samples based on their metabolic compositions
3 讨 论
本次实验室驯化共获得8个缺氮驯化株,所有驯化株的比生长速率与对照株无显著差异,表明长期缺氮驯化不会提高Synechocystissp. PCC6803的生长.然而,本课题组前期用含有丁醇的培养基驯化Synechocystissp. PCC6803,成功获得了丁醇耐受的驯化株[2].这两次实验室驯化效果不同可能是由选择压力不同所致,缺氮驯化株的生长没有提高,因此不会增加营养盐的消耗,推测在营养盐缺乏的环境下更有利于种群的延续.
GC-MS可以检测细胞内多种代谢物[15],因此能够用于发现代谢的细微变化.本研究利用GC-MS检测缺氮驯化株的代谢组时,共检测到52种代谢物,本课题组前期在Synechocystissp. PCC6803盐敏感突变株中检测到60种代谢物[14].这两项研究检测到的代谢物数量相当、种类相似,可能是因为它们使用的实验材料都是由野生型Synechocystissp. PCC6803衍生而来.
用分层聚类分析样品代谢组相似性时发现,虽然驯化株的比生长速率与对照株无显著差异,但驯化株的代谢组却不同于对照株,表明实验室驯化会对细胞代谢产生影响.另外,比生长速率较高的驯化株(NS1、NS2、NS3、NS7和NS8)的代谢组,不同于比生长速率较低的驯化株(NS4、NS5和NS6),表明实验室驯化最终产生了2种代谢模式不同的驯化株.缺氮胁迫下Synechocystissp. PCC6803形成不同代谢模式的后代,类似于逆境条件下,一年生植物产生不同类型的种子[5],表明蓝藻这类原核生物在受到胁迫时,也会使用“双面下注”的策略来确保种群的延续.野生型Escherichiacoli不能利用柠檬酸只能利用葡萄糖,与此类似,BLOUNT等[19]用缺乏葡萄糖但富含柠檬酸的培养基驯化E.coli, 最终也获得了两种不同代谢模式的驯化株(一种能高效利用葡萄糖,另外一种能利用柠檬酸).
本课题组曾经单细胞转录组测序发现缺氮胁迫会增加Synechocystissp. PCC6803细胞间基因表达的差异[20],推测在实验室驯化过程中,长期缺氮提高了细胞间基因表达的差异,最终产生了两种不同代谢模式的驯化株.解析不同代谢模式的遗传基础,则需进一步对驯化株进行基因组重测序,以便发现基因组层面上的差异[21];另外,缺氮胁迫会影响Synechocystissp. PCC6803的DNA甲基化修饰模式,利用DNA甲基化测序技术来探究驯化株的表观修饰变化也很有必要[22].
结 语
本研究表明Synechocystissp. PCC6803在应对长期的缺氮胁迫时,会产生不同代谢模式的后代,以此来增加种群延续的可能,该结果有助于增加对蓝藻缺氮胁迫下适应机制的理解.
