多孔Ti-45Nb合金的微观组织与力学性能研究
2019-09-18李永华
李永华,陈 楠
多孔Ti-45Nb合金的微观组织与力学性能研究
*李永华,陈 楠
(沈阳理工大学材料科学与工程学院,辽宁,沈阳 110159)
新型多孔Ti-Nb合金因为具有良好的生物相容性,在硬组织植入材料领域中受到关注。本文利用纯Ti和Nb粉采用粉末烧结法制备多孔Ti-45Nb合金。通过造孔剂NH4HCO3调控多孔钛合金的孔隙度、孔隙尺寸、孔隙形貌、弹性模量和抗压强度。研究结果表明:随着造孔剂含量的增加,多孔Ti-45Nb合金的孔隙度和孔隙尺寸增大,孔隙连通性增加;弹性模量和抗压强度减小。多孔Ti-45Nb合金的孔隙特性和力学性能满足硬组织植入材料的基本要求。
多孔Ti-Nb合金;孔隙特性;力学性能
0 引言
当今世界正处于科技突飞猛进的时代,人们的生活质量明显提升,而且日益长寿。某些人日渐增多的髋关节、牙根等人体硬组织替换治疗的需求促进了生物材料的研发。其中,医用金属材料如钛合金和不锈钢等因为强度、塑性和韧性以及耐蚀性好而得到更多的应用。但近年来的研究表明硬组织植入用金属材料的基本要求如下:第一,医用金属材料无细胞毒性。传统医用金属材料如Ti6Al4V合金在植入后会在体液中的氯离子等的腐蚀下析出或溶解出铝离子和钒离子,此类离子在体内可能会造成阿尔茨海默症、过敏和神经系统等疾病,即细胞毒性大。因此,最近学者们主要选用生物相容的无/低细胞毒性的金属元素如Mo、Nb、Ta、Zr、Sn等研发新材料。第二,医用金属材料与骨组织的力学性能相匹配,尤其是弹性模量接近。从表1可见,常规金属材料如Ti6Al4V和316L的弹性模量明显高于松质骨和密质骨的弹性模量。此时,过高弹性模量的金属植入物在受力过程中将承担大多数的载荷,而临近的骨组织基本或较少承载。会引起骨组织的吸收和骨质疏松等问题。因此学者们热衷于开发低弹性模量的钛合金。如Ti-29Nb-13Ta-4.6Zr、Ti-15Mo、Ti-12Mo-6Zr-2Fe合金的弹性模量明显低于常规钛合金和不锈钢材料,但仍明显高于骨组织的弹性模量[1-8]。目前有效降低医用金属材料的弹性模量的方案为将孔隙结构与金属材料相结合,即医用多孔金属材料。其中选用生物相容性优良的合金元素开发医用多孔钛合金成为研究热点。如多孔Ti-10Mo、Ti-16Sn-4Nb合金与骨组织的弹性模量接近[9-16]。多孔Ti-Nb合金的制备方法有粉末烧结(Ti-40Nb)[11]、凝胶注模成型(Ti-(10-35)Nb)[12]、选择性激光烧结(Ti-40Nb)[13]、激光烧结(Ti-23Nb)[14]、脱合金法(Ti-17Nb)[15]等。

表1 医用金属和骨骼的弹性模量
其中,与其他方法相比,粉末烧结法具有简便易行、成本低、孔隙度范围宽等特点。研究表明:该合金有较好的耐蚀性和生物相容性。已有报道多数集中于铌含量低于40%的多孔Ti-Nb合金[11-17]。本文采用粉末烧结法制备多孔Ti-45Nb合金,并研究孔隙度、孔隙尺寸和孔隙形貌、相组成和力学性能。
1 实验方法
选用中位径粒度分别为63.32mm和78.20mm的商用Ti和Nb粉末,粒度分布曲线分别如图1和图2所示。按质量配比Ti-45wt.%Nb称取Ti和Nb粉并在混料器中充分混合24 h。选取粒度小于300mm的碳酸氢铵NH4HCO3颗粒为造孔剂,按总质量比为15%、25%、35%的比例与金属混合粉末混合6 h。而后在模具中压制生坯。在流动氩气保护下置于烧结炉中加热至200 ℃保温2 h,待造孔剂分解逸出后,继续加热至1180 ℃并保温4 h,冷却即可得到多孔Ti-45Nb合金。利用线切割机床切取试样并清洗后备用。采用扫描电电子显微镜(SEM)观察试样微观结构。利用X射线衍射仪(XRD)测定物相。利用材料试验机进行压缩实验,试样尺寸为F10 mm´10 mm,测定力学性能。
图1 钛粉的粒度分布曲线
图2 铌粉的粒度分布曲线
2 结果与讨论
2.1 物相
添加35 wt.%的NH4HCO3造孔剂烧结而成的多孔Ti-45Nb合金的X射线衍射图谱如图3所示。可见主相为b相,对应的衍射峰很强,而次相为a相,对应的衍射峰很弱。衍射图谱中无其他相存在,表明:造孔剂的添加对于多孔Ti-45Nb合金的物相没有影响。
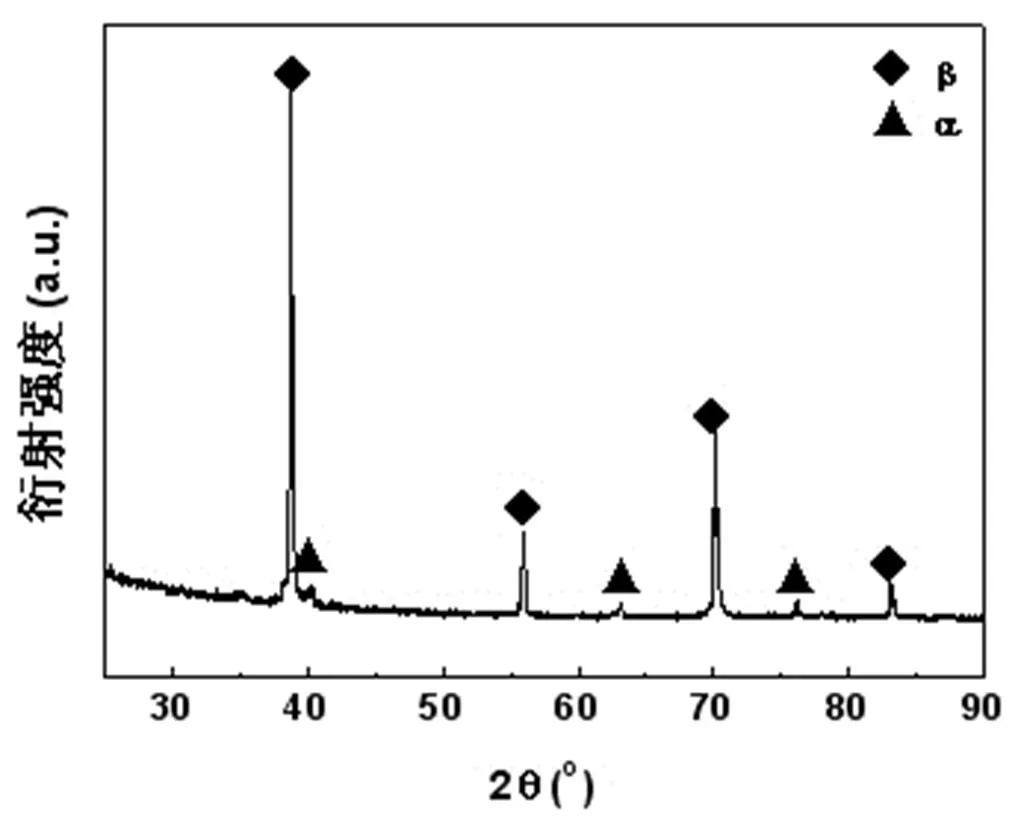
图3 多孔Ti-45Nb合金的X射线衍射图谱
造孔剂NH4HCO3在200 ℃左右加热,如式(1)所示,分解为气体,并逸出坯料。在原造孔剂处留下孔隙,造孔剂具有“遗传性”。孔隙与造孔剂的形貌密切相关。
NH4HCO3=NH3+CO2+H2O(1)
2.2 孔隙特性
添加不同含量的NH4HCO3造孔剂烧结而成的多孔Ti-45Nb合金的孔隙形貌的扫描电子显微镜照片如图4所示。添加15wt.%的造孔剂的多孔钛合金的孔隙形貌如图4(a)所示,可见孔隙分散,连通性较小,孔隙形貌不规则,这是因为不规则形状的造孔剂NH4HCO3颗粒的遗传性所致。当造孔剂含量增加到25%时,从图4(b)所示的孔隙形貌可见,孔隙尺寸增大,而且孔隙出现了部分连通。当造孔剂含量进一步增加到35%时,孔隙形貌如图4(c)所示,孔隙尺寸略有增大,而孔隙的连通性明显增加。由图像分析得到,图4(a)中所示的椭圆形框内的孔隙尺寸多数大于100mm,为大孔。此类100~600mm的大孔有助于骨组织的长入、体液和养分的输运,植入物能够牢固地固定[3]。图4(a)中所示的矩形框内的孔隙尺寸多数介于20~70mm,为小孔,有利于羟基磷灰石以及蛋白质等的附着,从而改善多孔材料的生物相容性。多孔Ti-45Nb合金的平均孔隙尺寸如表2所示,可见随着添加造孔剂的含量由15%增加到25%,孔隙尺寸明显增大,当增加到35%时,孔隙尺寸变化不大,这是由于造孔剂含量增大到一定程度,连通孔隙增大所致。

(a) 15%; (b) 25%; (c) 35%
按照公式(2)测定多孔Ti-45Nb合金的孔隙度
= [1-/s]´100% (2)
其中和s(5.73 g/cm3)分别为多孔和致密态Ti-45Nb合金的密度。
如表2所示,多孔Ti-45Nb合金的孔隙度随着造孔剂含量的增加而明显增大。
因此,通过添加造孔剂可控制多孔Ti-45Nb合金的孔隙度、孔隙尺寸以及孔隙形貌。
可见多孔Ti-45Nb合金的孔隙尺寸大于100mm,而且孔隙度大于41.6%的多孔钛合金的孔隙连通性较好。满足多孔植入材料的孔隙特性要求。
表2 多孔Ti-45Nb合金的孔隙度和平均孔隙尺寸
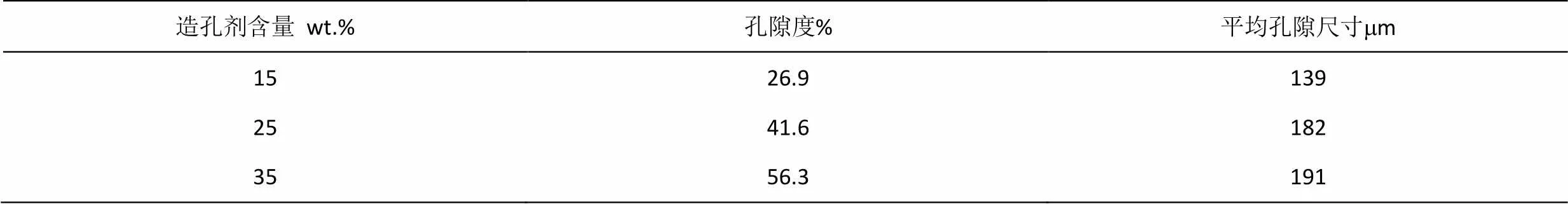
Table 2 Porosity and average pore size of porous Ti-45Nb alloy
2.3 力学性能
不同孔隙度的多孔Ti-45Nb合金的压缩应力应变曲线如图5所示,可见不同孔隙度的多孔Ti-45Nb合金的压缩试验曲线由弹性变形、塑性变形和断裂阶段构成。其中弹性变形阶段中孔隙的孔壁部分发生弹性变形。随着应力的增加,孔壁部分发生塑性变形、弯曲,孔隙产生明显的剧烈变形。最后孔壁部分发生断裂,多孔材料产生相应的断裂现象[4]。其中曲线的最大应力为抗压强度。从表3可见,多孔Ti-45Nb合金的抗压强度随着孔隙度的增加而明显降低。这是因为孔隙度增大意味着多孔材料的实际“有效”承载面积的降低,造成强度的明显降低。松质骨的抗压强度为1~100MPa范围内,多孔Ti-45Nb合金与松质骨的抗压强度匹配。
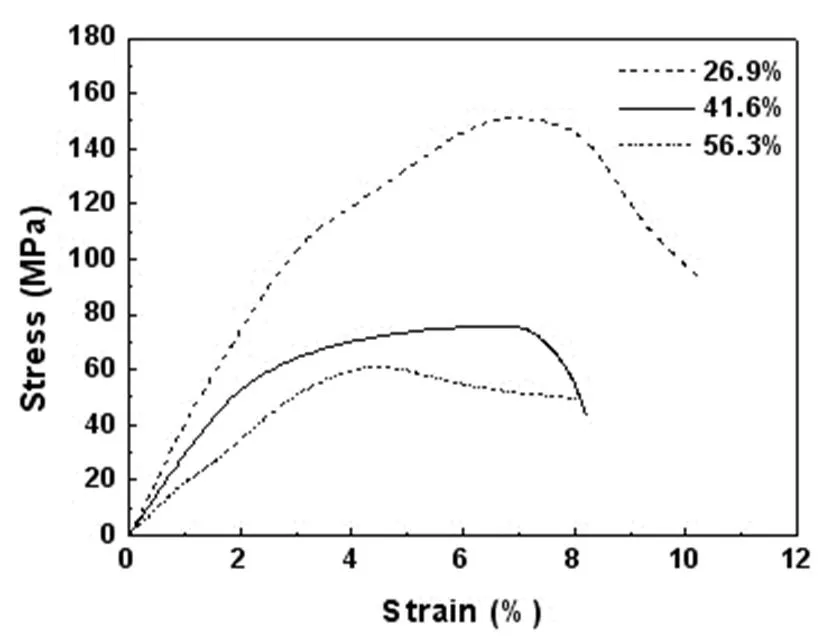
图5 多孔Ti-45Nb合金的压缩应力应变曲线
多孔Ti-45Nb合金的弹性模量通过分析压缩应力应变曲线的弹性段的斜率而获得,如表3所示,弹性模量随着孔隙度的增大而降低。多孔Ti-45Nb合金的弹性模量在1.93~3.98GPa范围内,与表1所示的松质骨的弹性模量相匹配。
因此,多孔Ti-45Nb合金有望成为理想的硬组织植入材料。
表3 多孔Ti-45Nb合金的弹性模量和抗压强度
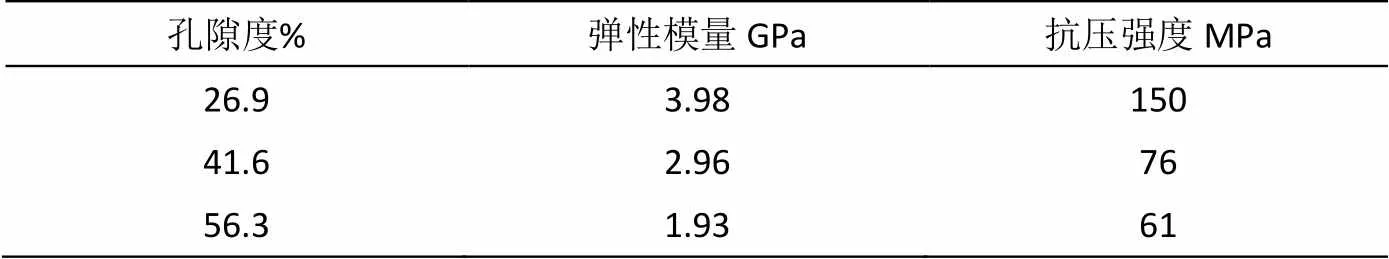
Table 3 Elastic modulus and compression strength of porous Ti-45Nb alloy
3 讨论
a)Ti-45Nb合金可利用粉末烧结法制备。
b)NH4HCO3造孔剂可调控多孔Ti-45Nb合金的孔隙度、孔隙尺寸、孔隙形貌以及弹性模量和抗压强度。
c)度为41.6%~56.3%的多孔Ti-45Nb合金的平均孔隙尺寸为182~191mm,孔隙连通性好;抗压强度为61~76MPa,弹性模量为1.93~2.96GPa。满足硬组织多孔植入材料的孔隙特性和力学性能的基本要求。
[1] Chen Q,Thouas G A. Metallic implant biomaterials[J]. Materials Science and Engineering: R: Reports, 2015(87): 1-57.
[2] Geetha M, Singh A K, Asokamani R, et al.Ti based biomaterials, the ultimate choice for orthopedicimplants- A review[J]. Progress in Materials Science, 2009 (54):397-425.
[3] Suchanek W, Yoshimura M. Processing and properties of hydroxyapatite based biomaterials for use as hard tissue replacement implants [J]. Journal of Materials Research, 1998 (13): 94-117.
[4] Gibson L J. The mechanical behavior of cellular bone [J]. Journal of Biomechanics, 1985 (18): 317-328.
[5] Matsumoto H, Watanabe S, Hahada S. Microstructures and mechanical properties of metastablebTiNbSn alloys cold rolled and eat treated [J]. Journal of Alloys and Compounds, 2007 (439): 146-155.
[6] Atapour M,Pilchak A L,Frankel G S, et al. Corrosion behavior of β titanium alloys for biomedical applications [J]. Materials Science and Engineering: C, 2011,31(5): 885-891.
[7] Harun W S W,Kamariah M S I N,Muhamad N, et al. A review of powder additive manufacturing processes for metallic biomaterials [J]. Powder Technology, 2018 (327): 128-151.
[8] Mohammed M T. Mechanical Properties of SLM- Titanium Materials for Biomedical Applications: A Review [J]. Materials Today: Proceedings, 2018, 5(9): 17906-17913.
[9] Xie F, He X, Lu X, et al. Preparation and properties of porous Ti-10Mo alloy by selective laser sintering [J]. Materials Science and Engineering: C, 2013 (33): 1085-1090.
[10] Nouri A, Hodgson PD,Wen C E. Effect of process control agent on the porous structure and mechanical properties of a biomedicalTi–Sn–Nb alloy produced by powder metallurgy [J]. Acta Biomaterialia, 2010 (6): 1630-1639.
[11] Zhuravleva K, Müller R, Schultz L, et al. Determination of the Young’s modulus of porousb-type Ti–40Nb by finite element analysis [J]. Materials and Design, 2014 (64):1-8.
[12] Yang D,Guo Z,Shao H,et al. Mechanical properties of porous Ti-Mo and Ti-Nb alloys for biomedical application by gelcasting[J]. Procedia Engineering, 2012 (36): 160-167.
[13] Zhuravleva K, Bönisch M, Prashanth K G, et al. Production of porous β-type Ti–40Nb alloy for biomedical applications: comparison of selective laser melting and hot pressing [J]. Materials, 2013(6): 5700-5712.
[14] Ibrahim M K,Hamzah E, Saud S N, et al.Parameter optimization of microwave sintering porous Ti-23%Nb shape memory alloys for biomedical applications [J]. Transactions of Nonferrous Metals Society of China, 2018,28(4): 700-710.
[15] Okulov I V, Okulov A V, Volegov A S, et al. Tuning microstructure and mechanical properties of open porous TiNb and TiFe alloys by optimization of dealloying parameters [J]. ScriptaMaterialia, 2018 (154): 68-72.
[16] Fojt F, Joska L, Málek J. Corrosion behavior of porous Ti-39Nb alloy for biomedical applications [J]. Corrosion Science, 3013 (71): 78-83.
[17] Andrade D P, Vasconcellos LMR, Carvalho ICS, e tal. Titanium-35niobium alloy as a potential material for biomedicalimplants: In vitro study [J]. Materials Science and Engineering C, 2015 (56): 538-544.
research on microstructure and MECHANICAL Property of porous Ti-45Nb alloy
*LI Yong-hua, CHEN Nan
(School of Materials Science and Engineering, Shenyang Ligong University, Shenyang, Liaoning 110159, China)
New type porous Ti-Nb alloy has drawn much attention in the field of hard tissue implant material due to good biocompatibility. In this paper, porous Ti-45Nb alloy is prepared by powder sintering from pure Ti and Nb powders. Porosity, pore size, pore morphology, elastic modulusand compressive strength of the porous titanium alloy can be controlled by the adding amount of pore forming agent NH4HCO3.The research results indicate that porosity, pore size and pore connectivity increase while elastic modulus and compressive strength decrease with the increase of pore forming agent amount. The pore features and mechanical property of porous Ti-45Nb alloy meet the preliminary requirements of hard tissue implant.
porous Ti-Nb alloy; pore characteristics; mechanical property
TG146
A
10.3969/j.issn.1674-8085.2019.05.013
1674-8085(2019)05-0067-05
2019-05-21;
2019-07-06
辽宁省教育厅科技项目(LG201612)
*李永华(1970-),男,辽宁丹东人,教授,博士,主要从事金属功能材料研究(Email: yhlicn@163.com);
陈 楠(1994-),男,辽宁沈阳人,硕士生,主要从事金属功能材料研究(Email: 1587809030@qq.com).
