油樟叶精油不同馏分化学成分及其抗氧化能力评价
2019-09-18胡文杰朱立成殷帅文周升团
胡文杰,朱立成,殷帅文,周升团
油樟叶精油不同馏分化学成分及其抗氧化能力评价
*胡文杰,朱立成,殷帅文,周升团
(井冈山大学生命科学学院,江西,吉安 34009)
采用减压分馏的方法对油樟叶精油进行分馏,结合GC-MS联用技术研究油樟叶精油及其不同馏分的化学成分,并对其清除1,1-二苯-2-三硝基苯肼(DPPH)自由基能力进行了评价。结果表明:油樟叶精油及其不同馏分中的化学成分及其含量差异较显著。从油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)中分别鉴定出29、15、20和31种物质,共鉴定出31种化合物,包括烃类21种、醇类8种、酮类和酯类各1种,它们的共有成分有15种,此外还检测到一些特有成分,油樟叶精油(A0号精油)14种、馏分A2号精油5种、馏分A3号精油16种。油樟叶精油及其不同馏分均有清除DPPH 自由基能力,它们的抗氧化活性能力强弱顺序为 A3> A2> A0> A1。但它们清除能力均低于同质量浓度的维生素C。本研究结果为油樟叶精油有效成分的进一步分离纯化及其资源开发利用可以提供理论依据。
单宁;油樟;分馏;气相色谱-质谱;抗氧化
油樟((Gamble)N.Chao)是樟科(Lauraceae)樟属()常绿高大阔叶乔木,也是中国特有的重要的经济作物,已被列为国家二级重点保护野生植物[1]。该植物主产于四川宜宾,在江西、湖南、湖北、广西等地均有分布[2]。油樟的叶、枝、根、花和果等部位均富含芳香精油,它是香料、食品、医药、日化产品的重要原料来源[3]。
目前国内外学者对油樟的研究主要集中于化学成分[4-8]、抗菌[9-10]、抗炎[11-12]、镇痛[13]和抗癌[14]活性等方面。虽然有油樟精油的化学成分的相关报道,但针对油樟叶精油各馏分以及抗氧化活性的评价尚未见报道。油樟叶精油中的化学成分复杂,多为倍半萜和二萜类化合物,具有沸点高、高温下易氧化等特点,加热时间过长可能会引起分解与转化,进而影响其药理药效,同时油樟叶精油中同分异构体也较多,理化性质极为相近,因此,寻找与其药理药效功能相吻合的有效成分并分离纯化是研究的关键[15]。传统有效成分的分离多用结晶法、柱层析等方法,这些分离方法工序繁琐。本研究以油樟为研究材料,对其叶精油采用减压分馏得到不同温度的馏分,并利用气-质联用仪技术(GC-MS)对油樟叶精油及其馏分进行化学成分分析及其抗氧化活性研究,以期为油樟这种特有的经济树种资源开发利用奠定一定基础。
1 材料与方法
1.1 主要仪器与试剂
ShimadzuGCMS-QP2020 气相色谱-质谱联用仪、电子轰击电离源EI、Rxi-5Sil MS(30 m × 0.25 mm × 0.25 μm)色谱柱:日本岛津公司。1,1-二苯-2-三硝基苯肼(DPPH):上海鲁汶生物科技有限公司;无水硫酸钠、无水乙醇等试剂均为AR,购自于南京化学试剂有限公司;维生素C,购自于美国 Sigma公司。
1.2 方法
1.2.1 油樟叶精油的提取
称取油樟鲜叶样品200 g,放入圆底烧瓶中,加入一定量的蒸馏水,采用水蒸气蒸馏法提取2 h,收集精油,用无水硫酸钠干燥,得到淡黄色透明液体,4 ℃冷藏,备用,标注为A0号精油,其得油率约为1.92%。
1.2.2 油樟叶精油的分馏
采用分馏装置,经预试验结果可知,对1.2.1所得的精油进行减压分馏(-0.073 MPa),收集到三种不同温度下的精油馏分,分别为:沸程小于60 ℃的馏分,标注为A1号精油;沸程在60~100 ℃之间的馏分,标注为A2号精油;沸程在100~150 ℃的馏分,标注为A3号精油。
1.2.3 油樟叶精油及其馏分的GC-MS条件
气相色谱条件:Rxi-5Sil MS(30 m × 0.25 mm × 0.25 μm)石英毛细管柱,起始温度 50 ℃,保留 2 min,以8 ℃·min-1升温至 160 ℃,保持0 min,以 8℃·min-1升温至 250 ℃,保持 15 min至完成分析;载气为 He,流速 1.0 mL·min-1,进样量 0.5 μL,分流比 20:1。
质谱条件:电离方式EI,电子能量70 eV;离子源温度200 ℃,进样口温度 250 ℃,扫描范围m/z 60~350。
1.2.4 油樟叶精油及其馏分对DPPH自由基清除作用
油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)分别用无水乙醇配制成2、4、6、8、10 mg․mL-1不同浓度梯度的待测液,备用。配制 0.1 mmol /L 的 DPPH 无水乙醇溶液,量取 3 mL 于试管中,然后加入 1 mL 不同浓度的精油样液,立即混匀,于室温条件下避光放置30 min,于517 nm 波长下测定吸光值A;以无水乙醇代替精油样液,测定吸光值A0。用相同浓度的抗坏血酸水溶液作为阳性对照,每组平行 3 次。DPPH 自由基清除率的计算公式:清除率= [(A0-A)/A0]×100%
1.2.5 数据处理及质谱检索
将实验样品用气相色谱-质谱(GC-MS)分离出的组分,采用Nist谱库、文献检索和人工解析等联合方法,鉴定、确认各成分,采用峰面积归一法计算出各成分的相对百分含量。
2 结果与分析
2.1 各馏分占油樟叶精油量总体积的百分比
由图1可知,通过减压分馏,分离后的油樟叶精油100~150 ℃的馏分(A3号)所占的比例最大;60~100 ℃之间的馏分(A2号)次之;60 ℃以下的馏分(A1号)所占的比例最少。

图1 各馏分占总精油量的体积百分比
2.2 油樟叶精油及其各馏分化学成分分析
按照1.2.3所描述的实验方法,对油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)进行气相色谱-质谱联用技术分析,得到其总离子流图2。通过GC-MS分析,经检索、解析和文献查对,本试验从油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)中分别鉴定出29、15、20和31种挥发性成分,共鉴定出31种化合物,各平均值分别占精油总量的99.85%、99.94%、99.96%和 99.79%。这些化合物中烃类有21种、醇类有8种、酮类和酯类各1种(表1)。
由表1和表2可知,油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)的化学组分差异较显著。油樟叶精油及其所得到的馏分中共同含有的成分有15种,除此之外,油樟叶精油(A0号精油)中还检测到14种化合物,其中烃类7种、醇类6种、酮类1种;馏分A2号精油还检测到5种化合物,其中醇类4种、酮类1种;馏分A3号精油还检测到16种化合物,其中烃类8种、醇类6种、酮类1种、酯类1种。

时间(min) (A1)时间(min) (A2) 时间(min) (A3)时间(min) (A0)

表1 油樟叶精油及其各馏分化学成分及其相对含量
注:“─”表示未检测出,下同
2.2.1 烃类化合物
油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)中烃类化合物种类数及总相对百分含量差异较显著。从油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)中分别鉴定出烃类化合物20、13、13和21种。馏分A1号精油和A2号精油的烃类化合物种类数相等,与馏分A3号精油中烃类化合物种类数相差较大。各馏分中烃类化合物总相对含量的平均值在27.12%~65.82%波动,馏分A1号精油中烃类化合物相对百分含量的平均值较高,达到为65.82%,馏分A2号精油次之,含量为47.74%,馏分A3号精油最低,含量为27.12%,说明油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)中烃类化合物总相对百分含量差异极为显著。在烃类化合物中,A0号精油中4(10)-侧柏烯(12.75%)、-蒎稀(5.06%)和-蒎烯(3.55%)的相对百分含量的平均值较高,经过减压分馏后,A3号精油中4(10)-侧柏烯(9.93%)、-蒎稀(2.56%)和-蒎烯(2.80%)的相对百分含量的平均值均减少,说明这些物质在其他馏分中大部分已被分离。
2.2.2 醇类化合物
从油樟叶精油(A0号精油)及其所得到的馏分(A1号精油、A2号精油、A3号精油)中共鉴定出8种醇类化合物。A0号精油、A1号精油、A2号精油和A3号精油中的醇类化合物种类数分别为8、2、6和8种。此外,A0号精油、A1号精油、A2号精油和A3号精油中的醇类化合物总相对百分含量的平均值分别为66.81%、34.12%、52.17%和72.41%,A3号精油中的醇类化合物总相对百分含量的平均值约是A1号精油中的2.12倍。在醇类化合物中,A0号精油中的1,8-桉叶油素(50.96%)、-松油醇(11.44%)和松油烯-4-醇(3.58%)经过减压分馏后,在A3号精油中其相对百分含量的平均值均增大,分别为52.29%、14.54%和4.51%,说明这些化合物减压分馏后,在A3号精油中得到更好地分离和富集。
2.2.3 酮类和酯类化合物
除了上述烃类和醇类化合物外,本试验还检测到酮类和酯类化合物。酮类化合物仅有1种,即樟脑,此化合物在A0号精油、A2号精油和A3号精油中检测到,且相对百分含量的平均值极低,而A1号精油尚未检测到。酯类化合物也仅有1种,即乙酸冰片酯(0.03%),此化合物在A0号精油、A1号精油和A2号精油中尚未检测到,在A3号精油中已检测到但含量极低。
2.3 油樟叶精油及其各馏分主要成分分析
由表2可知,油樟叶精油及其各馏分由各类挥发性物质组成,且精油化合物组成类型、种类及其含量有所不同。其中醇类物质是油樟叶精油(A0号精油)及其馏分(A1号精油、A2号精油、A3号精油)的主要成分,各平均值分别占精油总量的66.81%、34.12%、52.17%和72.41%;其次是烃类物质,各平均值分别占精油总量的32.86%、65.82%、47.74%和27.12%。此外,油樟叶精油及其各馏分还含有少量酮类、酯类等其他化合物。

表2 油樟叶精油及其馏分各类成分的组成
从表3中可以看出,油樟叶精油(A0号精油)及其馏分(A1号精油、A2号精油、A3号精油)中主要组成成分(相对百分含量>1%)分别有11、6、8和12种,各平均值分别占精油总量的94.80%、96.60%、95.49%和95.15%;A0号精油中含量较高的化合物依次为1,8-桉叶油素、4(10)-侧柏烯、-松油醇、-蒎稀、松油烯-4-醇、-蒎烯、-萜品烯、(+)-4-蒈烯、-月桂烯、2-甲基-5-(1-甲基乙基)-双环[3.1.0]-2-己烯和石竹烯;馏分A1号精油中的主要成分依次为1,8-桉叶油素、4(10)-侧柏烯、-蒎稀、2-甲基-5-(1-甲基乙基)-双环[3.1.0]-2-己烯、-蒎烯和-月桂烯;馏分A2号精油中的主要成分依次为1,8-桉叶油素、4(10)-侧柏烯、-蒎稀、-蒎烯、2-甲基-5-(1-甲基乙基)-双环[3.1.0]-2-己烯、-月桂烯、(+)-4-蒈烯和-萜品烯;馏分A3号精油中的主要成分依次为1,8-桉叶油素、-松油醇、4(10)-侧柏烯、松油烯-4-醇、-蒎烯、-蒎稀、-萜品烯、石竹烯、(+)-4-蒈烯、-月桂烯、大根香叶烯B和D-柠檬烯。由此可见,1,8-桉叶油素是油樟叶精油(A0号精油)及其馏分(A1号精油、A2号精油、A3号精油)中的绝对主导成分。

表 3 油樟叶精油及其馏分的主要组成成分(相对含量>1%)
注:“─”表示未检测出;“▲”表示相对百分含量低于1%
2.4 油樟叶精油及其各馏分抗氧化活性评价
从油樟叶精油(A0号精油)及其馏分(A1号精油、A2号精油、A3号精油)的DPPH自由基清除率数据(表4和图3)可知,清除率均随样品质量浓度的增加而增加,呈现出良好的量效关系。分别得到精油及其各馏分的浓度(x)与清除率(y)的回归方程(表4),IC50(清除率为50%时样品的浓度)分别为3.27 mg·mL-1、7.37 mg·mL-1、2.44 mg·mL-1和2.18 mg·mL-1。因此,油樟叶精油及其各馏分均有DPPH自由基清除能力,它们的抗氧化活性能力强弱依次为A3> A2> A0> A1。
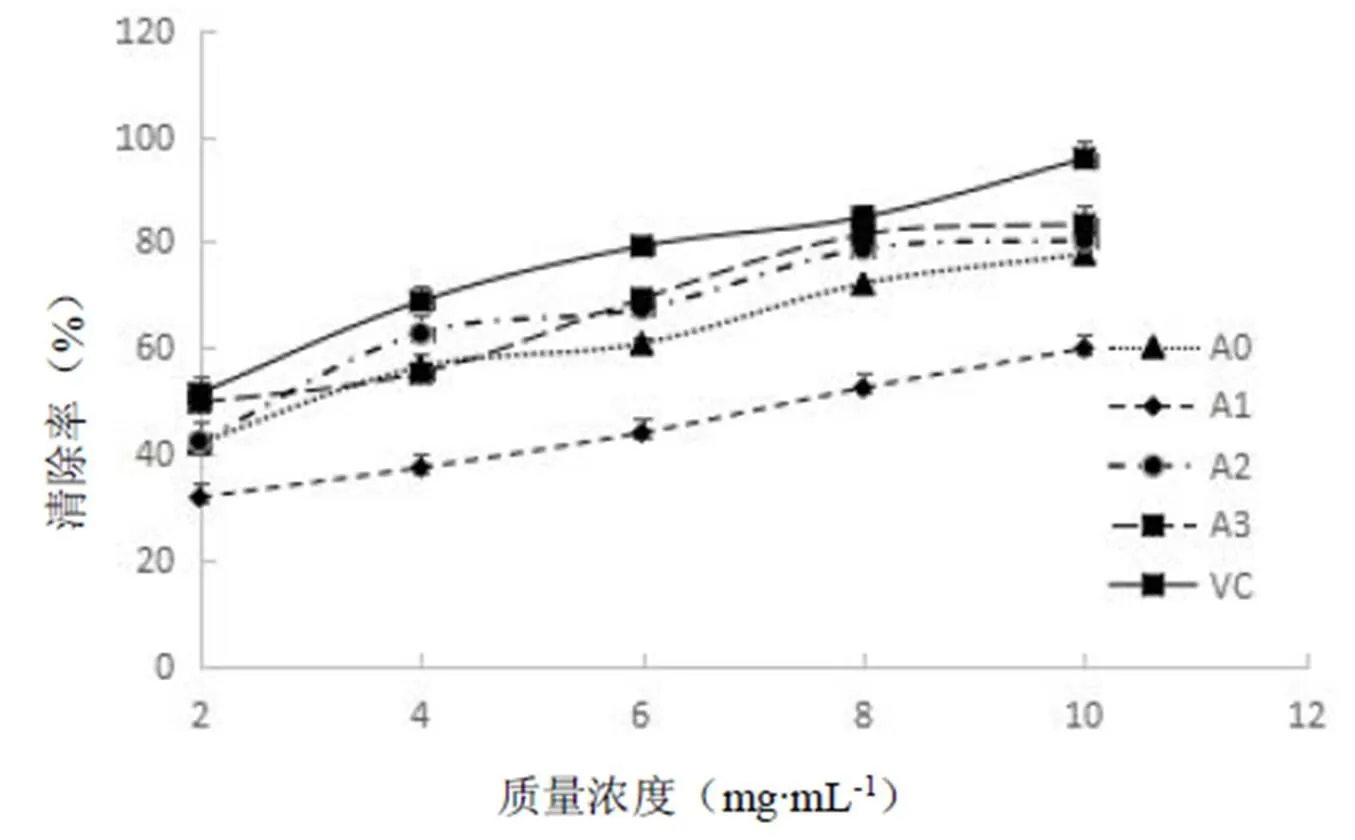
图3 精油及其馏分对DPPH自由基清除作用

表4 油樟叶精油及其馏分相对含量、回归方程及其DPPH自由基清除率的IC50
3 讨论
本试验采用水蒸气蒸馏法提取油樟叶的精油,并通过减压(-0.073 MPa)分馏得到三种不同温度(60 ℃以下、60~100 ℃、100~150 ℃)馏分,通过GC-MS联用技术对其化学成分进行分离鉴定,共检测出31种化合物。油樟叶精油及其馏分种类较少,以烃类、醇类为主,酮类和酯类相对较少。油樟叶精油及其馏分中含量较高成分有1,8-桉叶油素、-蒎稀、-松油醇、4(10)-侧柏烯等。黄远征等[4]分析了油樟叶芳香油的化学成分,鉴定出28个成分,以1,8桉叶脑、α-萜品醇、香桧烯等化合物为主。可见油樟叶精油及其馏分主要化合物存在一定差异,这可能是由于种源、采样时间等原因造成的。
油樟叶的精油化学成分复杂,多为萜类化合物,有些化学成分具有沸点高、高温下易氧化等特点。本实验油樟叶的精油不同馏分中所含的化学成分的种类及其百分含量有较大差别,即使各馏分中相同的物质,其含量也不同;各个温度馏分中,1,8-桉叶油素相对含量均较高,尤其是在100~150 ℃馏分中,1,8-桉叶油素相对含量达到了52.29%;但-松油醇相对含量却反之,在油樟叶中一般-松油醇相对含量较高,但经过减压分馏后仅在馏分A3中检测到,A1和A2却未检测到,说明减压分馏对某些化学成分除了具有富集作用外,还会由于温度高等因素的影响,化学成分之间存在相互转化等作用。
油樟叶精油及其馏分中含有多种具有应用价值的化学成分,如1,8-桉叶油素是油樟叶精油及其馏分的主要成分,可用作香料、抗菌、抗病毒或食品添加剂等作用[15-18];-蒎稀是合成香料的重要原料,也是合成润滑剂、增塑剂等的原料,具有多种用途[19-20]。-松油醇用于香精的配制,亦用于医药、农药、塑料、肥皂、油墨、仪表和电讯工业中,它是玻璃器皿上色彩的优良溶剂等[21-22]。因此,本研究结果可为油樟植物资源的综合开发利用提供一定的参考依据。
自由基具有较强氧化性,人体内自由基的积累会引起衰老和多种疾病的发生,抗氧化剂可有效清除自由基或阻断自由基介导,有助于人体抵抗疾病。人工合成的抗氧化剂具有潜在的毒性和致癌作用,而天然抗氧化剂具有安全、无毒、高效等优点,因此寻找天然、高效、低毒的抗氧化剂将成为一种趋势[23]。本试验采用DPPH自由基清除能力评价油樟叶精油及其各馏分的抗氧化能力。结果显示,它们均有抗氧化能力,其抗氧化能力有剂量依赖性。结合它们中1,8-桉叶油素的含量分析,馏分A2中1,8-桉叶油素相对百分含量比A0低,但抗氧化活性却强;相反,馏分A0中桉油精含量高,其抗氧化能力却相对较弱。这表明油樟叶精油及其各馏分中,含量较高的1,8-桉叶油素、-松油醇等化学成分协同作用对其抗氧化能力发挥了重要的作用,但具体是哪种或哪些物质起主要作用,有待于今后进一步研究。
精油是含有多种成分的复杂体系,其抗氧化活性是多种化学成分共同作用的结果。油樟叶精油及其馏分对DPPH自由基的清除能力有一定影响,但明显略弱于VC;作为一种多用途植物,其富含特有的活性物质,具有抗氧化等多种生理功能,拥有广阔的市场开发潜力和研究价值。
4 小结
油樟叶精油通过减压分馏得到油樟叶精油100 ~150 ℃之间的馏分(A3号)所占的比例最大;60 ~100 ℃之间的馏分(A2号)次之;60 ℃以下的馏分(A1号)所占的比例最少。
油樟叶精油及其馏分中的化学成分及其含量差异较显著。本试验从油樟叶精油(A0号精油)及其馏分(A1号精油、A2号精油、A3号精油)中共鉴定出31种化合物,包括烃类(21种)、醇类(8种)、酮类(1种)及酯类(1种),它们的共有成分有15种,除此之外,油樟叶精油(A0号精油)中还检测到14种化合物;馏分A2号精油检测到5种化合物;馏分A3号精油检测到16种化合物。这些化合物中有许多物质可用于香精香料、抗菌消炎等作用。
油樟叶精油及其馏分清除DPPH自由基能力有显著的量效关系,显示了较好的抗氧化活性。但对DPPH自由基的作用还不如VC强,但与 VC相比,它们的抗氧化活性相对较弱。
[1] 中国植物志编辑委员会. 中国植物志(第31卷) [M]. 北京:科学出版社, 1982: 184-186.
[2] 陶光复,丁靖垲,孙汉董. 湖北油樟叶精油的化学成分[J]. 武汉植物学研究, 2002, 20(1):75-77.
[3] 刘宇,殷中琼,魏琴,等. 油樟叶挥发油 β-环糊精包合物的制备工艺研究及稳定性考察[J]. 中国中药杂志, 2013, 38(13): 2015-2018.
[4] 黄远征,温鸣章,赵蕙,等. 关于油樟叶芳香油化学成分的研究[J]. 武汉植物学研究,1986, 4(1): 59-63.
[5] 胡文杰,高捍东,江香梅,等. 樟树油樟、脑樟和异樟化学型的叶精油成分及含量分析[J].中南林业科技大学学报, 2012, 32(11): 186-194.
[6] 杨素华,安家成,陆顺忠,等. 油樟型樟树精油的成分分析[J]. 广西林业科学, 2017, 46(3): 315-318.
[7] 游玲,王涛,李兰,等. 78株油樟内生真菌发酵产物的挥发性组分分析[J]. 西北农林科技大学学报:自然科学版, 2009, 37(9): 193-198.
[8] Chen F L, Xu M, Yang X Y, et al. An improved approach for the isolation of essential oil from the leaves ofusing microwave- assisted hydrodistillation concatenated double-column liquid-liquid extraction [J]. Separation and Purification Technology, 2018, 195(29): 110-120.
[9] Li L, Shi C F, Yin Z Q, et al. Antibacterial activity of α-terpineol may induce morphos tructural alterations in Escherichia coli [J]. Brazilian Journal of Microbiology, 2014, 45(4): 1409-1413.
[10] 王涛,游玲,魏琴,等. 油樟内生细菌的多样性及抑制植物病原菌初步研究[J]. 西北林学院学报, 2009, 24(2): 97-100.
[11] Du Y H, Feng R Z, Li Q, et al. Anti-inflammatory activity of leaf essential oil from(Gamble) N. Chao [J]. International Journal of Clinical and Experimental Medicine, 2014, 7(12): 5612-5620.
[12] 丛赢,张琳,祖元刚,等. 油樟() 精油的抗炎及抗氧化活性初步研究[J]. 植物研究, 2016, 36(6): 949-954.
[13] 曹玫,贾睿琳,江南,等. 油樟叶挥发油的镇痛活性研究[J]. 广西植物,2013,33( 4): 552-555.
[14] 叶奎川,殷中琼,魏琴,等. 油樟叶挥发油及其主要成分的体外抗肝癌活性[J]. 解剖学报, 2012, 43(3): 381-386.
[15] Castro K N C, Canuto K M, Brito E S, et al. In vitro efficacy of essential oils with different concentrations of 1,8-cineole against Rhipicephalus (Boophilus) microplus [J]. Revista Brasileira de Parasitologia Veterinaria, 2018, 27(2): 203-210.
[16] Sampatha S, Subramanibc S, Janardhanam S, et al. Bioactive compound 1,8-Cineole selectively induces G2/M arrest in A431 cells through the upregulation of the p53 signaling pathway and molecular docking studies [J]. Phytomedicine, 2018, 46(15): 57-68.
[17] Kaninika P, Paramita B. Mass transfer and hydrodynamic study of supercritical carbon dioxide extraction of 1,8-cineole from small cardamom seeds [J]. Chemical engineering communications, 2018, 205(8): 1023-1033.
[18] Ambrosch S, Duliban C, Heger H. et al. Effects of 1,8‐Cineole and (–)‐linalool on functional brain activation in a working memory task [J]. Flavour and Fragrance Journal, 2018, 33(3): 235-244.
[19] Renbaum-Wolff L, Grayson J W, Bateman A P, et al. Viscosity of α-pinene secondary organic material and implications for particle growth and reactivity [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(20): 8014-8012.
[20] Singh H P, Batish D R, Kaur S, et al. Alpha-Pinene inhibits growth and induces oxidative stress in roots [J]. Annals of Botany, 2006, 98(6): 1261-1269.
[21] Cutillas AB, Carrasco A, Martinez-Gutierrez R, et al. Thymus mastichina L. essential oils from murcia (Spain): composition and antioxidant, antienzymatic and antimicrobial bioactivities [J]. PLos One, 2018, 13(1): 1-19.
[22] Camesasca L, Minteguiaga M, Fariña L, et al. Overproduction of isoprenoids by saccharomyces cerevisiae in a synthetic grape juice medium in the absence of plant genes [J]. International Journal of Food Microbiology, 2018, 282(3): 42-48.
[23] 熊皓平,杨伟丽,张友胜,等. 天然植物抗氧化剂的研究进展[J]. 天然产物研究与开发, 2001, 13(5): 75-79.
CHEMICAL CONSTITUENTS AND ANTIOXIDANT CAPACITY OF THE ESSENTIAL OIL AND ITS DISTILLATIONS FROMLEAVES
*HU Wen-jie, ZHU Li-cheng, YIN Shuai-wen, ZHOU Sheng-tuan
(School of Life Science, Jinggangshan University, Ji’an, Jiangxi 343009, China)
The essential oil was separated fromleaves by vacuum fractionation, its chemical constituents of every fraction were analyzed by GC-MS and the antioxidant activity were also evaluated through the measurement of 1,1-Dipheny-2-picrylhdrazyl radical 2,2-Dipheny-1-(2,4,6-trinitrophenyl) (DPPH) scavenging activity. The results showed that the chemical constituents and contents of the essential oil and its distillations fromleaves were significantly different. There were 29, 15, 20 and 31 compounds, identified from the essential oil (A0) and its distillations (A1, A2, A3) respectively, In total, 31 components were identified from them, including hydrocarbon (21), alcohols (8), ketones (1) and esters (1). Only 15 common components were detected in them, in addition, the number of special components among them were A0(14), A2(5) and A3(16), respectively. The essential oil and its distillations fromleaves showed antioxidant activity, the order of their antioxidant activity is A3> A2> A0> A1, and the activity of scavenging DPPH radical of the essential oil and its distillations was lower than that of Vc at the same mass concentration. The results could provide reference for further study on the separation and purification of the effective components, exploitation and utilization fromleaves.
; fractionation; GC-MS; antioxidant
R931.6/Q946
A
10.3969/j.issn.1674-8085.2019.05.006
1674-8085(2019)05-0026-08
2019-05-17;
2019-06-26
江西省教育厅科技计划项目(GJJ170641);江西省自然科学基金项目(20181BAB204014);井冈山大学博士科研启动项目(JZB1309)
*胡文杰(1974-),男,江西吉安人,副教授,博士,主要从事植物资源开发利用研究(E-mail:huwenjie2008@126.com);
朱立成(1972-),男,江西吉水人,副教授,博士,主要从事生物化学教学科研工(E-mail:zjiet@qq.com);
殷帅文(1978-),男,湖南浏阳人,副教授,博士,主要从事天然产物研究与开发(E-mail:shwyin@126.com);
周升团(1971-),男,江西瑞昌人,讲师,硕士,主要从事微生物学研究(E-mail: zhoushengtuan@163.com).
