三七多糖的微生物发酵提取工艺优化及其抗炎功效评价
2019-09-18刘平平虞旦王昌涛赵丹张佳婵李萌
刘平平,虞旦,王昌涛,2,赵丹,张佳婵,李萌,*
(1.北京工商大学理学院植物资源研究与开发重点实验室,北京100048;2.北京工商大学食品营养与人类健康高精尖创新中心,北京100048)
三七是五加科植物Panax notoginseng(Burk.)F.H.Chen 的根,《本草纲目拾遗》中记载:“人参补气第一,三七补血第一,味同而功亦等,故称人参三七,为中药中之最珍贵者”[1]。据书中记载,三七功用补血,能够活血达到去瘀生新的效果,外用能够消肿镇痛;其抗炎症的作用以及免疫调节的作用非常显著,不仅能抑制疤痕增生,还能起到抗衰老、抗氧化作用[2-4]。此外,现代药理研究也证明三七中的主要有效成分之一皂苷对中枢神经系统有明显的抑制作用和镇痛作用[5],尤其是人参皂苷Rg1 和人参皂苷Rb1 还具有增强血清超氧化物歧化酶(superoxide dismutase,SOD)活性,减缓衰老的功效,并具有显著抗纤维化作用,外用可保养皮肤[6-8];此外,大量关于三七多糖生理活性的研究表明,三七多糖具有促进加强网状内皮系统的功能[9],还可以抵抗微波辖射[10]、提高免疫力[11],有骨缺损修复和促进恢复创伤等作用[12]。
现有研究中对多糖的提取常用的方法包含水提、碱提、酸提、苯酚提取、微波辅助提取、超声辅助提取和酶提等方法[13]。其中微生物发酵法可利用代谢途径分泌出的各种生物酶,分解植物细胞的致密结构,使植物活性成分顺利提取出来。且在发酵过程中,微生物自身代谢将许多人体不能直接吸收利用的有效活性物质大分子降解成小分子,从而使发酵产物在人体中可以更快地被吸收,有提高有效成分利用率、产生新化合物、减少毒副作用、提高提取率的功效[14]。
皮肤角质细胞能够合成多种促炎因子和半抗原,在皮肤受到刺激时,在免疫自稳及免疫应答过程中,发挥重要作用。本试验采用食用级黄酒酵母发酵的方法提取三七多糖,并对提取工艺进行优化,利用反转录实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术,检测三七多糖对人类永生化表皮细胞HacaT 培养体系中这些细胞因子表达量的影响,从而对三七多糖的抗炎功效进行评价。
1 材料与方法
1.1 材料与试剂
三七粉:云南白药集团股份有限公司;黄酒酵母:植物资源研究与开发重点实验室保存;酵母浸粉(生物试剂)、琼脂(生物试剂):北京奥博星生物技术;葡萄糖(分析纯):国药集团;浓硫酸、苯酚、无水乙醇(分析纯):北京化工厂;人参皂苷Re 标准品:成都曼思特生物科技有限公司;0.05%(含乙二胺四乙酸)胰蛋白酶、DMEM 高糖培养基、胎牛血清:美国GIBCO 生命技术公司;噻唑蓝溴化四唑(thiazolyl blue tetrazolium bromide,MTT):美国 Sigma 公司;人表皮永生化细胞(HacaT):中国科学院细胞库;培养细胞/细菌总RNA 提取试剂盒(DP430)、FastKingRTKit(WithgDNase)(KR116)、SuperReal 荧光定量预混试剂彩色版(FP215):天根生化科技(北京)有限公司。
1.2 仪器与设备
BXM-30R 立式压力蒸汽灭菌器:上海博迅实业有限公司;全温度震荡培养箱DQHZ-2001A:太仓华美生化仪器厂;UVmini-1240 紫外分光光度计:日本岛津;T6 新世纪紫外可见分光光度计:北京普析通用仪器有限公司;Sunrise 酶标仪:帝肯贸易有限公司;倒置显微镜:株式会社尼康;Bss160 带自动转盘的孵化箱Grumbach;ZEISS 体式显微镜:ZEISS;DJW-5KVA 智能型交流净化稳压电源:北京力能恒电电子科技有限公司;ABI7300 型荧光定量PCR 仪:美国应用生物系统公司。
1.3 试验方法
1.3.1 总糖含量的测定
采用苯酚硫酸法测定总糖含量[15],首先是标准曲线的绘制。总糖质量浓度(ρ)在0~0.12 g/L 范围内与A490呈良好的线性关系,标准方程为:A490=10.213ρ-0.048(R2=0.999 3)。
样品含量测定:将水溶性多糖样品稀释至合适浓度后,加1 mL 置于试管中,取两只带塞试管,分别吸取1 mL 待测液和1 mL 去离子水,再分别依次添加0.5 mL 5%苯酚,摇匀后加入2.5 mL 浓硫酸,盖上试管盖,充分摇匀,静置5 min;沸水浴1h,测定吸光值A490。
1.3.2 还原糖含量测定
采用DNS 法测定还原糖糖含量[16],首先是标准曲线的绘制标准曲线。还原糖标准品质量浓度(ρ)在0~0.12 g/L 范围内与A540呈良好的线性关系,标准方程为,标曲:A540=0.006 3ρ-0.002 8,R2=0.999。
样品含量测定:样品液适当稀释,尽量使糖浓度为 0.1 g/L~1.0 g/L,取 1.0 mL 到试管中,加入 DNS 试剂2 mL,沸水浴加热2 min 后用流水冷却,再加蒸馏水补足到15 mL 刻度,在540 nm 波长下测定样品的吸光度。
1.3.3 多糖含量测定
多糖含量=总糖含量-还原糖含量。
1.3.4 高效食用级黄酒酵母的培养
挑取高效食用级黄酒酵母单菌落接菌于固体培养基中,在28 ℃培养箱中培养48 h。挑取酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YPD)固体培养基上单菌落接菌于YPD 液体培养基,在28 ℃摇床中培养48 h,转速180 r/min,培养之后即可作为菌种备用。
1.3.5 微生物发酵法提取三七多糖单因素试验
1.3.5.1 液料比单因素试验
选取 20∶1、30∶1、40∶1、50∶1、60∶1、70∶1(mL/g)6 个梯度作为液料比的单因素试验条件[17],经125 ℃灭菌30 min 后,接种食用级黄酒酵母,在30 ℃摇床中培养48 h,转速4 800 r/min 离心发酵液20 min 后取上清液,在100 ℃水浴灭菌20 min,混合均匀后得三七发酵液。设置3 组平行。
1.3.5.2 时间单因素试验
选取 36、42、48、54、60 h 这 5 个梯度作时间的单因素试验条件,固定液料比为 40∶1(mL/g),经 125 ℃灭菌30 min 后,接种食用级黄酒酵母,在30 ℃摇床中培养不同时间后,转速4 800 r/min 离心发酵液20 min后取上清液,在100 ℃水浴灭菌20 min,混合均匀后得三七发酵液。设置3 组平行。
1.3.5.3 温度单因素试验
选取 26、28、30、32、34 ℃这 5 个梯度作温度的单因素试验条件[18],固定液料比为 40∶1(mL/g),经 125 ℃灭菌30 min 后,接种食用级黄酒酵母,在不同温度摇床中培养48 h 后,转速4 800 r/min 离心发酵液20 min后取上清液,在100 ℃水浴灭菌20 min,混合均匀后得三七发酵液。设置3 组平行。
1.3.5.4 接菌量单因素试验
选取不同接菌量3%、4%、5%、6%、7%这5 个梯度作为单因素试验条件,固定液料比为40∶1(mL/g),经125 ℃灭菌30 min 后,接种不同量食用级黄酒酵母,在30 ℃摇床中培养48 h 后,转速4 800 r/min 离心发酵液20 min 后取上清液,在100 ℃水浴灭菌20 min,混合均匀后得三七发酵液。设置3 组平行。
1.3.6 三七多糖提取得率
三七多糖提取得率/(g/g)=多糖含量×发酵液体积/三七质量
1.3.7 微生物发酵法提取三七多糖正交试验
在单因素试验的基础上,选取对试验结果影响较大的3 个因素进行正交设计,选取液料比、温度、接菌量,每个因素各取3 个水平,以发酵液中三七多糖的提取得率为考察指标。
其他试验条件确定为:pH 值为7,发酵时间36 h,按照正交设计表进行试验,发酵后将溶液在转速4 800 r/min 离心发酵液20 min 后取上清液,在100 ℃水浴灭菌20 min,混合均匀后得三七发酵液测多糖含量。设置3 组平行,见表1。
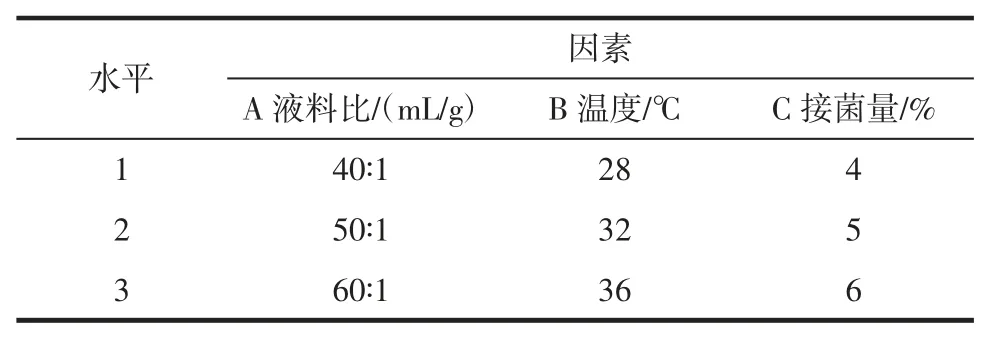
表1 正交试验设计Table 1 Orthogonal experiment design
1.3.8 三七发酵液多糖制备
于三七悬浮液中接种3%食用级黄酒酵母,30 ℃摇床中培养48 h,转速4 800 r/min 离心发酵液20 min后取上清液,100 ℃水浴灭菌20 min,混合均匀后得三七发酵液,醇沉三七发酵液,冻干得到多糖粉末,多糖溶解后以酶解与Sveag 法结合的方法多次去蛋白,悬蒸去除有机试剂,再次冻干得到三七发酵液多糖(三七多糖)。
1.3.9 细胞培养
1.3.9.1 细胞复苏
从-80 ℃冰箱中取出待用冻存的HacaT 细胞,迅速37 ℃水浴,在1 min~2 min 内轻微振动将其融化。1 000 r/min 离心10 min,去上清。加入1 mL DMEM完全培养液,转移至10 cm2培养瓶中,37 ℃5%CO2培养。
1.3.9.2 细胞传代
当细胞生长至90%融合时,用2 mL 磷酸缓冲盐溶液洗两次(动作轻柔)。加入200 μL 0.25%的胰酶放入CO2培养箱中消化5 min,放到显微镜下观察,当确认细胞从培养瓶壁上脱落后,加入2 mL 完全培养液终止消化,800 r/min 离心10 min,去上清,加入4 mL培养液,计数后,以5×105密度接种于10 cm2培养瓶。
1.3.9.3 MTT 法测定HacaT 细胞毒性试验
选取对数生长期状态良好的HacaT 细胞。用0.25%胰蛋白酶将HacaT 细胞消化,离心后重悬于含有10%胎牛血清的DMEM 培养基中,计数;用96 孔培养板接种细胞,并设置空白对照,边缘孔用无菌磷酸盐缓冲液填充,在5%CO2,37 ℃环境中培养过夜;按照各自终浓度分别加入三七多糖,细胞对照组是未做处理的组,每组设3 个复孔,培养48 h 后加入5 g/L 的MTT溶液,继续在37 ℃,5%CO2环境中培养4 h 后终止培养;吸除孔内液体,用磷酸盐缓冲液洗涤1 次,加入二甲基亚砜(dimethyl sulfoxide,DMSO)溶解结晶;M3 读板仪测定各孔吸光度值 A570。分别用 0.5、1、2、2.5、5 g/L三七多糖和100 μmol/L 阿司匹林各5 μL 添加到5 mL细胞培养液中,处理HacaT 细胞24 h。提取细胞总RNA,荧光定量分析炎症细胞因子转录水平表达量,以ERK1 作为内参基因。
1.3.9.4 三七多糖溶液对细胞进行不同时间培养
将消化后的细胞,以2×106/孔的密度接种6 孔板内,以 0.5 g/L 浓度三七多糖处理细胞 0、0.5、1.0、1.5、2.0 h[19]。提取细胞总RNA,荧光定量分析处理对炎症细胞因子在转录水平表达的影响,以ERK1 作为内参基因。
1.3.10 细胞总RNA 提取与转录
按照RNA 提取试剂盒和反转录试剂盒说明书进行操作。
1.3.11 引物及探针的设计和合成
根据NCBI 中发布的基因序列,通过Primer Express 软件设计出13 个基因(包含管家基因ERK1)的特异性引物,引物序列见表2。

表2 实时定量荧光PCR 引物序列Table 2 Primer sequences for real-time PCR
1.3.12 实时荧光PCR
根据SuperReal 荧光定量试剂盒说明书操作,总反应体系为 20 μL,包括 cDNA 模板 1 μL,10×Super-Real PreMix Plus 缓冲液 10 μL,正、反义引物各 0.3 μL,热启动酶 0.25 μL,双蒸水补足至 20 μL。
循环参数:95 ℃预变性 2 min,然后按 95 ℃ 15 s,57 ℃ 20 s,72 ℃ 30 s,共 40 个循环,72 ℃收集荧光数据。反应在ABI7300 荧光定量PCR 仪上进行。
2 结果
2.1 发酵法提取三七多糖单因素试验结果
2.1.1 液料比对三七多糖提取的影响
不同液料比对三七多糖提取的影响结果见图1。
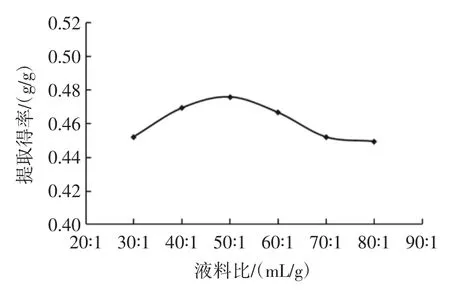
图1 提取液料比对三七多糖提取率的影响Fig.1 Effect of liquid-to-material ratio on the polysaccharides content
如图1 所示,三七多糖提取得率随着液料比的增加而增加,在液料比为50∶1 (mL/g)时达到了峰值0.476 g/g,随后提取得率随着液料比的升高而降低。说明溶剂液料比在一定范围内对提取得率有显著的影响。因此,选择 40∶1、50∶1、60∶1(mL/g)作为正交试验水平。
2.1.2 时间对三七多糖提取的影响
不同发酵时间对三七多糖提取的影响结果见图2。
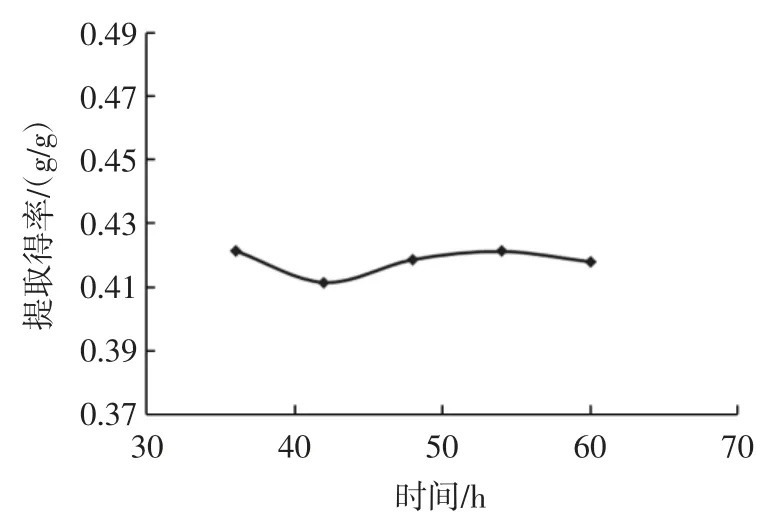
图2 提取时间对三七多糖提取得率的影响Fig.2 Effect of time on the polysaccharides content
如图2 所示,提取得率随着时间的增加变化并不明显,说明较短时间内酵母菌已经完成了周期性的增长,消耗大糖转化为小分子糖类,总糖含量并无明显改变。本着工艺低成本和高提取得率的原则,不将时间当作一个正交试验因素,在后续试验中将发酵时间定为正常的48 h。
2.1.3 温度对三七多糖提取的影响
不同发酵温度对三七多糖提取的影响结果见图3。
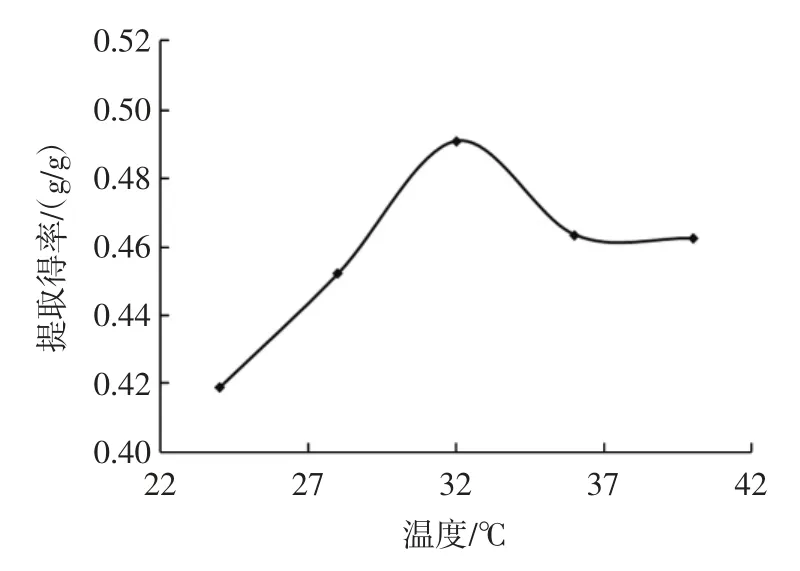
图3 提取温度对三七多糖提取得率的影响Fig.3 Effect of temperature on the polysaccharides content
如图3 所示,提取得率随着温度的增加变化率显著,在温度为32 ℃时达到了峰值0.491 g/g,随后提取得率随着温度的升高而降低,在36 ℃后变化开始趋于平缓。可能是一定温度下会促进三七多糖的溶出,过高温度会影响黄酒酵母的生长繁殖从而导致提取得率降低,因此,选择28、32、36 ℃作为正交试验因素。
2.1.4 接菌量对三七多糖提取的影响
不同接菌量对三七多糖提取的影响结果见图4。
如图4 所示,提取得率随着接菌量的增加变化率显著,当接菌量5%时达到了峰值0.410 g/g,随后提取得率随着接菌量的增大而降低,可能是由于菌量达到饱和状态,从而影响生长4%、5%、6%作为正交试验因素。
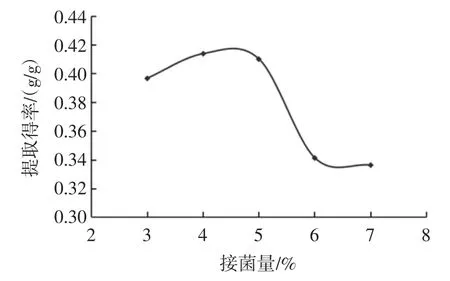
图4 接菌量对三七多糖提取得率的影响Fig.4 Effect of temperature on the polysaccharides content
2.2 发酵法提取三七多糖正交试验结果
不同因素组合对三七多糖提取的影响结果见表3。
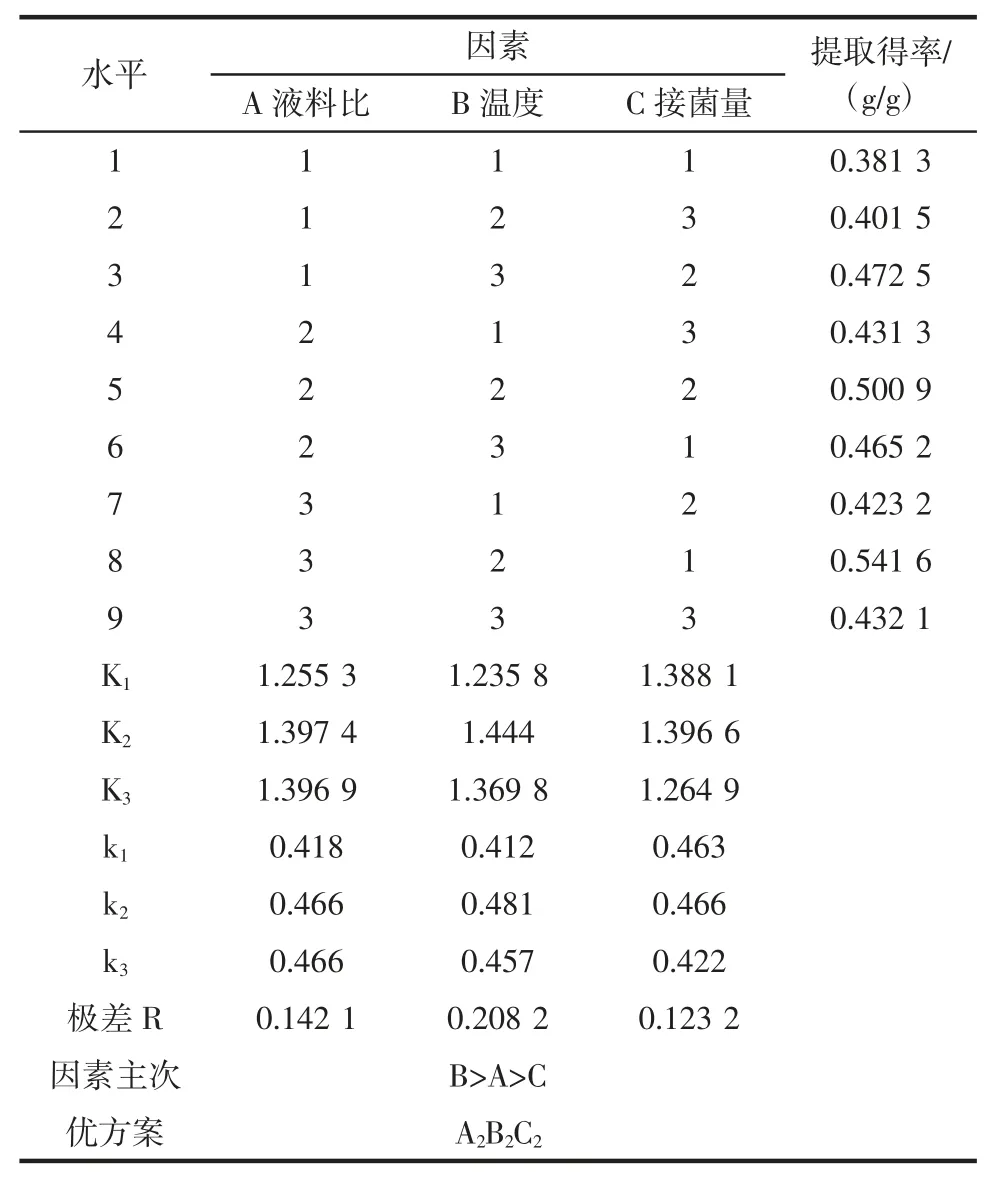
表3 正交试验结果Table 3 The results of orthogonal experiment
由表3 极差分析可知,各因素对三七多糖提取效果的影响主次分别为:温度>液料比>接菌量,发酵法提取三七多糖的最佳工艺条件为:液料比为50∶1(mL/g),发酵温度为32 ℃,接菌量为5%。通过观察极差R 值可看结果表现出显著性差异。最后,根据优化结果进项优方案试验,提取的三七多糖提取得率为0.501 g(多糖)/g(原料),符合预期值。
2.3 对HacaT细胞增殖的影响
三七多糖浓度对HacaT 细胞存活率的影响见图5。
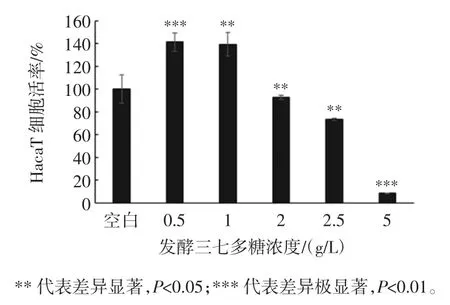
图5 三七多糖浓度对HacaT 细胞存活率的影响Fig.5 Cell viability with different polysaccharide of Panax notoginseng
如图5 所示,以未加任何三七多糖的细胞作空白对照,当三七多糖浓度高达2 g/L 时,细胞增殖活力依然超过90%,说明三七多糖对细胞几乎无毒性。且当三七多糖浓度减小,细胞增殖活力反而增加,三七多糖浓度为0.5 g/L 和1 g/L 时,细胞存活率高达141.32%和139.25%,说明低浓度三七多糖对HacaT 有增殖作用,在后面试验中以低浓度三七多糖作为作用于HacaT 细胞的浓度。
2.4 三七多糖处理浓度的确定
以100 μmol/L 阿司匹林作为参照,观察同一时间段内不同浓度三七多糖处理条件下HacaT 细胞中的CSF-1 表达量的差异,以及同一浓度三七多糖不同时间段处理条件下CSF-1 表达量的差异。
不同浓度三七多糖对CSF-1 基因表达量的影响见图6。
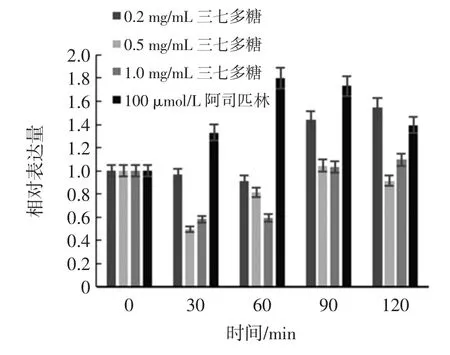
图6 不同浓度三七多糖对CSF-1 基因表达量的影响Fig.6 Influence of different polysaccharide of Panax notoginseng to CSF-1 expression
从图6 中可以看出,通过SPSS 软件进行LSD 法和Duncan 法分析其显著性,相同浓度的三七多糖在不同时间段的处理下差异显著(P<0.05),不同浓度的三七多糖的处理后水平差异不显著(P>0.05)。因此,选择0.5 g/L 的三七多糖为最终浓度,考察其处理不同时间对炎症细胞因子表达量的影响。
2.5 三七多糖添加时间影响
考察时间效应,三七多糖处理HacaT 细胞,2 h内,炎症相关基因表达量变化。
2.5.1 炎症因子类基因(IL-6、IL-8)
促炎症因子IL-6 在炎症和免疫反应中具有多种功能,是由活化的单核细胞、内皮细胞、T 淋巴细胞、巨噬细胞和成纤维细胞等分泌的,在促炎因子IL-1 和TNF 的刺激下,IL-6 的表达量会增加,从而增加炎症反应中花生四烯酸的释放,刺激T 细胞活化和增殖,促进B 细胞分泌免疫球蛋白,血清中IL-6 的水平增高几乎与炎症程度成正比[20-21]。在炎症反应中,IL-8 是直接作用于表皮细胞,主要是促进慢性炎症的发展,聚集并激活T 淋巴细胞、白细胞和血管内皮细胞[22]。
三七多糖对IL-6/IL-8 表达量的影响见图7。
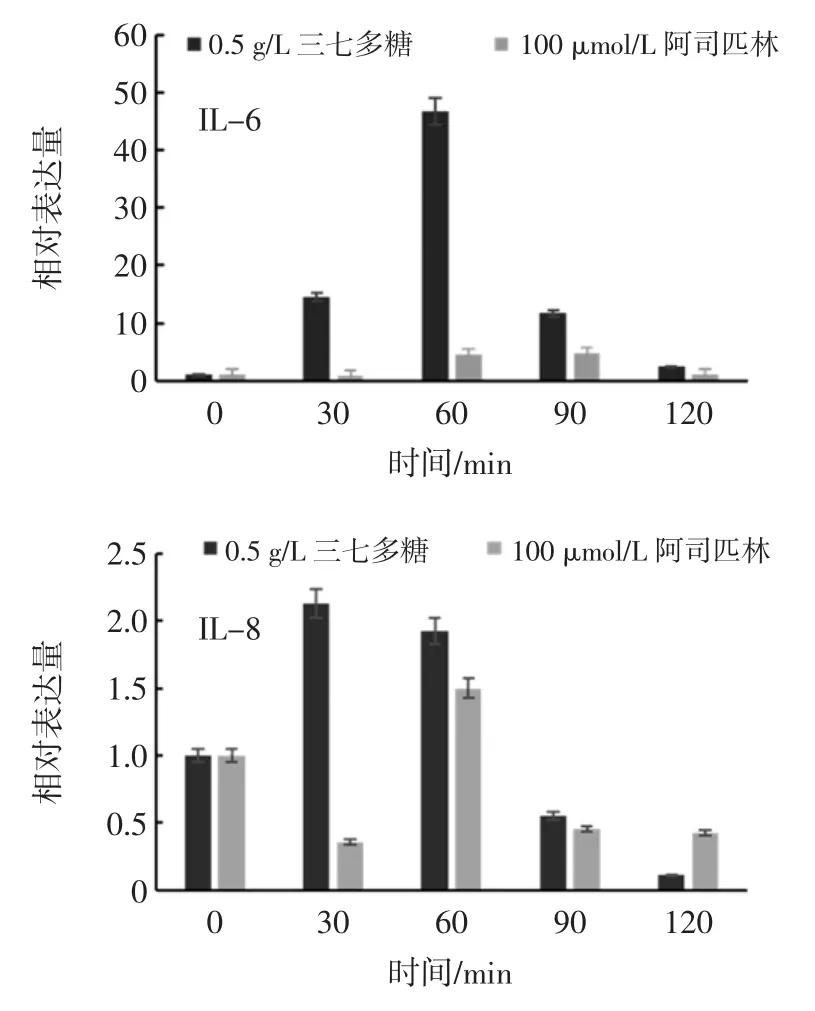
图7 三七多糖处理不同时间对IL-6/IL-8 表达量影响Fig.7 Influence of training time by polysaccharide of Panax notoginseng to IL-6/IL-8 expression
如图7 所示,相比于对照组100 μmol/L 阿司匹林,IL-6 的表达量更高,到60 min 时上升到最高,然后缓慢降低,在120 min 的时间降到初始值附近。整体来看,三七多糖对IL-6 基因表达量的影响主要在2 h 内的促进作用。三七多糖对IL-6 基因表达量的影响验证了三七多糖可能是通过影响的花生四烯酸的代谢而起到抗炎作用的。
在30 min 短时间内,IL-8 表达量迅速上升至最高值,并在接下来时间内保持下降趋势,之后的一个小时内降到初始值以下,再紧接着从90 min 到120 min的时间内,仍然保持下降趋势。整体来看,三七多糖对IL-8 基因的影响主要体现在30 min 到120 min 内迅速抑制其表达。IL-8 表达的增高使得大量中性粒细胞向炎症区域聚集,通过释放炎症介质加重炎症反应。三七多糖先激发后抑制了IL-8 的表达,间接地抑制了炎症的发生和发展,对炎症起到缓解功效。
2.5.2 造血生长因子(CSF1、CSF2)
CSF1 为造血生长因子,参与单核细胞、巨噬细胞的增殖分化以及存活[23-24],CSF2 为具有多效性的造血生长因子,体内研究表明CSF2 的产量与效应可以由TNF、MIP-1a 等调控[25-26]。
三七多糖处理不同时间对CSF-1/CSF-2 表达量影响见图8。
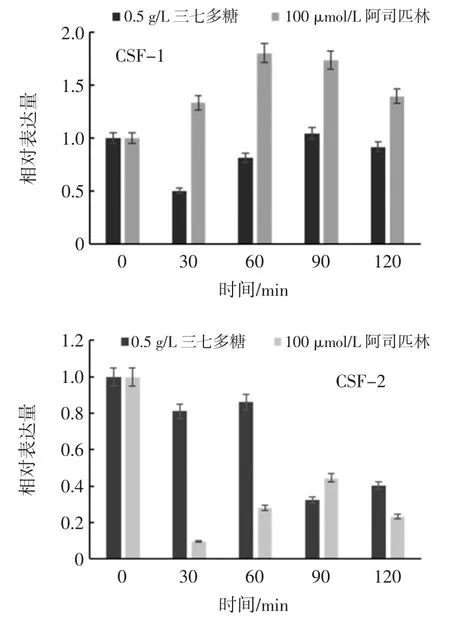
图8 三七多糖处理不同时间对CSF-1/CSF-2 表达量影响Fig.8 Influence of training time by polysaccharide of Panax notoginseng to CSF-1/CSF-2 expression
根据图8 发现,三七多糖对CSF-1、CSF-2 的作用主要表现为抑制作用,30 min 短时间内,三七多糖作用于CSF-1 使其表达量迅速下降,此时阿司匹林对照组的表达量表现为上升且表现为促进表达的作用,之后的一个小时内,即从30 min 到90 min 的时间内,CSF-1 基因有缓慢的上升趋势,增幅不大且表达量数值一直小于初始值,在90 min 到120 min 的时间内,又有下降趋势。整体来看,三七多糖对CSF-1 基因的影响主要体现在0 min 到30 min 内迅速抑制其表达,并在120 min 的时间内保持抑制其表达的作用,间接地抑制了炎症的发生和发展。三七多糖作用于CSF-2 的作用趋势类似,先降低再升高再降低,但是幅度小于CSF-1,而且对照组阿司匹林作用于CSF-2 的表达量在前60 min 是低于三七多糖对CSF-2 的表达量,在90 min时短暂反超后又在120 min 时再次低于,但整体跟三七多糖一样,对于CSF-2 的表达量一直是抑制作用。
2.5.3 趋化因子相关基因CCL20、白细胞募集因子CXCL3
CCL20、CXCL3 则是具有能将白细胞募集到炎症部位的因子,主要功能是白细胞募集,在炎症初期发挥自体免疫功能,应对感染[27]。
三七多糖处理不同时间对CCL20/CXCL3 表达量影响见图9。
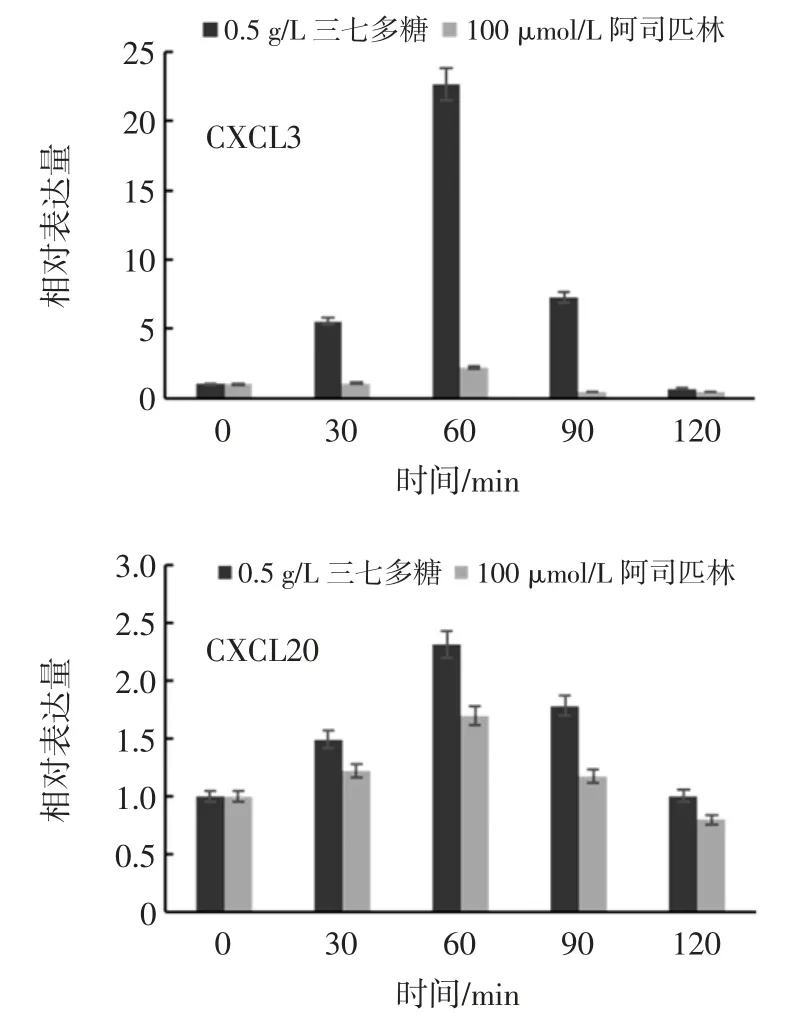
图9 三七多糖处理不同时间对CCL20/CXCL3 表达量影响Fig.9 Influence of training time by polysaccharide of Panax notoginseng to CCL20/CXCL3 expression
三七多糖对CCL20/CXCL3 表达量的影响如图9所示,相比于对照组100 μmol/L 阿司匹林,CCL20 的表达量偏高但是也很接近,从0 min 到60 min,一直缓慢上升到达最高值,紧接着缓慢降低,在120 min 的时间降到初始值附近。整体来看,三七多糖对CCL20 基因表达量的影响主要在2 h 内的促进作用。三七多糖对CCL20 基因表达量的影响验证了三七多糖能够在炎症发生时调动白细胞发生免疫。
相比于对照组 100 μmol/L 阿司匹林,CXCL3 的表达量远远高于对照组,从0 min 到60 min 时中,快速上升到达最高值,紧接又急剧降低,在120 min 的时间降到初始值附近并低于初始值。对照组阿司匹林对CXCL3 表达量也是先增加再降低,但是表达量增幅不多且在90 min 时就降至初始表达量以下。从整体来看,三七多糖对CXCL3 基因表达量的抑制作用体现在90 min 之后,且慢于阿司匹林,三七多糖对CXCL3 基因表达量的影响验证了三七多糖能够在炎症发生后期调动白细胞发生免疫。
2.5.4 蛋白抗体TNF-AIP3
TNF-AIP3 主要由TNF 诱导表达,是一个重要的负性免疫调节基因,其过表达可阻断TNF 受体或T 细胞受体(TCR)引起的NF-kappa 转导通路的激活[28]。
三七多糖处理不同时间对TNF-AIP3 表达量影响见图10。
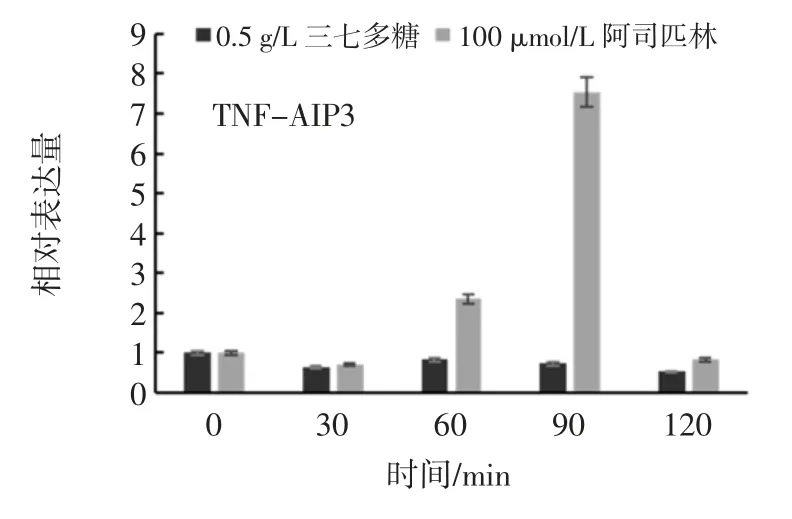
图10 三七多糖处理不同时间对TNF-AIP3 表达量影响Fig.10 Influence of training time by polysaccharide of Panax notoginseng to TNF-AIP3 expression
根据图10 发现,三七多糖对TNF-AIP3 的作用主要表现为抑制作用,在120 min 内变化幅度不大,但是一直处于抑制表达的状态,说明三七多糖对TNFAIP3 基因的影响主要体现在120 min 的时间内保持抑制其表达的作用,间接地抑制了炎症的发生和发展。相比于阿司匹林对照组,阿司匹林作用细胞后60 min,TNF-AIP3 的表达量开始上升,在接下来30 min 短时间内又迅速下降到抑制状态。
3 结论
本文通过微生物发酵法对三七中的多糖进行提取,并采取正交试验对三七多糖提取条件进行优化。通过采用荧光定量PCR 方法检测三七多糖对炎症细胞因子在2 h 内的变化趋势。研究结果表明:经试验测定,选出对试验结果影响较大的液料比、温度、接菌量3 个因素,并选定3 个水平为考察指标,最终得到最优提取工艺为:液料比50∶1(mL/g)、接菌量为5 %、温度为32 ℃、pH 值为7,发酵时间36 h,此时多糖提取得率最高,达到0.501 g/g。通过MTT 法检测多糖对HacaT 细胞的增殖作用及安全浓度范围为1 g/L,用0.5 g/L 的三七多糖考察不同时间处理对炎症细胞因子表达量的影响:白细胞活化因子CSF2、CSF1 下调,胞内信号负调节因子 TNF-AIP3 表达下调、Cxcl3、TNFAIP3 基因的表达均有下调的作用;对IL6 是上调作用,对CCL20、IL8(CXCL8)是先上调再抑制。综上,炎症细胞因子网络系统复杂多样,三七多糖可干预炎症反应不只是通过某个基因的方式进行的,而是以多基因靶点和多环节方式减弱促炎症反应,增强抗炎症反应,以达到抗炎功效。
