胶性参数下可食性果胶膜的制备及其性能研究
2019-09-18潘婕曹端林王建龙郝媛张宏博
潘婕,曹端林,王建龙,郝媛,张宏博
(1.中北大学化学工程与技术学院,山西太原030051;2.三亚航空旅游职业学院,海南三亚572000)
果胶(pectin,PT)是一种结构复杂的酸性杂多糖,主链由D-吡喃半乳糖醛酸在α-1,4-糖苷键作用下聚合而成,侧链由D-半乳糖、L-鼠李糖、D-山梨糖、D-阿拉伯糖等中性糖构成[1],主要存在于植物细胞壁的初生细胞壁和中间片层中[2],多与纤维素、半纤维素和木质素等其他成分共存。果胶因其凝胶性,被广泛用于食品、医药等行业,其凝胶机理与酯化度相关[3-5]。高酯果胶(high-methoxy pectin,HMP)以“糖-酸成胶机制”形成凝胶,即需要大量的酸和糖[3];低酯果胶(lowmethoxy pectin,LMP)形成凝胶则需要金属阳离子的参与[6],不需要糖的添加,所以低酯果胶作为制备低糖食品的重要原料而备受青睐。
近年来,为了环境可持续性发展,减少不可降解的食品包装材料对环境的破坏,相对于合成包装材料,利用可再生资源开发、生产可生物降解的环保型材料备受关注,将成为今后研究趋势[7-9]。果胶具有良好的生物相容性、降解性和无毒性,成为生产环保型生物薄膜的首选材料;作为天然高聚物,因其凝胶性,使其制备可食性薄膜成为可能[10]。果胶基薄膜和其他许多可生物降解的薄膜一样,作为气体和水分流动的屏障,以延长保质期和保持食品的质量[11]。果胶具有携带功能性物质的潜力,可以作为活性物质的载体,用于开发营养强化的可食用薄膜[12]。可食性膜作为活性食品包装材料,它可以携带各种抗菌药物在包装系统中,由于活性物质可以连续迁移到食物中,比直接应用抗菌物质可以更有效[13]。
姜黄素(curcumin,Cur)是一种多酚类生物活性化合物,来源于草药和膳食香料姜黄,具有抗炎、抗氧化,抗癌,抗突变,抗生素,抗病毒,抗真菌,抗淀粉样,抗糖尿病等多种药理和生物活性[14-15]。临床试验表明,口服姜黄提取物耐受性良好,且未观察到剂量限制毒性[16]。姜黄素因其众多的药理作用和固有的无毒性,已成为传统药物,并被用作天然食品添加剂[17]。
果胶作为一种膳食纤维,能够降低血清胆固醇和血糖含量,被称为“人体健康的平衡素”[18];同时也是一种优良的药物制剂基质,可被用于制药、健康促进和治疗等方面[19]。基于近年来天然多糖在生理功能方面的突破性研究[20]及天然药食同源材料的优良特性,在食用膜中添加姜黄素,制备无增塑剂、表面活性剂等添加的可食性膜,用于食物包装或保鲜,可提高食品的附加值,增强竞争力,而且对人体有益。
目前,果胶膜的研究主要集中在果胶改性膜的研究方面,而在胶性参数下、纯天然高聚物凝胶膜的研究不多;此外,果胶膜反应的条件也没有统一标准,实验室成膜往往膜的厚度、均一性等较难控制。本试验基于低酯果胶凝胶机理和成膜性能,拟以钙离子为交联剂,在设定凝胶性参数条件下制备果胶膜,并对该膜进行表征和性能研究,以拓宽天然多糖的应用领域。在膜的外观评价、力学性能、体外降解和透光性等一系列性能测试基础上,最终确定果胶最适浓度、钙离子浓度、反应温度和时间,再加入合适剂量的药食同源材料姜黄素。通过载药膜在不同pH 值释放介质中的体外释药行为,探究果胶-钙交联网络结构对释药性能的影响,以期对可食性包装膜的制备及其应用提供依据。
1 材料与方法
1.1 材料及设备
低酯果胶(食品级):烟台安德利果胶有限公司;姜黄素(纯度99.9%)、无水氯化钙(分析纯)、胃蛋白酶(酶活力≥1 200.0 U/g)、果胶酶(酶活力≥50.0 U/g):国药集团化学试剂有限公司;无水磷酸二氢钠(纯度99.0%)、磷酸氢二钠(分析纯):上海阿拉丁生化科技股份有限公司。
DF-101Z 磁力加热搅拌器:郑州长城科工贸有限公司;752N 型紫外-可见光分光光度计:上海菁华科技仪器有限公司;AL1194 数显螺旋测微仪:上海凡莜工具有限公司;LGD5000 电子万能拉力试验机:厦门易仕特仪器有限公司;PHS-25 型pH 计:上海仪电科学仪器股份有限公司;D8 ADVANCE A25 型X 射线粉末衍射仪:北京爱科思瑞技术有限公司;JEM-2100F 场发射投射电子显微镜:日本电子株式会社;DSC-1 示差扫描量热仪、ME204E 电子天平:梅特勒-托利多仪器(上海)有限公司;SHA-B 数显恒温水浴振荡器:天津赛得利斯实验分析仪器制造厂。
1.2 方法
1.2.1 膜的制备
配制不同质量浓度的果胶液100 mL,静置数小时待其充分溶胀,玻璃棒搅拌使其完全溶解,将胶液移至250 mL 具塞圆底烧瓶,置于恒温搅拌条件下,使用恒压分液漏斗缓慢滴加10 mL 的CaCl2溶液进行离子交联反应。待果胶-钙交联反应一定时间后,采用流延法,将胶液趁热浇注于直径为60mm 的聚乙烯平皿内,静置、待成凝胶后,于37 ℃下烘干,起膜后24 h 后用于性能测试。为了减少膜厚度的差异性,胶液须注满至边缘线。
1.2.2 膜的性能测定
1.2.2.1 膜厚度测定
采用精度为0.001 mm 的螺旋测微仪测定,在膜的中心及对称的周边位置随机选取5 个点测定厚度,取其平均值。
1.2.2.2 透光性测定
将复合膜润湿后裁剪成与比色皿侧面积一样大小的形状,贴附于比色皿外表面,保持平整,避免出现褶皱和气泡,以空比色皿为参比,测定膜在360 nm~860 nm 波长范围内的透光率[21]。
1.2.2.3 力学性能测定
将膜剪成一定规格的长方形,用电子万能拉力试验机进行拉力测试,测定复合膜的拉伸强度(tensile strength,TS)及断裂伸长率(elongation at break,EAB)[8]。夹距L0为20 mm,拉引速率为10 mm/min,每组膜测定3 次。测定温度(25±2)℃,相对湿度(50±3)%。
根据拉力和位移,利用公式(1)和(2)计算膜的拉升强度和断裂伸长率:
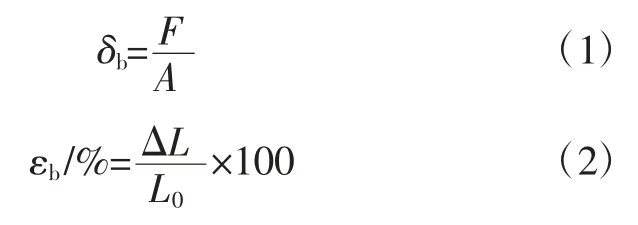
式中:δb为拉伸强度,MPa;F 为拉力,N;A 为截面积,m2;εb为断裂伸长率,%;ΔL 为位移,mm。
1.2.2.4 降解时间测定
取均匀膜剪成10 mm×20 mm 的长方形,分别放入等量人工体液中,置于37 ℃、转速为50 r/min 的恒温振荡仪中,以肉眼看不到膜碎片为标准,待膜完全降解、记录体外降解时间。
使用不同pH 值的磷酸盐缓冲液(phosphate buffer saline,PBS)进行人工体液的配制[22-23]。
1)模拟胃液:pH1.20 的盐酸液,其中加入0.32%的胃蛋白酶。
2)模拟小肠液:pH6.86 的 PBS 缓冲液。
3)模拟结肠液:pH7.40 的 PBS 缓冲液,其中加入0.25%的果胶酶。
1.2.3 膜的表征
1.2.3.1 差示扫描量分析(differential scanning calorimeter,DSC)
采用差示扫描量热仪,样品被精确地称重后置于密封的铝制锅内,加热速率为10 ℃/min,从0 ℃到300 ℃[24]。
1.2.3.2 X 射线衍射分析(X-ray diffraction,XRD)
将膜剪成直径为20 mm 的圆形,置于X 射线衍射仪下进行分析。扫描电压为220 V,扫描速度2 θ/min,衍射角 5°~80°[25]。
1.2.3.3 微观形貌观察(scanning electron microscope,SEM)
将膜分别置于×1 000 倍扫描电镜下,观察膜表面的微观形态。
1.2.4 载药及体外释药性能
以姜黄素为模型药物,在制膜过程中加入2 g/L 的姜黄素乙醇溶液,采用流延法成膜。
1.2.4.1 姜黄素含量测定
1)检测波长的确定:以相应空白膜的PBS 缓冲液和乙醇为参比,在300 nm~700 nm 波长范围内扫描,确定最大吸收波长λmax 为427 nm。
2)标准曲线的建立:精密称取5.0 mg 姜黄素标准品,置于100 mL 棕色容量瓶中,加75%乙醇溶解并定容至刻度线。精密移取 0.5、1.0、1.5、2.0、2.5 mL 标准品溶液置于25 mL 棕色容量瓶中,加乙醇定容至刻度线,摇匀,于427 nm 处测其吸光度。以浓度C(μg/mL)为横坐标,吸光度A 为纵坐标,绘制标准曲线,并进行线性回归。得到标准曲线方程为:A=0.142 4C-0.001 8,其中r=0.999 9。结果表明,姜黄素在 1.0 μg/mL~5.0 μg/mL浓度范围内存在良好的线性关系。
3)膜中姜黄素含量计算:以加入姜黄素总质量(mg)除以所制备药膜的干燥恒重质量(g),计算所得药膜中药物含量。
1.2.4.2 体外释放度的测定
选取20 mm×20 mm 大小的均匀膜,置于装有30 mL加入人工胃液、小肠液、结肠液的棕色释药杯中,将杯放入温度为37 ℃、转速为100 r/min 的恒温水浴振荡器中,按照一定的释药时间取样[26],通过紫外分光光度法测定释放介质中姜黄素含量,按(3)式计算累积释放度[23],绘制不同人工体液中药物累积释放度和时间之间的关系曲线,以考察果胶-姜黄素膜的体外释药行为。
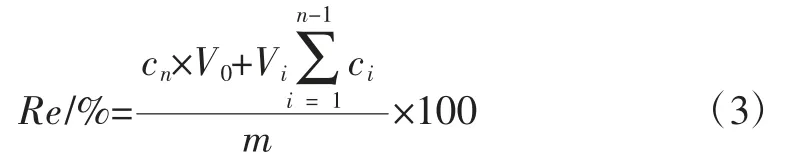
式中:Re 是累积释放度,%;cn为第 n 次取样后释放介质中药物浓度,mg/mL;V0为释放介质的体积,mL;Vi为每次取样的体积,mL;ci为第 i 次取样置换时释放介质中药物浓度,mg/mL;m 为试样膜剂中药物含量,mg。
1.3 数据统计
采用Origin8.5 和SPSS24.0 软件进行绘图和数据统计分析,数据结果采用均值±标准差表示。
2 结果与分析
2.1 力学性能分析
膜的力学性能是表征天然高分子膜材料抵抗外力破坏的能力,也是决定膜材料是否具有潜在应用价值的主要因素,通常用拉伸强度和断裂伸长率来描述。55 ℃下交联2 h 所制备的不同浓度果胶膜的力学性能测试结果如表1 所示。
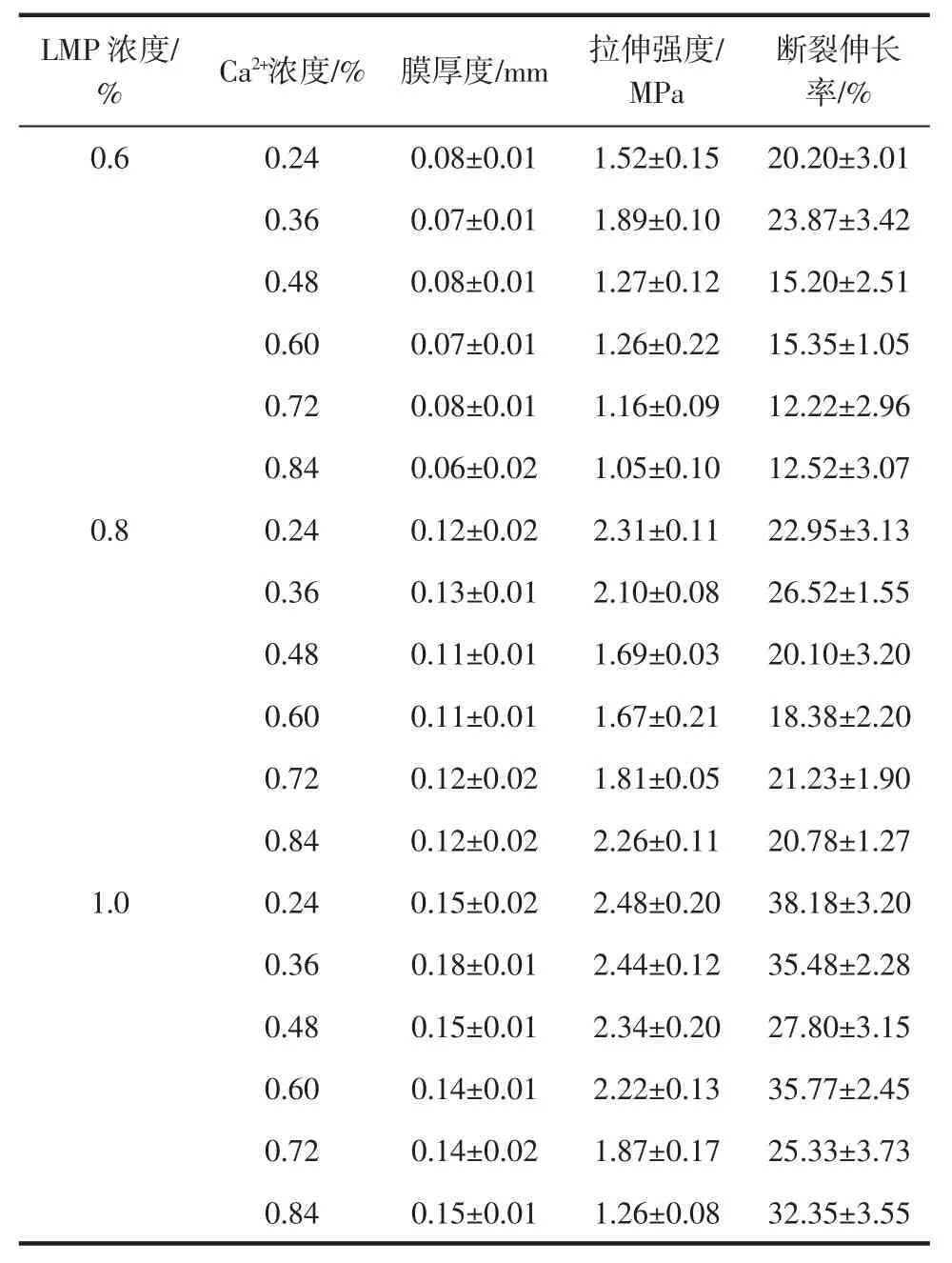
表1 Ca2+浓度对不同浓度果胶膜厚度和力学性能的影响Table 1 Thickness and mechanical properties of pectin films under different Ca2+concentrations
由表1 可知,钙离子浓度对不同浓度果胶膜力学性能影响不同,这是由于果胶分子自身结构的复杂性和果胶-钙凝胶机理的复杂性共同造成的。离子交联是由不同分子链上羧基之间的钙桥构成的,通过离子交联形成的有效连接区随着钙离子含量的增加半径略微增加[20],在膜的力学性能上未能明显体现。0.6%、0.8 %、1.0 %的膜分别在Ca2+浓度为0.36 %、0.36 %、0.24%的条件下具有较高的拉伸强度和断裂伸长率。当果胶浓度0.6%、Ca2+浓度为0.24%时,未能形成固态凝胶,可能由于二者浓度较低,所形成的有效连接区过少,交联网络结构疏松所致。果胶浓度为1.0%的膜的拉伸强度,随钙离子浓度增加呈现下降趋势,可能由于果胶-钙过度交联,导致凝胶析水所致。
相同Ca2+浓度、温度(55 ℃)下,制备的不同浓度果胶膜的力学性能测试结果如表2 所示。
由表2 可知,不同交联时间对果胶膜的力学性能无明显差异性影响。当交联时间过短时,交联反应不充分进而影响膜的力学性能;一般情况下,随着果胶浓度或Ca2+浓度增加,交联时间应相应增加;当交联时间过长时,发生断链或β-消除反应[27],降低膜的力学性能。根据如上果胶膜力学性能测试结果,交联时间选择 2 h~4 h 为宜。
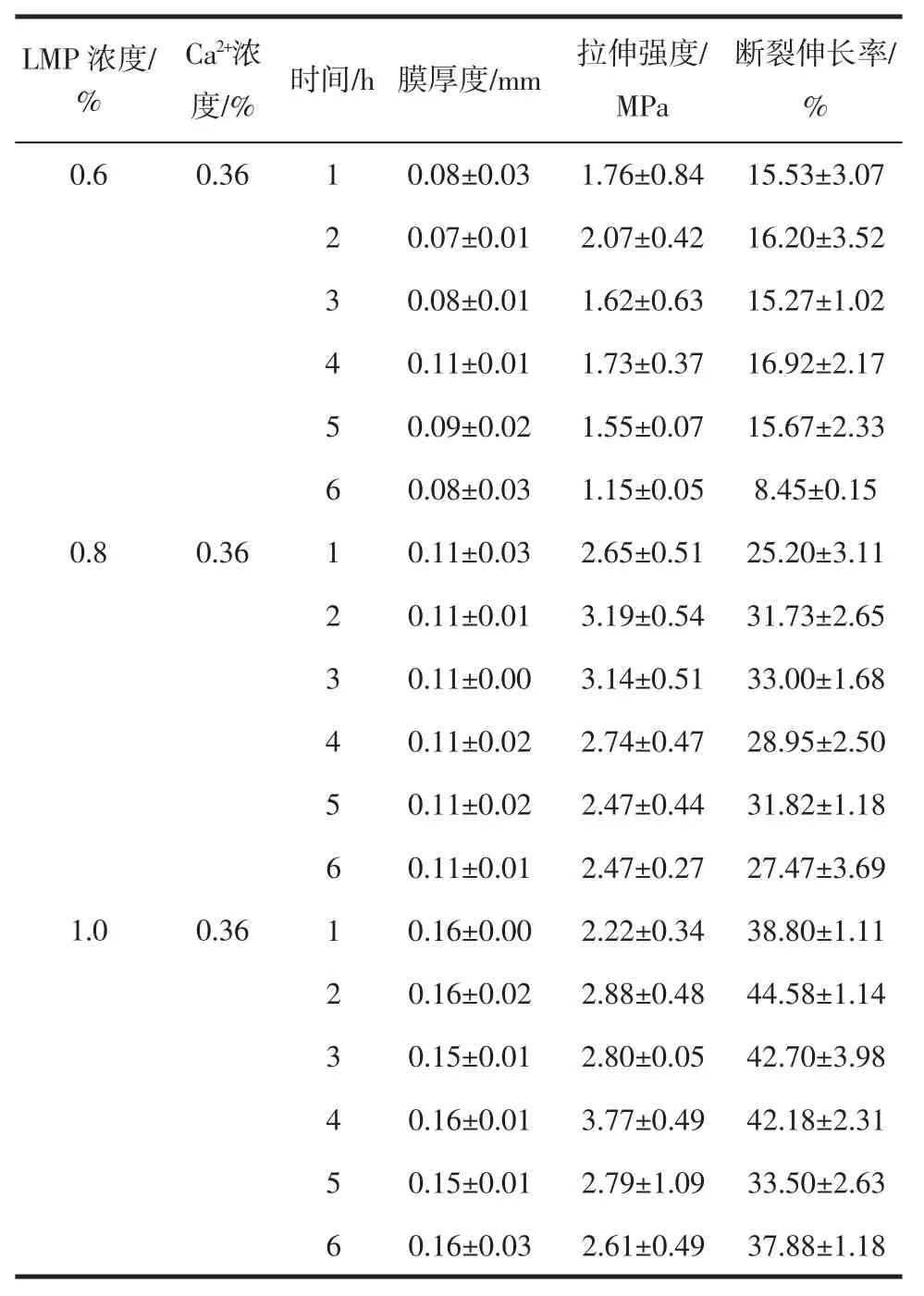
表2 交联时间对果胶膜厚度和力学性能的影响Table 2 Thickness and mechanical properties of pectin films at different cross-linking times
相同Ca2+浓度下、交联2 h 所制备的不同浓度果胶膜的力学性能测试结果如表3 所示。
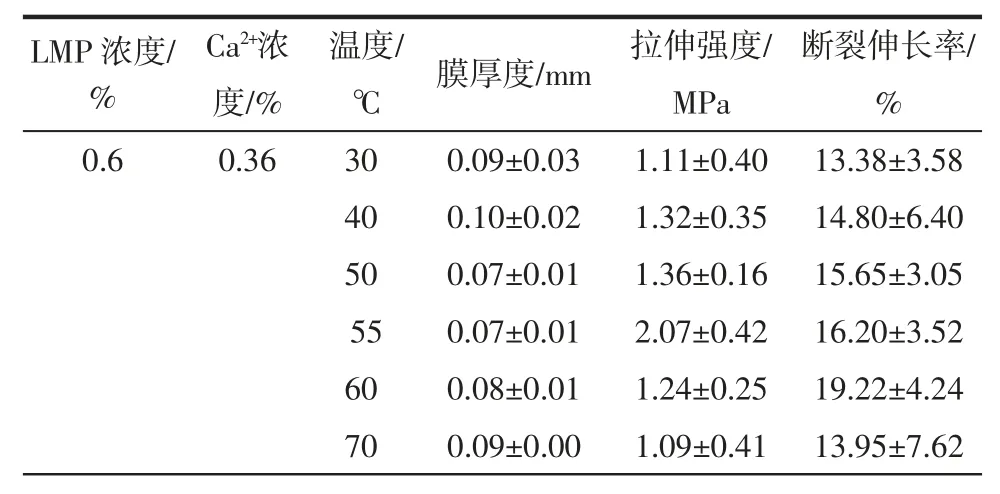
表3 交联温度对果胶膜厚度和力学性能Table 3 Thickness and mechanical properties of pectin films at different cross-linking temperatures
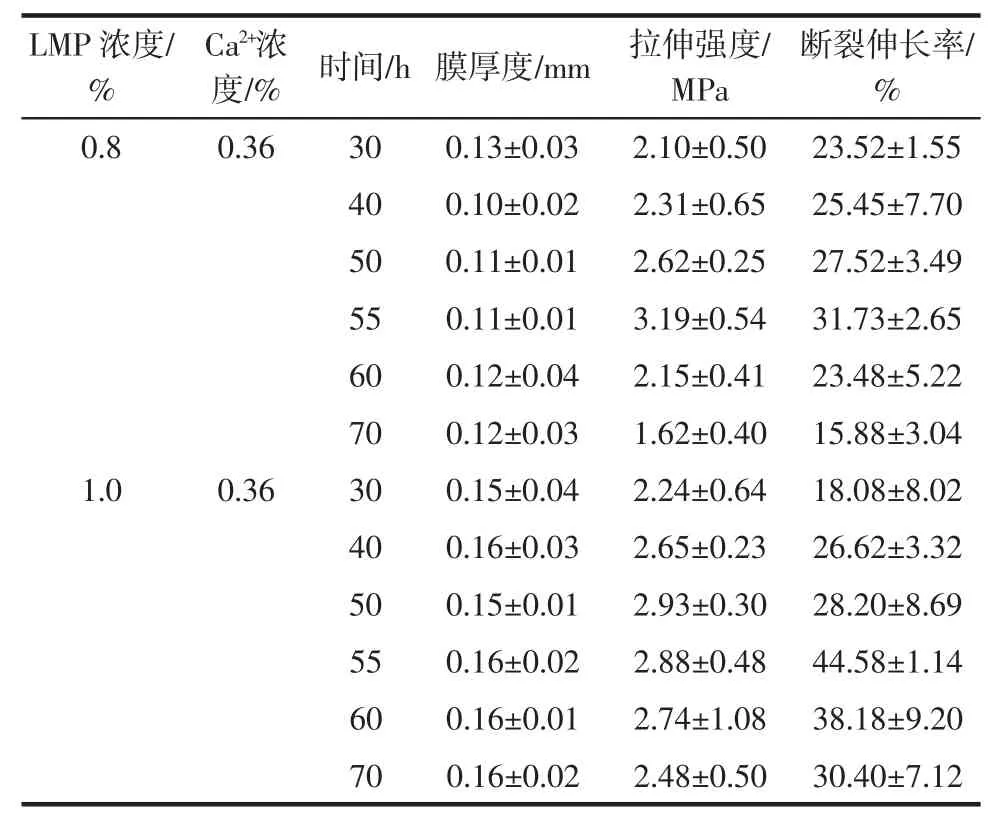
续表3 交联温度对果胶膜厚度和力学性能Continue table 3 Thickness and mechanical properties of pectin films at different cross-linking temperatures
由表3 可知,不同交联温度对果胶膜的力学性能影响不同,随温度升高,膜的断裂伸长率均出现先增大后减小的趋势;交联温度为55 ℃时,膜具有较高的拉伸强度。当交联温度偏低时,随着果胶浓度增加,果胶水溶性降低,胶液不均相程度提高,膜的均匀程度降低,对膜的力学性能造成较大影响;温度较高,随着搅拌时间增加,果胶链会发生断链或β-消除反应增强,凝胶能力降低,影响膜的力学性能。故交联温度宜选择在 50 ℃~60 ℃之间。
综上所述,选择0.6%~1.0%果胶浓度,在0.24%~0.84%Ca2+浓度下,交联温度 30 ℃~70 ℃,交联时间 1 h~6 h 即凝胶条件下,均能成功制备出不同力学性能的果胶膜。
2.2 透光率分析
膜的透光率能够反映果胶-钙交联所成凝胶的均相程度,透光率越高均一相越好。不同浓度果胶膜的透光率随波长的变化曲线如图1 所示。
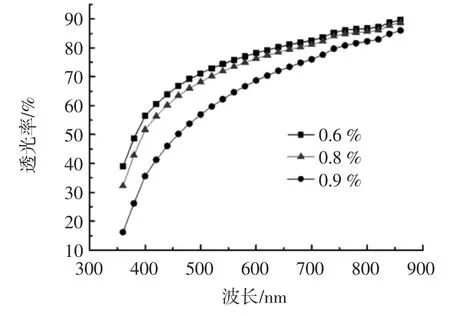
图1 不同果胶膜的透光率Fig.1 Transmittance of different pectin concentration films
由图1 可知,所制备的果胶膜,均匀程度良好,在360 nm~860 nm 波长范围内,透光率随波长的增大而增大,随果胶浓度增大而降低。当果胶浓度增大,胶液中固形物量增加,所成凝胶均相程度下降,同时膜的厚度增加,致使膜的透光性降低。
2.3 体外降解分析
不同浓度的果胶-钙凝胶膜体外降解时间如图2所示。
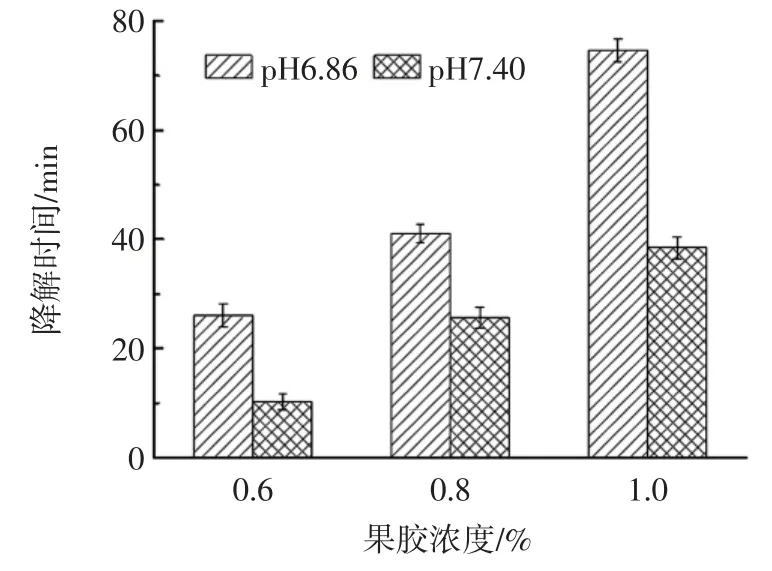
图2 不同浓度果胶膜的体外降解情况Fig.2 In vitro degradation of different pectin concentration films
由图2 可知,随果胶浓度增加,降解时间延长;人工结肠液中降解所需时间最少;人工胃液中,凝胶膜12 h 未见降解。这是由于果胶为聚阴电解质,酸性条件下,质子化程度高,分子链间强烈的静电作用使得水分子难以穿透果胶-钙交联网络结构,不利于水分的运输,膜的水溶性降低。表明果胶膜具有一定的结肠靶向性,可用于靶向药物的包衣材料。
2.4 XRD分析
当X 射线通过某种物质时,每一种物质都有自己的独特的衍射峰。当物质结构发生变化时,相应特征峰也会改变[28]。所以可通过XRD 图谱上特征峰的变化来判断果胶分子在Ca2+的作用下是否发生离子交联反应。果胶和姜黄素不同状态下的XRD 谱图如图3所示。
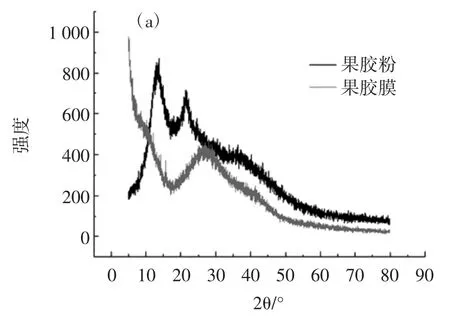
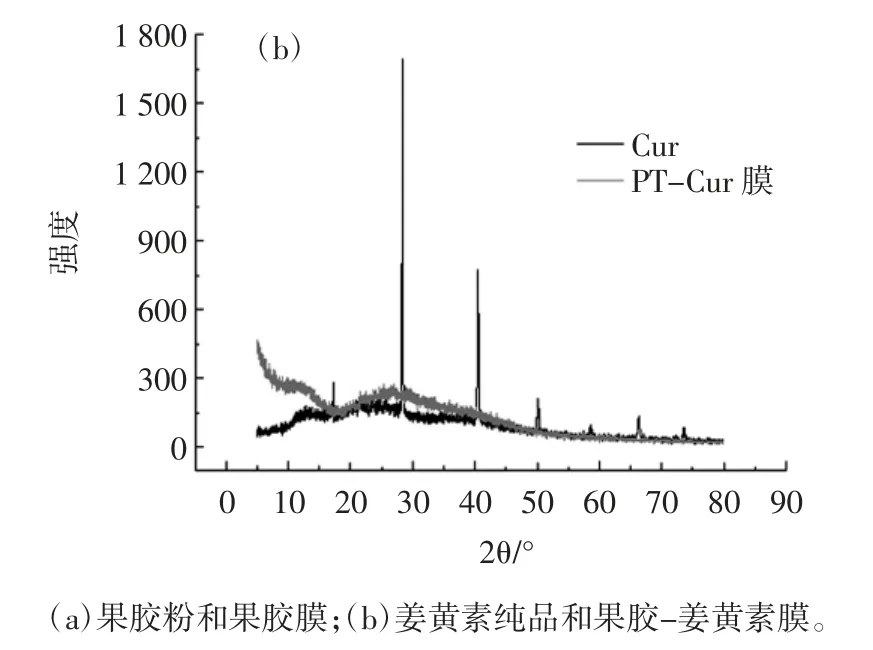
图3 果胶和姜黄素不同状态下的X 射线衍射光谱Fig.3 X-ray diffraction spectra of pectin and cur under different conditions
如图3(a)所示,果胶粉末在 13°和 21°处有两个明显的特征峰。在Ca2+交联作用下,果胶膜13°处的衍射峰消失,21°处的衍射峰向右迁移,且强度减弱,这是果胶-钙分子之间相互作用的结果。如图3(b)所示,姜黄素在 17、28、40、50°和 66°处有 5 个明显的衍射峰,峰强度大且峰面窄,表明姜黄素以晶体形式存在。所制备的PT-Cur 载药膜,姜黄素的特征峰在载药膜中未呈现,可能由于药物小分子嵌入果胶-钙交联网络结构所致。表明果胶多糖可以作为药物的优良载体,能够完全包覆姜黄素,使晶型药物未漏出。
2.5 形貌分析
对不同果胶膜和载药膜进行外观和微观形貌观察,结果如图4。

图4 不同果胶膜的形貌Fig.4 Surface morphologies of different pectin gel films
图4(a)~(c)显示了不同浓度果胶膜的外观形貌,随着果胶浓度的增加,膜厚度增加,颜色变深。图4(d)为载姜黄素药膜,膜表面光滑、平整,药物均匀分散于膜中、无相分离现象。电镜扫描结果如图 4(e)和(f),图4(e)显示膜表面平整、均匀,致密、无孔洞和裂缝,具有良好的结构完整性。表明果胶-钙通过离子交联形成强而紧密的凝胶网络结构。图4(f)显示,纯果胶基药膜中姜黄素晶体形态未被破坏,主要以针形和棒形均匀分散于药膜中。表明果胶-钙凝胶网络结构能够对药物起到良好的包埋作用,有效保护药物晶型不受损,可以作为晶型药物的优良载体。
2.6 DSC分析
图5 显示了示差扫描量热法获得的两种膜的热行为。
DSC 曲线表明,在温度低于100℃时,果胶膜和果胶-姜黄素膜均有广泛的吸热性能,为相应膜中水分的蒸发;其中载药膜锁水性能较强,蒸发温度较纯果胶膜高。在180 ℃左右的吸热带,由姜黄素热降解引起的。在200 ℃以上时,观察到放热带,这是由多糖的热降解引起的[24]。
2.7 姜黄素含量
在果胶浓度0.8%、Ca2+浓度0.36%、交联温度55 ℃、时间2 h 的成膜条件下,添加姜黄素乙醇溶液,制备出的果胶膜中姜黄素(24.35±5.08)mg/g,且质量差异小于5%。
2.8 体外释药性能分析
整个释药过程中,人工胃液中的姜黄素释放量低于检测下限,可视为不释药。PT-Cur 膜在人工肠液中释药曲线如图6 所示。
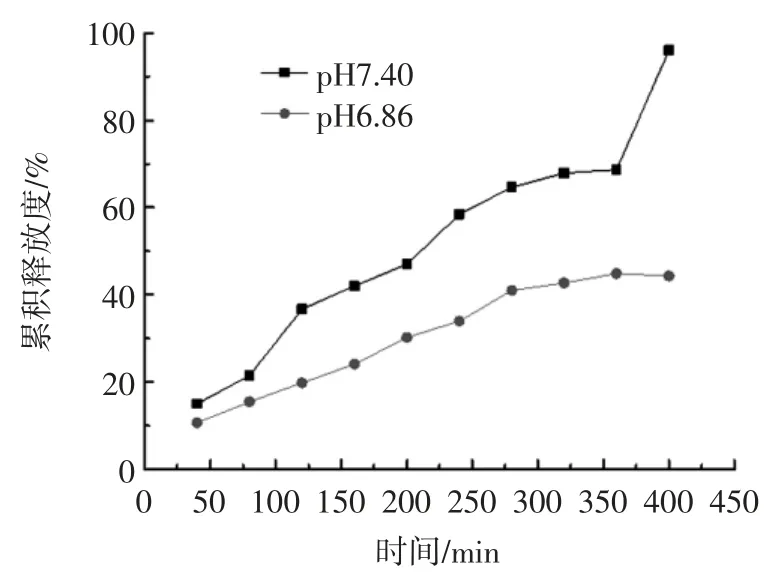
图6 果胶-姜黄素药膜体外释药曲线Fig.6 Drug release in vitro of edible PT-Cur film
由图6 可知,随介质pH 值增大,相同时间内的累积释放度增大;在pH 6.86 释放介质中,6 h 中累积释放度小于50%,显示出缓释效果;在pH 7.40 释放介质中,6 h 中累积释放度达到70%,6 h 后显示突释行为。果胶为聚阴电解质,酸性条件下由于强烈的静电作用使分子链以聚集态存在,膜剂中姜黄素基本不释放;随pH 值增大,果胶分子中羧基质子化程度减弱,分子链以舒展态存在,且发生不同程度降解,交联网络结构溶蚀,姜黄素释放度增大。
人体中没有果胶酶,只有当药膜到达结肠后,在结肠各种微生物的作用下,果胶发生降解[29],姜黄素得以集中释放。此外,膜中的钙离子能增加某些酶的活性[30],从而加快果胶-钙交联网络的瓦解、药物骨架的溶蚀,使药物更快地释放。给药体系的这种特点有助于结肠定位递药系统的构建。
3 结论
果胶凝胶化是一个非常复杂且包含多种分子间相互作用的过程,除受果胶自身结构的复杂性影响外,还受到很多外在因素如离子强度、温度、共溶物等影响,钙含量和果胶浓度对低酯果胶凝胶的影响尤为显著。果胶分子链通过钙桥交联形成溶胶、凝胶和非均相析水凝胶3 种形式胶态[20]。在凝胶基础上制备的果胶膜,其力学性能受果胶浓度影响最为显著。果胶浓度较低时,形成的果胶-钙有效交联区少,交联网络结构较为疏松,致使膜薄软、完整性差,力学性能较低,体外降解时间短。随果胶浓度增加,膜厚度增加,力学性能提升,体外降解时间延长,透光性下降。当果胶浓度过大时,果胶-钙之间会因过度交联而产生凝胶析水现象,导致凝胶发生相分离,降低膜的均匀程度甚至成膜能力,影响膜的各项性能。
姜黄素在果胶膜中含量为(24.35±5.08)mg/g,主要以针形和棒形存在;XRD 分析表明,果胶膜对姜黄素起到了良好的包埋作用;DSC 曲线表明,小分子药物的嵌入能够改变果胶-钙凝胶网络结构的热稳定性。
药物溶出主要伴随着膜的降解,所制备的果胶基药膜在不同的释药介质中均具有缓、迟释效果,在人工胃液中低于检测下限,一定程度表明果胶具有结肠递药靶向性。此外,若选择乙醇作为药物溶剂时,由于乙醇能够使果胶聚集沉析,其加量会成为影响果胶基药膜形貌组织的显著因素之一。
