改性壳聚糖用于平衡剂脱钒的再生工艺研究
2019-09-18刘伟志任满年曹发海
刘伟志,耿 桐,任满年,曹发海
(1.华东理工大学化学工程系,上海 200237;2.中国石化洛阳分公司)
在流化催化裂化(FCC)过程中,为了维持催化剂的反应活性和选择性,必须持续加入一定量的新鲜催化剂,并定期卸出部分平衡剂[1]。这种平衡剂上沉积了大量的镍、钒等有毒有害金属,已被国家列入危险废物名录,严禁采用填埋方法处理。随着原油重质化和劣质化及市场对轻质油需求量的日益增加,FCC平衡剂产量越来越大。沉积在平衡剂表面上的钒会逐渐迁移到催化剂孔道中,造成分子筛结构坍塌而永久失活[2]。采用脱金属的方法对平衡剂进行再生,可提高其活性,减少废催化剂引起的环境污染和降低企业的运营成本,具有良好的社会效益和经济效益[3]。
目前FCC平衡剂的脱金属方法多种多样,如酸洗法、磁分离、Demet法以及加碳氯化法等[4-7],其中大多存在成本高、投资大、设备复杂、条件苛刻等问题,还可能对环境造成二次污染。壳聚糖(CTS)是天然手性高分子甲壳素在碱性条件下水解脱除乙酰基生成的衍生物,易获得且成本低,由于其分子中富含氨基(—NH2)和羟基(—OH),可以和多种金属发生络合反应,达到脱金属的目的[8-11]。然而,CTS脱钒的效果并不理想,原因是在酸性条件下壳聚糖络合金属能力不强,而在其分子中引入二硫代氨基甲酸(DTC)基团[12]时,因分子中S原子上有孤对电子,容易极化产生负电场,能捕捉金属离子形成正四面体结构,生成稳定的螯合物,这样就增加了脱金属剂的吸附点位,从而提高脱金属率,同时克服了壳聚糖在酸性条件下络合能力弱的缺点。基于此,本研究提出将改性壳聚糖作为新型脱金属剂应用于平衡剂脱钒的新构想,即以壳聚糖为原料,在碱性条件下与CS2发生亲核加成反应,制备新型脱金属剂改性壳聚糖DTC-CTS。DTC-CTS分子中含有氨基(—NH2)、羟基(—OH)、硫羰基(—CS)和大量孤对电子,螯合能力强,几乎可与所有过渡金属离子结合。本研究探索DTC-CTS的合成工艺及用于脱除FCC平衡剂中钒的适宜工艺条件;采用XRD,BET,SEM等表征方法分析研究再生前后FCC催化剂的比表面积、孔体积和微观表面结构变化,以及催化剂中Y型分子筛的保留度;采用ACE评价装置考察再生前后催化剂的微反活性。
1 实 验
1.1 试剂及仪器
试验所用平衡剂由中国石化洛阳分公司提供,其金属钒的质量分数为0.47%,微反活性为58%。所用化学试剂主要包括:氢氧化钠(分析纯),壳聚糖(脱乙酰度≥95%),二硫化碳(分析纯),冰醋酸(分析纯),甲醇(分析纯),乙醇(分析纯),丙酮(分析纯)。
采用美国Agilent公司生产的等离子体发射光谱仪(ICP-AES)测定催化剂的金属含量。分析波长为177~785 nm,光学分辨率为0.009 nm(200 nm处),等离子气体流量为15.0 Lmin,辅助气流量为1.50 Lmin,仪器稳定时间为15 s,雾化气压为200 kPa。
采用美国Thermo Nicolet公司生产的红外光谱(IR)仪进行DTC-CTS结构分析。
采用德国Siemens公司生产的D5005型X射线衍射仪进行催化剂结构表征。Kα辐射,管电压为30 kV,管电流为20 mA,步进扫描(步幅0.02°),预置时间为2 s,扫描范围为5°~70°。
采用美国Micromerities公司生产的ASAP2400型自动吸附仪进行比表面积、孔体积以及孔径分布测定。样品在2 Pa、300 ℃条件下抽真空脱气5 h,以N2为吸附介质,在88.5 K条件下等温吸脱附,测定吸附等温线。
采用日本JEOL公司生产的扫描电子显微镜(SEM)进行催化剂形貌分析。
采用Agilent公司生产的7890A型色谱仪测定反应液体产物的组成。色谱柱长30 m、内径0.25 mm,液膜厚度0.25 μ m;汽化室温度280 ℃;检测器温度280 ℃;柱温:初始温度35 ℃,保持0.5 min,以12 ℃min的速率升至235 ℃,保持5 min;载气:高纯氮;进样量0.4 μ L。
1.2 制备改性壳聚糖DTC-CTS
将2 g壳聚糖CTS溶于200 mL甲醇中,在搅拌下加入质量分数为40%的NaOH溶液18 mL,室温溶胀2 h,并在2 h内缓慢滴加10 mL CS2和30 mL乙醇的混合液,然后升至一定温度,反应2~14 h。待反应结束后用纯水洗涤产物,然后用乙醇和甲醇反复洗涤产物,最后再用丙酮脱水,在50 ℃的烘箱里干燥1 h,得到改性壳聚糖DTC-CTS。
DTC-CTS合成反应式如下:

1.3 脱金属实验
催化剂预处理:将催化剂放入马弗炉,在650 ℃下焙烧3 h,以除去催化剂上沉积的焦炭,恢复部分活性中心,同时增加催化剂表面的钒与脱金属剂的接触几率,提高脱钒率。
脱金属溶液的配制:取0.5 g制备好的DTC-CTS于烧杯中,加入150 mL水,快速搅拌,使其均匀分散在水溶液中,在搅拌的过程中,匀速倒入5 mL乙酸,这样制得的脱金属溶液的溶解效果好,有利于后续脱金属试验的进行。
将配制好的200 mL脱金属溶液倒入500 mL圆底烧瓶中,加入预处理后的催化剂0.5 g(粉末状),在一定温度下,于转速400 rmin的条件下搅拌,反应一定时间。反应结束,静置沉降1 h,之后取反应清液,用ICP-AES测定溶液中钒的含量,计算出脱钒率。
1.4 催化剂活性评价
反应后的催化剂用水反复洗涤,干燥,用于表征和活性测试。
从反应液体产物的色谱图及积分仪中计算出汽油的面积百分比G1,液体产物中汽油的真实质量分数G按式(1)计算。然后按式(2)计算微反活性指数MA。
G=K1G1
(1)
(2)
式(1)中,K1为色谱的汽油含量修正系数。式(2)中:W1为液体产物质量,g;W为进油量,g。
2 结果与讨论
2.1 DTC-CTS合成条件对脱钒效果的影响
在制备改性壳聚糖(DTC-CTS)的过程中,氨基与CS2的加成反应步骤里,随着反应时间的增加,合成的DTC-CTS颜色有所不同,可能是合成时伴随有副产物的出现所致。为制得脱金属效果更好的DTC-CTS,需先确定最优合成时间,在合成温度 50 ℃条件下,考察合成反应时间对DTC-CTS脱钒率的影响,试验结果如图1所示。从图1可以看出:未改性的壳聚糖(合成反应时间为0)用于脱金属实验时,脱钒率为21.1%;随着合成时间的增加,脱钒率逐渐提高,在10 h时达到最高,脱钒率为45.3%,这是由于随着反应的进行,更多的CS2与氨基加成,形成了更多吸附金属的活性位点,故脱钒率也随之提高;反应进行到14 h时,脱钒率下降到35.2%,可能的原因是随着反应时间继续延长,反应深度不断增加,且在碱性溶液中,仲胺和伯胺与OH-发生反应生成仲胺或伯胺离子,部分产物与反应体系中的伯胺离子反应生成了NaHS,从而形成了橙红色的副产物,导致脱金属活性位数量减少,脱钒率下降。为了得到效果更好的脱金属剂DTC-CTS,将适宜的合成时间定为10 h。
其次,考察了DTC-CTS合成温度对脱钒率的影响,试验结果如图2所示。从图2可以看出:在合成温度为30 ℃时,脱钒率只有32.3%;随着合成温度的升高,脱钒率逐步提高,当合成温度达到50 ℃时,脱钒率达到45.3%;此后随着反应温度升高,脱钒率开始下降,产物颜色加深变暗。这是因为在50 ℃后,随着温度的升高,副反应逐渐发生,温度过高会使得生成的二硫代甲酸盐更容易和溶液中的仲胺和伯胺离子反应,导致合成产物含量下降,造成DTC-CTS脱钒率的下降。故将适宜的合成温度定为50 ℃。
因此,DTC-CTS的最优合成条件定为:反应温度50 ℃,反应时间10 h。此最优合成条件下制备的DTC-CTS和CTS的红外光谱如图3所示。由图3可以看出:DTC-CTS的谱图中存在DTC基团特征谱带;对比波数为3 421 cm-1处的vO-H和波数为2 971 cm-1处的vN-H谱带,DTC-CTS峰强较CTS峰强明显减弱,这说明—NH2和—OH上有可能发生了反应;CTS中波数为1 386 cm-1(vC-N)处的吸收峰和波数为1 081 cm-1(vC-O)处的吸收峰在DTC-CTS谱图中减弱,说明仲胺和仲羟基与CS2发生了加成反应;DTC-CTS谱图中,波数为1 453 cm-1(vC-NS2)和865 cm-1(vC-S)处出现新的吸收峰,这是DTC基团的特征谱带。上述结果表明改性壳聚糖DTC-CTS制备成功。
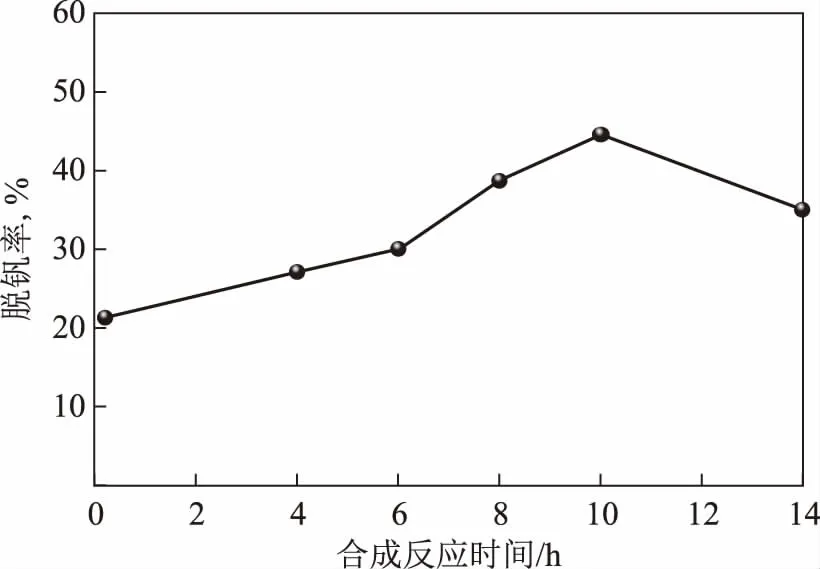
图1 DTC-CTS合成时间对脱钒率的影响

图2 DTC-CTS合成温度对脱钒率的影响
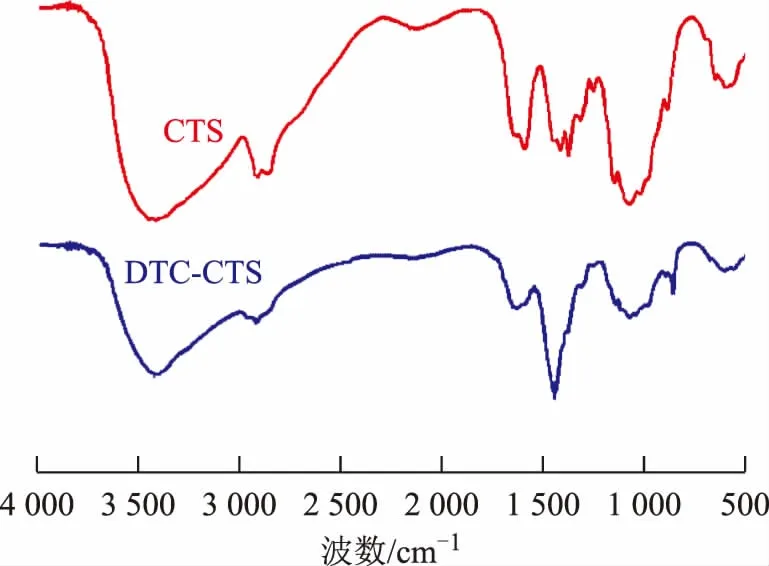
图3 DTC-CTS和CTS的红外光谱
2.2 工艺条件对脱钒效果的影响
2.2.1 反应温度将0.5g DTC-CTS脱金属剂溶解于150 mL质量分数为3.2%的乙酸水溶液中,配制成脱金属溶液,在平衡剂0.5 g、反应时间4.5 h、转速400 rmin、沉降时间1 h的条件下,反应温度对催化剂脱钒率的影响如图4所示。由图4可以看出:当反应温度为25 ℃时,脱钒率只有25.2%;随着温度逐步升高,脱钒率逐渐上升且趋于平缓;当温度达到125 ℃时,脱钒率达到54.8%;当温度达到150 ℃时,脱钒率没有明显变化。这是因为随着温度的升高,溶液中的DTC-CTS获得能量,加剧布朗运动,从而与FCC催化剂上的金属钒碰撞更加激烈,有利于脱金属剂DTC-CTS与钒的结合。但是当温度超过125 ℃时,吸附达到饱和,脱钒率不再提高,这是因为平衡剂上的一部分钒沉积在孔道内部深层,已经渗透到沸石晶格中[13],无法与脱金属剂发生有效碰撞,故限制了脱钒效果。因此,DTC-CTS对钒吸附的最佳温度为125 ℃。
2.2.2 反应时间将0.5 g DTC-CTS脱金属剂溶解于150 mL质量分数为3.2%的乙酸溶液中,配制成脱金属溶液,在废催化剂0.5 g、反应温度125 ℃、转速400 rmin、沉降时间1 h的条件下,反应时间对催化剂脱钒率的影响如图5所示。由图5可知:随着反应时间的增加,脱钒率不断上升,在反应进行到4.5 h时达到峰值,此时脱钒率为54.8%;随后反应趋于平衡,脱钒率不再上升。这是因为反应开始时催化剂对V2O5的吸附是一种表面吸附,吸附的是沉积在平衡剂外表面的V2O5,吸附速率较大。当表面吸附达到平衡后,表面的V2O5被脱除,平衡剂孔道内部的V2O5由于温度太低,无法形成熔融状态迁移到外表面,吸附达到饱和[13]。因此,DTC-CTS对钒吸附的最佳时间为4.5 h。

图5 反应时间对脱钒率的影响
2.3 催化剂结构分析
2.3.1 分子筛保留度为探究再生工艺对催化剂结构的影响,对实验室再生FCC催化剂(再生剂)、平衡剂和新鲜FCC催化剂(新鲜剂)进行XRD表征,结果如图6所示。由图6可以看出:2θ为6.3°,10.3°,12.1°,16.0°处所对应的d值(镜面间距)分别为101,16,10,14(JCPDS No.77-1550),3种催化剂均存在活性结构Y型分子筛的特征衍射峰[14],说明再生剂相比于平衡剂的结构没有被破坏,且再生剂与平衡剂无明显的峰值差异,这意味着该再生工艺处理的FCC催化剂中分子筛没有发生晶胞收缩,粒子结构和尺寸无明显变化,仍属于Y型分子筛,分子筛保留度高;然而,FCC催化剂会有一部分分子筛在使用过程中结构被破坏,造成了再生剂的响应峰峰值比新鲜剂的峰值低。
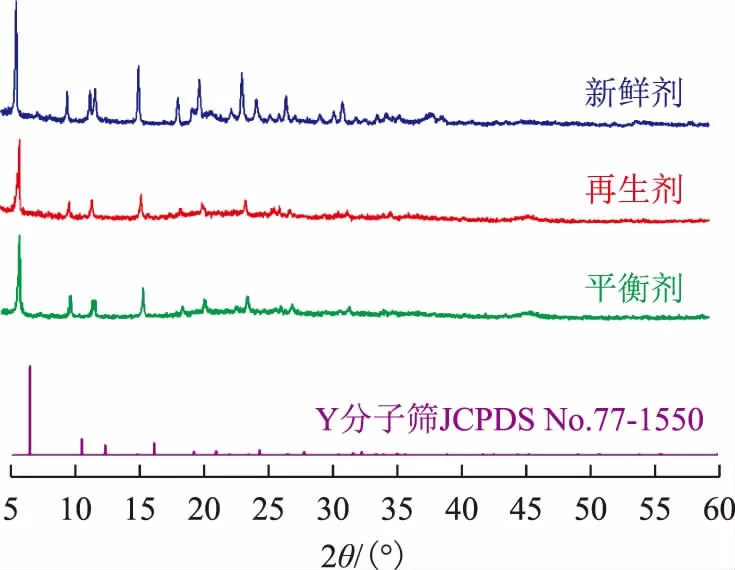
图6 FCC催化剂的XRD图谱
2.3.2 催化剂的比表面积和孔体积FCC催化剂的孔道是催化裂化反应发生的主要场所,FCC催化剂的活性不仅与催化剂的组成有关,而且与其自身的比表面积和孔体积大小密切相关。本研究所用平衡剂和再生剂的孔结构性质如表1所示。由表1可以看出,再生工艺处理过的催化剂比表面积和孔体积明显增加,这是因为在预处理和再生过程中去除了催化剂上沉积的金属钒及焦炭。

表1 催化剂的孔结构性质
2.3.3 SEM分析平衡剂和再生剂的表面形貌照片见图7。由图7(a)和图7(b)可以看出,两者拥有相似的形貌,颗粒几乎均为球形,外表较光滑,没有发生形变或结构的破损。由图7(c)和图7(d)可以看出,再生后的催化剂表面孔道更多、更明显,更有利于催化裂化反应在孔道中进行。

图7 催化剂的表面SEM照片
2.4 催化剂微反活性
经微反试验评价,平衡剂的微反活性为58%,再生剂的微反活性为63%,比平衡剂提高了5百分点。说明使用改性壳聚糖DTC-CTS可以有效地脱除平衡剂上沉积的金属钒,使平衡剂的比表面积和孔体积得以恢复,明显提高了平衡剂的微反活性。
3 结 论
基于壳聚糖和CS2在最适宜条件(50 ℃、10 h)下发生亲核加成反应制备了改性壳聚糖DTC-CTS,并将其用于FCC平衡剂脱钒。结果表明,在适宜条件下合成的改性壳聚糖DTC-CTS具有更多的活性位,更有利于络合脱除平衡剂上的钒金属。当脱金属反应温度达到125 ℃、反应时间为4.5 h时,脱钒率可达到54.8%。对脱钒后的再生剂进行表征,结果表明,再生后的催化剂分子筛结构保留度好,比表面积和孔体积明显增加,具有更多的孔道,有利于催化裂化反应的进行,微反活性从58%提高到63%,提高了5百分点。
