SB203580减轻高原低氧大鼠脑水肿的实验研究
2019-09-18施冰冯振龙赵永歧朱玲玲李俊峡
施冰,冯振龙,赵永歧,朱玲玲,李俊峡
(1.中国人民解放军总医院第七医学中心心内科,北京 100700;2.军事科学院军事认知与脑科学研究所)
在缺氧条件下,p38MAPK可被磷酸化活化,通过磷酸化活化转录因子调控特定基因表达,进而将信号从细胞外传导到细胞核,参与细胞生长、发育、分裂等细胞生物学过程。p38MAPK信号通路参与了脑水肿的信号传导。小分子化合物SB203580是p38 MAPK通路特异性抑制剂,具有抗缺氧、减轻炎性反应等作用。前期研究中,课题组通过全转录组测序和生物信息学分析,预测SB203580具有潜在的防治急性高原反应的功能。本研究运用综合实验舱模拟海拔7000 m高原低氧环境,探索SB203580防治急性高原低氧大鼠脑水肿的效果及其相关机制。
1 材料与方法
1.1 动物模型构建与实验分组 选用成年健康六周龄SPF级SD大鼠,体质量(200±20)g,雄性,购自北京维通利华实验动物技术有限公司。许可证号:SCXK(京)2016-0006。所有动物实验均通过中国人民解放军总医院第七医学中心伦理委员会审核。采用随机数字表法将SD大鼠分为高原低压低氧实验组(HH组)、SB203580干预组(SB组)和常压常氧对照组(con组)。每组18只动物。应用实验舱(贵州风雷航空军械有限责任公司)模拟高原低压低氧条件。实验舱参数设定:模拟海拔高度7000 m,升降速度10 m/s,舱内压力56 kPa,舱内氧气压力8.6 kPa,舱内温度22.8 ℃,舱内湿度24%RH。HH组和SB组的大鼠置于低氧实验舱内饲养,实验舱运行时间23 h/d。每日开仓1 h用于更换垫料、饲料和饮用水。昼夜比12 h∶12 h。Con组大鼠置于实验舱外饲养,处理等同于实验组大鼠。
1.2 实验药品及处置方法 SB203580和DMSO购自sigma公司。DMSO配置为20 mM储备液,SB203580溶于30%DMSO中配置成溶液。SB203580溶液于每天开仓时进行腹腔注射,根据大鼠体质量计算SB203580溶液注射量(10 mg/kg)。每日注射1次,每只大鼠连续注射7 d。
1.3 脑组织含水量检测 各组大鼠完成实验后,腹腔麻醉注射处死。剖开颅骨,无菌条件下取出全脑,滤纸吸干。用电子天平称量全脑湿质量后,置于120 ℃恒温干燥箱烘干24 h 至恒质量,称重脑组织干质量。计算脑组织含水量=(湿重-干重) /湿重×100%。
1.4 脑组织病理检测 各组大鼠完成实验后,腹腔麻醉注射处死。剖开颅骨,无菌条件下取出全脑,滤纸吸干。脑组织用40 mL/L多聚甲醛溶液固定24 h,常规脱水,石蜡包埋,连续切5片,片厚约4 μm,HE染色,中性树胶封片,光镜下观察病理变化。
1.5 脑组织AQP1 和AQP4 mRNA检测 应用real time PCR检测各组大鼠脑组织AQP1和AQP4mRNA表达。选取100mg脑组织标本,采用Trizol法提取组织总RNA。通过Reverse Transcription Kit将RNA逆转录为cDNA,使用荧光定量PCR试剂盒对AQP1和AQP4mRNA进行测定。检测总体系为25 μL(其中上下游引物各0.5 μL、Premix 12.5 μL,cDNA模板2 μL、ddH2O 9.5 μL)。PCR程序参照试剂盒中提供的两步法检测:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环。各组实验独立重复3次。实验数据使用AQP4和β-actin循环阈值(CT)之差(ΔCt)计算得到相关基因的表达情况,计算对比的样本间基因表达的差异(ΔΔCt)。以β-actin作为内参基因,采用2-ΔΔCt法计算mRNA相对表达量,以对照组的RQ值为1,各组是相对于1的变化倍数。引物由上海生工合成。各基因扩增的上下游引物序列见表1。

表1 各基因扩增的上下游引物序列

2 结果
2.1 大鼠脑组织含水量测定结果 与对照组[(70.15±3.32)%,n=6]比较,HH组大鼠脑组织含水量[(77.83±0.30)%,n=6]显著升高(P<0.05),而SB组大鼠脑组织含水量[(76.66±0.32)%,n=6]差异无统计学意义(P>0.05)。与HH组比较,SB组大鼠脑组织含水量显著降低(P<0.05)。提示SB203580可减轻高原低氧大鼠脑水肿。
2.2 脑组织AQP1和AQP4mRNA检测结果 与对照组比较,HH组大鼠脑组织AQP1mRNA表达量显著升高(P<0.01),SB203580组大鼠脑组织AQP1mRNA表达量未见显著变化(P>0.05)。与低氧组比较,SB203580组大鼠脑组织AQP1mRNA表达量显著降低(P<0.01)(表2)。提示SB203580可下调高原低氧大鼠脑组织AQP1mRNA表达。
与对照组比较,HH组大鼠脑组织AQP4mRNA表达量显著升高(P<0.01),SB203580组大鼠脑组织AQP4mRNA表达量未见显著变化(P>0.05)。与低氧组比较,SB203580组大鼠脑组织AQP4mRNA表达量显著降低(P<0.01)(表2)。提示SB203580可下调高原低氧大鼠脑组织AQP4mRNA表达。
2.3 大鼠脑组织病理变化 脑组织HE染色病理切片提示,对照组大鼠脑组织结构完整,神经元细胞排列整齐。低氧组大鼠脑组织神经元排列紊乱,细胞减少,血管扩张。血管、神经细胞周围间歇增大。与低氧组比较,SB203580组大鼠脑组织损伤程度较轻(图1)。
3 讨论
当机体暴露于高原低压低氧条件下时,脑和心脏作为需氧量较大的组织器官,对环境中氧分压的改变十分敏感,故而造成的损伤也较为明显[1-2]。脑损伤后炎性物质与氧化自由基等物质在脑组织的继发性损伤中起着重要的作用。脑水肿是脑缺氧后脑组织继发性损伤的主要表现之一。虽然许多学者对脑水肿的产生机制此作了大量实验和临床研究,但其具体的病理生物学机制尚未完全阐明。水通道蛋白(AQP) 是一类广泛分布于机体不同组织器官中的特异性跨膜转运水的膜蛋白,共有13个亚型。可以促进水分子的快速跨膜转运,维持细胞内外渗透压力的平衡。在神经系统表达的水通道蛋白有AQP1、3、4、5、8、9等6个亚型。其中AQP1、AQP4在脑组织表达较多,在脑外伤、脑出血、脑肿瘤等中枢神经系统病变时表达增加,参与脑水肿形成。
AQP1主要集中表达于侧脑室、第四脑室及第三脑室的脉络丛上,参与脑脊液的生成和调节,并参与水和离子的平衡[3]。AQP4 是中枢神经系统的主要水通道蛋白,在脑组织水平衡的调节中起着关键作用[4]。AQP4在正常脑组织中呈极性分布,主要位于血管周围的星形细胞足突处,靠近神经元侧足突表达较少。这种分布模式有助于调节细胞与血管间水的转运。AQP4的高表达与细胞毒性脑水肿程度呈正相关[5]。脑缺氧时,AQP4在血管侧分布减少,而在神经元侧分布增加,这种极性改变导致过多的水分子滞留在星形胶质细胞内造成细胞肿胀,导致脑水肿发生。因此,调节星形胶质细胞AQP4的表达可减轻脑水肿程度[6-7]。适时、正确地干预AQP4的表达变化可能为有效控制脑水肿的发生发展提供新思路。
SB203580是一种常用p38MAPK抑制剂,可以通透细胞,抑制p38MAPK激活,进而有效抑制一些炎性因子(如IL-1β、TNF-α)介导的部分信号传导。SB203580作为一种新型生物制剂,目前已被广泛应用于多种疾病治疗的研究领域。本研究发现,与常压常氧对照组相比,低压低氧组大鼠脑组织中AQP1及AQP4mRNA表达增高且伴脑组织含水量增加。提示在高原低氧环境下,大鼠脑组织缺氧后P38信号通路被激活,致使AQP1和AQP4高表达,进而增加脑含水量。以往研究发现,阻断p38的激活可以降低星形胶质细胞氧糖剥夺/复氧模型中AQP1及AQP4mRNA表达[8],减轻大鼠脑创伤后脑水肿程度。本研究发现,与低氧组相比,SB203580组大鼠脑组织AQP1和AQP4mRNA的表达显著降低伴脑含水量减少。提示SB203580可靶向抑制AQP1和AQP4的激活,导致AQP1和AQP4表达下调,进而减少脑含水量,具有抗高原低氧脑水肿的效果。本实验研究为急性高原病的预防和治疗提供了新的干预策略和干预靶点。
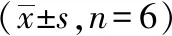
表2 SB203580对大鼠脑组织AQP1mRNA和AQP4mRNA表达的影响
注:与对照组比较,aP<0.01;与HH组比较,bP<0.01
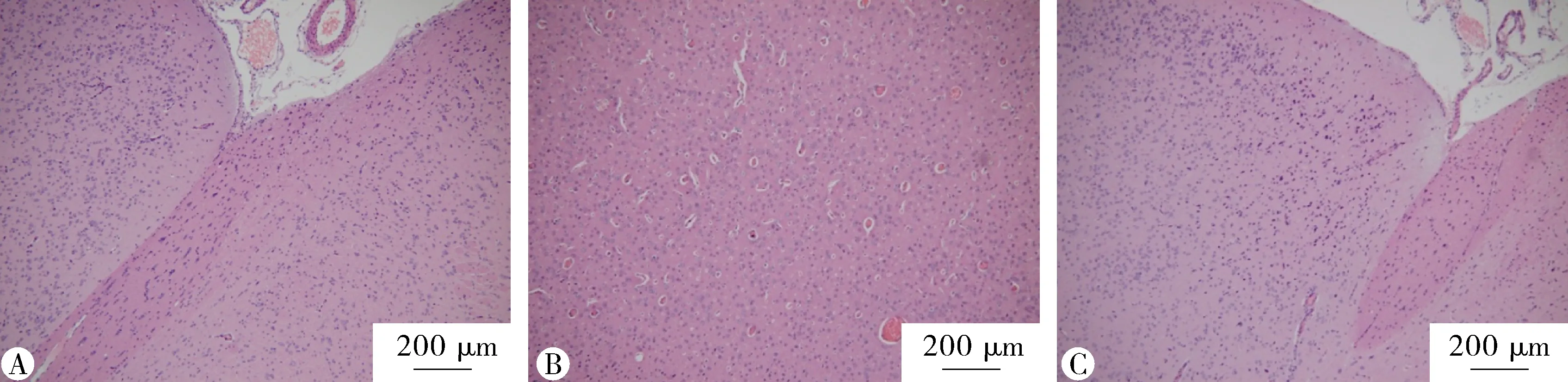
图1 SB203580对高原低氧脑组织病理学改变的影响 (HE染色) 。A:对照组,B:HH组,C:SB203580组
