高效液相色谱法测定动物性食品中头孢喹肟残留量
2019-09-18张玉洁黄耀凌王鹤佳
张玉洁,沈 昕,李 丹,黄耀凌,李 倩,王鹤佳
(中国兽医药品监察所,北京 海淀100081)
头孢喹肟(Cefquinome,CEF)是动物专用第4代头孢菌素类抗生素。其抗菌谱广、抗菌活性强,对革兰阳性菌和革兰阴性菌均显示良好的抗菌活性,对金黄色葡萄球菌、链球菌、绿脓杆菌和大肠杆菌属的成员都有较低的抑菌浓度,尤其对β-内酰胺酶高度稳定。在我国,头孢喹肟已被批准应用于敏感菌引起的猪、牛呼吸道细菌感染、急性乳房炎等疾病的治疗。目前未见有关头孢喹肟致畸性、致癌性及遗传毒性试验数据报道。但长期食用含有头孢喹肟残留的食品会对人类健康产生潜在威胁,也易导致耐药性的产生[1]。
国内外有关头孢喹肟残留检测方法的报道较少,主要集中在动物组织[2~6]及奶[1,7]中头孢喹肟的检测,多采用高效液相色谱法和液相色谱-质谱法。但目前的文献报道及已发布的国家标准中尚没有一种方法能同时检测猪、牛的肌肉、脂肪、肝脏、肾脏及牛奶等9 种组织中该药物的残留。因此本研究建立了一种适用于上述9 种动物组织样品中头孢喹肟残留检测的高效液相色谱法,该方法灵敏度高,适用范围广,可以满足我国农业部235 号公告[8]最高残留限量的要求。
1 材料与方法
1.1 仪器设备、试剂与对照品 Agilent1100 高效液相色谱仪(配紫外检测器);SPE 柱:HLB,60 mg/3 mL;氮吹仪;固相萃取装置;pH 计;冷冻离心机。
头孢喹肟标准品(中国兽医药品监察所,含量82.6%)、甲酸、磷酸、乙腈(色谱纯)、正己烷、正丙醇、高氯酸钠、超纯水。
1.2 溶液配制 头孢喹肟标准储备液(1 mg/mL):称取头孢喹肟标准品约10 mg,精密称定于10 mL量瓶中,用50%乙腈水溶液溶解并稀释至刻度。配制成浓度为1 mg/mL 标准储备液,4 ℃保存,有效期1 个月。
头孢喹肟标准工作液(2 μg/mL):准确量取标准储备液0.1 mL 于50 mL 量瓶中,用50%乙腈水溶液溶解并稀释至刻度,配制成浓度为2 μg/mL 的标准工作液。4 ℃保存,有效期1 个月。
高氯酸钠-磷酸缓冲液:取浓磷酸3.4 mL,缓慢加适量水稀释,再加入水合高氯酸钠3.45 g,用三乙胺调至pH 值3.6,最后用水定容至1 000 mL。
1.3 液相色谱条件 色谱柱:Phenomenex Luna C18 250 mm×4.6 mm(i.d),粒径5 μm;流动相:0.1%甲酸+乙腈(88+12,V/V)(牛奶样品甲酸浓度为0.2%),使用前经微孔滤膜过滤;流速:1.0 mL/min;检测波长:270 nm;柱温:35 ℃;进样量:50 μL。
1.4 标准曲线及线性范围的测定 准确量取2 μg/mL 头孢喹肟标准工作液适量于容量瓶中,用流动相稀释并定容,制成浓度为10、25、50、100、200、500 ng/mL 系列标准工作液。供高效液相色谱测定。从低浓度到高浓度依次测定,每一浓度进样3 针。以测得峰面积平均值为纵坐标,对应的标准溶液浓度为横坐标,绘制标准曲线。求回归方程和相关系数。
1.5 样品前处理 称取试料2±0.02 g(肝脏、肾脏),4±0.05 g(肌肉、脂肪)或5±0.05 g(牛奶),置于50 mL 离心管中,加入高氯酸钠-磷酸缓冲液2 mL,乙腈10 mL,涡旋混匀,振荡5 min,5 000 r/min离心5 min,取上清液于茄形瓶中,再按上述步骤重复提取1 次,合并两次上清液,加正丙醇5 mL,在40 ℃下旋转蒸发至近干。残渣中加入水10 mL 溶解至50 mL 离心管中,再加正己烷5 mL,涡旋混匀,5 ℃下10 000 r/min 离心8 min,取下层清液备用。
HLB 小柱依次用甲醇2 mL 和水2 mL 活化,备用液全部过柱,再依次用水3 mL 和5%乙腈水溶液3 mL 洗涤,抽干。肌肉、脂肪、肝脏、肾脏用流动相2.0 mL 洗脱,牛奶用12%乙腈溶液洗脱。洗脱液收集于10 mL 玻璃试管中,混匀后过0.45 μm 微孔滤膜,供高效液相色谱仪测定。
1.6 检测限及定量限 分别取猪、牛的肌肉、脂肪、肝脏、肾脏4 种组织及牛奶的空白样品进行添加回收试验,按照上述样品前处理方法处理,进HPLC 分析,测得各药物色谱保留处的基线噪音值,求其平均值。以S/N≥10,且在该添加水平的回收率和变异系数均满足残留分析要求的最小浓度作为定量限(LOQ),以S/N≥3 作为药物的检测限(LOD)。
1.7 准确度和精密度 采用标准添加法,在猪、牛的肌肉、脂肪空白组织中添加3 个不同浓度(25 μg/kg、50 μg/kg 和100 μg/kg)的头孢喹肟标准溶液进行回收率测定,每个浓度设定5 个平行样品,同时进行空白试验,重复3 次,求每个样品的回收率和批内、批间相对标准偏差(RSD)。按照相同方法,在肝脏、肾脏空白组织中添加3 个不同浓度(50 μg/kg、100 μg/kg和200 μg/kg),在牛奶中添加3 个不同浓度(10 μg/kg、20 μg/kg 和40 μg/kg)的头孢喹肟标准溶液,求每个样品的回收率和批内、批间RSD。
1.8 样品稳定性考察 本实验室目前运行ISO/IEC 17025 实验室质量管理体系并已获得中国合格评定委员会(CNAS)认可。依据CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》,采用平均值一致性检验法评价样品的稳定性,利用t 检验法计算稳定性结果。
从北京某超市购买猪肉样品,在本实验室经匀质后按照此方法检测,未检出头孢喹肟残留。将猪肉充分绞碎搅匀,制成匀质猪肉,称取样品20 份,每份(4.00±0.05)g,添加2.0 μg/mL 头孢喹肟标准工作液100 μL,制成添加浓度为50 μg/kg 阳性添加样品。制备当天,对其中10 份样品按照上述方法进行检测,另外10 份保存于-20 ℃冰箱中,7 d 后取出,按照同样方法测定头孢喹肟残留量。计算回收率,并按照下式计算t 值:
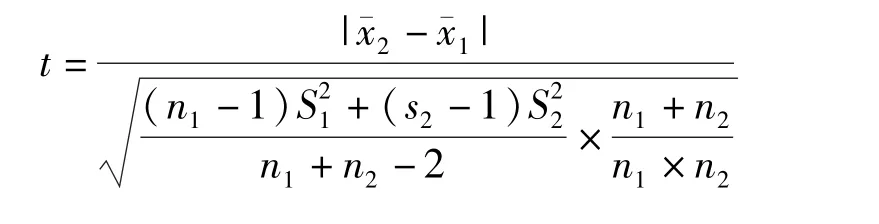
注:为了保证平均值和标准偏差的准确度,n1和n2均≥6。
若t<显著性水平α(α=0.05)自由度为n1+n2-2 的临界值(n1+n2-2)tα,则两个平均值之间无显著性差异。
2 结果
2.1 标准曲线及线性范围 取10、25、50、100、200、500 ng/mL 六个浓度点进行检测。其浓度范围包含了头孢喹肟在所有组织的最高残留限量及该方法的检测限和定量限。经测定,其线性方程为y=0.108 6x-0.665 5,R2=0.999 9。
2.2 检测限及定量限 空白试料按相同的步骤处理后,测定结果表明,大部分空白试料对所测分析物无干扰;少部分空白组织在药物色谱峰保留时间处有较小干扰,通过调整流动相比例可避开干扰物质。图1 A~C 例举了标准对照液、牛肝脏空白样品及添加样品的色谱图。
添加适量的标准工作液于2.00 g 空白肝脏、肾脏以及4.00 g 空白肌肉和空白脂肪中,分别制得浓度为25 μg/kg、50 μg/kg 的肝脏、肾脏空白添加试料及浓度为15 μg/kg、25 μg/kg 的肌肉、脂肪空白添加试料。添加适量的标准工作液于5.00 g 空白牛奶中,分别制得浓度为5 μg/kg、10 μg/kg 的牛奶空白添加试料。以上试料经前处理后上机测定,当肝脏、肾脏的添加浓度为25 μg/kg,肌肉、脂肪的添加浓度为15 μg/kg,牛奶的添加浓度为5 μg/kg 时,头孢喹肟色谱峰信噪比S/N 约等于3(按PtP 算)。当肝脏、肾脏的添加浓度为50 μg/kg,肌肉、脂肪的添加浓度为25 μg/kg,牛奶的添加浓度为10 μg/kg 时,头孢喹肟色谱峰信噪比S/N 大于或等于10。为此,确定头孢喹肟在猪、牛的肌肉、脂肪组织中的检测限为15 μg/kg,定量限为25 μg/kg;在猪、牛的肝脏、肾脏组织中的检测限为25 μg/kg,定量限为50 μg/kg;在牛奶中的检测限为5 μg/kg,定量限为10 μg/kg。
2.3 准确度和精密度 根据头孢喹肟在不同组织中的MRL 规定,在空白试料中添加3 个不同浓度(定量限、MRL 和2MRL)的头孢喹肟进行回收率试验,各浓度设置5 个平行样品,重复3 次,计算回收率及批内、批间相对标准偏差。
试验结果表明:本方法在25 μg/kg~100 μg/kg添加浓度范围内,猪肌肉、牛肌肉中头孢喹肟的回收率范围分别为60.2%~78.3%、65.4%~100%,猪脂肪、牛脂肪中头孢喹肟的回收率范围分别为60.4%~79.7%、71.0%~98.5%,在50 μg/kg~200 μg/kg 添加浓度范围内,猪肝脏、牛肝脏中头孢喹肟的回收率范围分别为61.4% ~94.3%、61.8%~98.6%,在50 μg/kg~400 μg/kg 添加浓度范围内,猪肾脏、牛肾脏中头孢喹肟的回收率范围分别为60.6% ~93.0%、61.3% ~97.2%。在10 μg/kg~40 μg/kg 添加浓度范围内,牛奶中头孢喹肟的回收率范围为60.3%~100%。批内与批间相对标准偏差均小于20%。

图1 标准对照液、牛肝脏空白样品及添加样品色谱图
2.4 稳定性 根据样品稳定性考察方法,制备样品当天及7 d 后,对样品进行了稳定性检验,两次检测结果进行比较,得到的t 值 3.1 提取条件的优化 现有的文献及标准中大多采用缓冲溶液[2-3]、乙腈[1,4]及乙腈水溶液[5,7]提取动物组织中的头孢喹肟。试验摸索发现,用缓冲溶液提取组织样品中的头孢喹肟杂质干扰明显。尝试用乙腈浓度为67%至83%乙腈水溶液以及纯乙腈对药物进行提取,组织及牛奶中的提取回收率仅在30%~60%范围内,不能满足残留检测的要求。其中83%乙腈水溶液提取回收率较高,约为40%~60%,其他浓度以及纯乙腈的提取回收率更低。因此本试验对提取液的极性及pH 值进行了摸索,结合头孢喹肟的药物结构性质,在83%乙腈溶液的基础上用不同pH 值的酸性缓冲液代替水,与乙腈按照1∶5比例混合进行提取。在同样操作条件下比较测试,发现用0.05 mol/L 磷酸缓冲液(三乙胺调节至pH 值3)2 mL 与乙腈10 mL 混合共同提取组织中的头孢喹肟,既能沉淀蛋白去除杂质,又能保证回收率达到60%以上。进一步参考刘利锋等人[6]的液相色谱流动相条件,发现缓冲液中加入高氯酸钠后提取效率有了进一步提高,因此确定了用高氯酸钠-磷酸缓冲液(pH 值3.6)2 mL 加乙腈10 mL 共同提取各组织中的药物。又对20 mL 提取液一次提取和12 mL 提取液分两次提取的提取效率进行了比较,显然后者的提取效率更高,所以最终确定了12 mL 提取液分两次提取的方案。 表1 样品稳定性检验结果 3.2 净化条件的优化 HLB 小柱对头孢喹肟保留能力较好,又容易洗脱,因此很适合用于动物组织中头孢喹肟的净化。在摸索HLB 小柱洗脱条件时发现,对于猪、牛的肌肉、脂肪、肝脏、肾脏,直接用流动相2 mL 就可以充分洗脱,而对于牛奶样品,用流动相洗脱,药物回收率几乎为零。配制不同浓度的乙腈水溶液,对牛奶样品的洗脱液比例进行重新摸索,试验结果显示,用12%乙腈溶液2 mL 进行洗脱,柱回收率可达85%以上,乙腈浓度降低会造成洗脱不完全,乙腈浓度升高会则同时洗脱出更多杂质。 3.3 色谱条件的优化 C18 色谱柱的硅胶基键合固定相表面存在一定量的游离硅醇基,由于头孢喹肟结构中的胺基和羧基能在水中发生解离,固定相表面的这些游离硅醇基可通过氢键或离子交换作用强烈吸附头孢喹肟,出现色谱峰拖尾,保留值不稳定等现象,导致峰形异常和分离度下降[6]。流动相中加入甲酸,改变系统pH 值,有助于改善头孢喹肟色谱峰峰形,提高分离度,稳定保留时间。0.1%甲酸含量对于改善猪、牛各种组织中头孢喹肟的分离恰到好处,但对于牛奶样品来说效果不甚理想。浓度增加至0.2%则可有效改善头孢喹肟色谱峰峰形,将其与杂质分开。浓度继续增加,不再有明显效果。对于不同来源的牛奶样品,在0.2%甲酸+乙腈(88+12,V/V)的基础上细微调整两项比例即可使药物与杂质有更好的分离。 3.4 适用组织的优化 头孢喹肟是动物专用的第1 个第4 代头孢菌素,我国农业部235 号公告[8]明确规定了该药物在猪、牛的肌肉、脂肪、肝脏、肾脏及牛奶中的残留限量,但目前的文献报道[1~7]中尚没有一种方法能同时应用于上述各组织中该药物的残留检测。国家标准[9]及行业标准中也尚未有同时涵盖猪、牛动物组织及牛奶的检测方法。因此,为了给我国最高残留限量规定提供技术支持,为适应我国现阶段食品安全检测工作的需要,本方法通过对提取、净化及色谱分离等分析环节的逐一优化,建立了适用于猪、牛的肌肉、脂肪、肝脏、肾脏及牛奶样品中头孢喹肟残留的检测方法。同时,对于头孢喹肟这类检测限量较高的药物而言,高效液相色谱检测法具有成本低、普及率高、操作简单等优点,更适合基层检测工作的需要。3 讨论

