京津潮白河多环芳烃及其衍生物分布
2019-09-17付璐婧乔梦赵旭李一兵李卓蓉刘冬晴
付璐婧,乔梦,赵旭,李一兵,李卓蓉,刘冬晴
1. 河北工业大学土木与交通学院,天津 300401 2. 中国科学院生态环境研究中心,环境水质学国家重点实验室,北京 100085 3. 北京市可持续城市排水系统构建与风险控制工程技术研究中心,水环境国家级实验教学示范中心,北京 100044
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是河流中普遍存在的一类持久性有机物,具有致畸、致癌和致突变的作用,会对人体健康产生潜在危害[1-2]。近年来河流中也检测到PAHs通过化学或微生物作用转化成的衍生物(substituted polycyclic aromatic hydrocarbons, SPAHs),如甲基、氧化、氯代等多环芳烃衍生物(MPAHs、OPAHs、ClPAHs)[3-5],可能具有更强的毒性和“三致效应”[6]。PAHs具有高亲脂性和疏水性,导致PAHs对有机物具有高亲和性[7]。Rhind等[8]研究发现PAHs和有机碳含量有关,且PAHs会与有机碳结合。Moeckel等[9]研究发现5环以上的PAHs浓度与有机碳浓度显著相关(P<0.0001),而4环以下PAHs浓度与有机碳之间没有明显的关系。自由态溶解度浓度是指自由溶解在水相,而不与任何介质或系统组分结合的化合物的浓度;结合态浓度是指存在于土壤、植物和动物体内的,用不能根本改变化合物本身和基质结构的提取方法提取以后,仍以母体化合物或它们代谢物持久存留在基质中的物质浓度[10-11]。污染物的自由态浓度比总浓度更好地反映污染物的生物有效性[12]。
潮白河为流经北京市北部、东部的重要河流,属海河水系。其上源有两支,东支为潮河,西支为白河。为了对潮白河水环境中PAHs及SPAHs的污染状况进行深入的研究,于2018年1月,在潮河及潮白河等20个主要监测断面进行了水样的采集,并对PAHs及SPAHs的污染特征进行了探讨,同时分析水样中自由态PAHs/SPAHs和结合态PAHs/SPAHs的分布。
1 材料与方法(Materials and methods)
1.1 水样的采集
2018年1月在京津潮白河用不锈钢采样器采集河流表层0~0.5 m的水样,其中潮河(A)采3点,潮白河北京地区(B)采8点,潮白河河北地区(C)采3点,潮白河天津地区(D)采6点共20点。其中第2、5、9、13、16和19点采样2瓶,具体位置见图1。
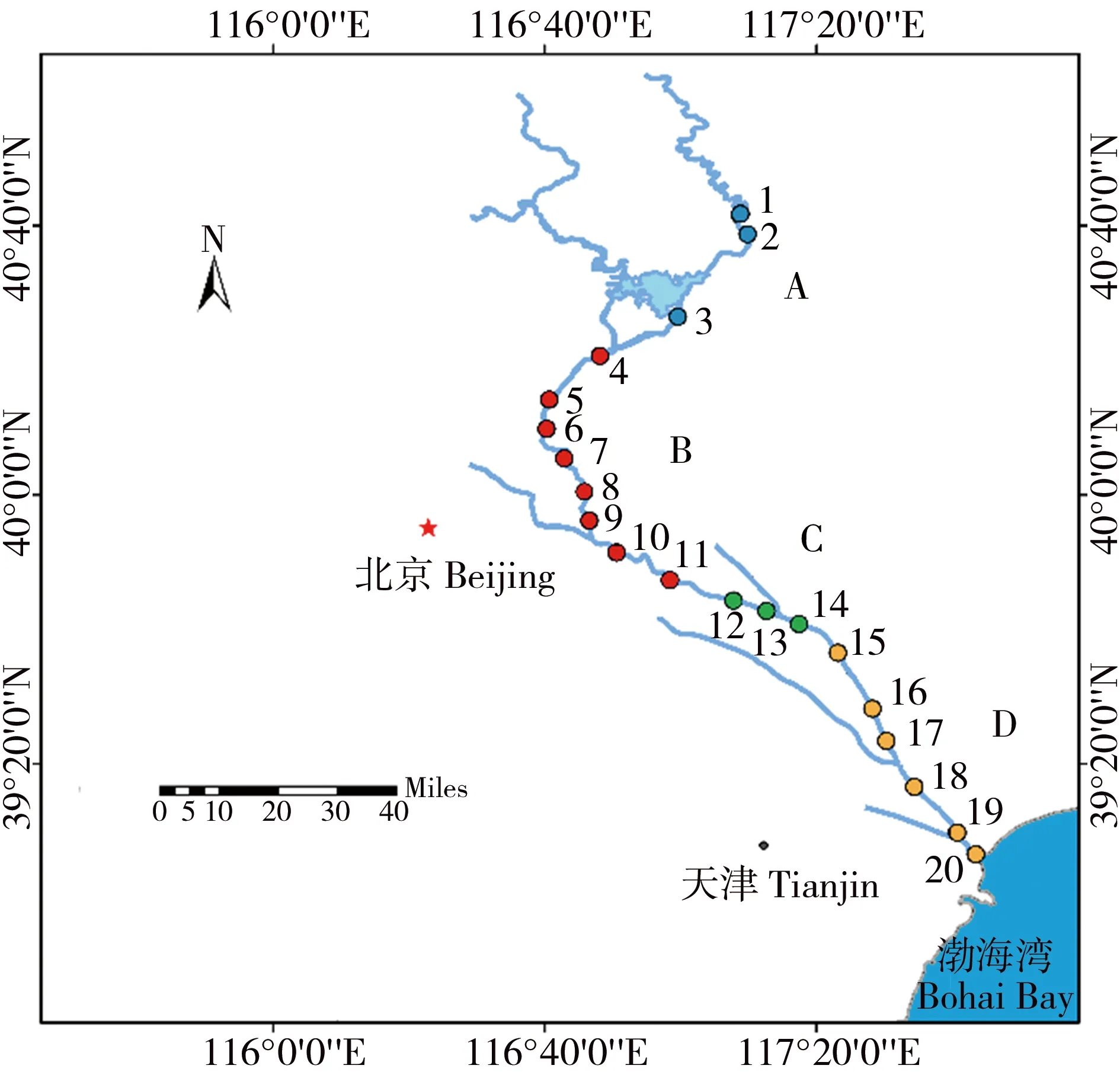
图1 京津潮白河采样图Fig. 1 Sampling map of Chaobai River of Beijing-Tianjin area
1.2 化学试剂
16种PAHs包括萘(Nap)、苊烯(Acy)、苊(Ace)、芴(Fluo)、菲(Phe)、蒽(Ant)、荧蒽(Flua)、芘(Pyr)、苯并[a]蒽(BaA)、屈(Chry)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、茚并[1,2,3-cd]芘(IcdP)、二苯并[a,h]蒽(DBA)和苯并[g,h,i]苝(BghiP)。4种MPAHs包括2-甲基萘(2-MN)、1-甲基荧蒽(1-MF)、2,6-二甲基萘(2,6-DMN)和3,6-二甲基菲(3,6-DMP)。6种OPAHs包括9-芴酮(9-FL)、蒽酮(AT)、蒽醌(AQ)、2-甲基蒽醌(2-MAQ)、苯并蒽酮(BAT)和苯并蒽-7,12-二酮(BA-7,12-D)。9种ClPAHs分别为1-氯萘(1-CN)、2-氯萘(2-CN)、1,4-二氯萘(DCN)、9-氯菲(9-ClPhe)、2-氯蒽(2-ClAnt)、1-氯蒽醌(1-ClAQ)、3-荧蒽(3-ClFlua)、1-氯芘(1-ClPyr)、6-氯苯芘(6-ClBap)。回收率指示物为4种氘代多环芳烃:氘代苊(d-Ace)、氘代菲(d-Phe)、氘代屈(d-Chry)、氘代苝(d-Pery),均购自AccuStandard (New Haven, USA)。
采用的内标物质二氟联苯(2-FB)购于Aldrich Chemical Co. (Gillingham, Dorset, USA)。HPLC级正己烷、甲醇购于美国Fisher Scientific公司,二氯甲烷购于美国J.T. Baker公司,丙酮购于美国Dikma Technologies公司。无水硫酸钠(分析纯,国药集团化学试剂有限公司),使用前经马弗炉在450 ℃下煅烧,以去除有机物。硫酸铝(分析纯)购于国药集团化学试剂有限公司。
1.3 PAHs及SPAHs的前处理
水样采集后,储存于4 L棕色玻璃瓶中,样品运回实验室后,4 ℃保存,水样用玻璃纤维滤膜(直径142 mm,孔径0.7 μm,Millipore)过滤,用量筒称量体积并记录,3 d内完成富集。过滤后的水样用活化好的C18固相小柱(500 mg, 6 mL购于Supelco)在固相萃取装置上富集,之后用10 mL DCM和5 mL HEX分4次洗脱萃取柱,洗脱液用旋转蒸发仪旋转蒸发至1 mL左右,转移到K-D浓缩瓶中,用氮吹仪浓缩,定容至0.5 mL。加入内标2-FB(100 ng),以待进行仪器分析,所测浓度为总PAHs/SPAHs质量浓度;为测定自由态PAHs/SPAHs浓度,需首先将与腐殖酸结合的PAHs/SPAHs絮凝沉淀[9],在重复的6瓶水样中加入160 mg硫酸铝(溶于5 mL的超纯水),调节pH为6.0,磁力搅拌器快速搅拌3 min (300 r·min-1),慢速搅拌25 min (100 r·min-1),以保证絮凝完全,絮凝沉淀后再进行过滤、富集、洗脱、氮吹和加标定容,所得浓度为自由态PAHs/SPAHs质量浓度。由于颗粒相样品含量较低,因此未做分析。
1.4 样品的测定
样品采用气相色谱-质谱仪进行测定(Agilent 5977B GC/MSD,美国),以无分流模式注入,载气为氦气,速度为1 mL·min-1。色谱条件:采用色谱柱为DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm,J&W Co. USA);离子源为电子轰击源(EI)[5]。进样口温度280 ℃、检测器温度为290 ℃;升温程序:初始温度为60 ℃,保留1 min,以20 ℃·min-1升到110 ℃,再以3 ℃升到290 ℃保留20 min。目标物首先以全扫描模式进行定性分析,然后以选择离子扫描进行定量分析。35种目标物的检出限为0.02~27.6 ng·L-1,定量限为0.04~91.9 ng·L-1。样品中指示物回收率分别为:d-Ace,(88%±18%);d-Phe,(98%±18%);d-Chry,(99%±18%);d-Pery,(96%±19%)。
2 结果与讨论(Results and discussion)
2.1 京津潮白河中PAHs分析
A、B、C和D河段中总PAHs(∑PAHs)质量浓度范围为55.06~96.43、99.99~215.02、141.41~179.88和106.33~209.41 ng·L-1,平均值为75.52、152.66、158.71和157.87 ng·L-1。A河段∑PAHs与B、C和D河段相比总质量浓度较低(图2),主要是A河段位于密云水库上游,为水源保护区,而下游(B、C和D段)受人类活动影响严重。A河段与广东西江(21.7~138 ng·L-1,平均值59 ng·L-1)、于桥水库上游(13.7~104.1 ng·L-1,平均值55.2 ng·L-1)相差不大[13-14]。下游河段与国内外其他河流相比,低于深圳茅洲河(13~1 212 ng·L-1,平均值292 ng·L-1)、黑龙江松花江(164.54~2 746.25 ng·L-1,平均值934.62 ng·L-1)和意大利亚诺河(12.4~2 321.1 ng·L-1,平均值739 ng·L-1);与天津海河(45.81~1 272 ng·L-1,平均值174 ng·L-1)、河北滦河(37.3~234 ng·L-1,平均值99.4 ng·L-1)相差不大[15-19]。
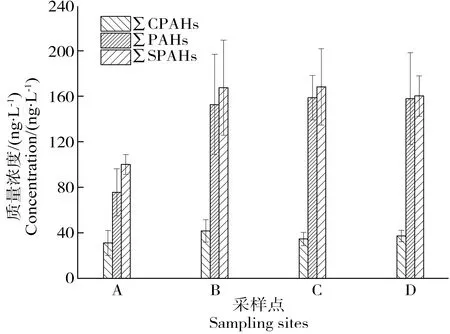
图2 京津潮白河各河流段∑CPAHs、 ∑PAHs和∑SPAHs质量浓度注:∑CPAHs、∑PAHs和∑SPAHs分别表示7种致癌PAHs、 16种PAHs和19种PAHs衍生物的质量浓度总和。Fig. 2 The mass concentrations of ∑CPAHs, ∑PAHs and ∑SPAHs in different river segments of Chaobai River of Beijing-Tianjin Area Note:∑CPAHs, ∑PAHs and ∑SPAHs stand for the total mass concentrations of 7 kinds of carcinogenic PAHs, 16 kinds of PAHs and 19 kinds of substituted polycyclic aromatic hydrocarbon.
7种致癌PAHs(CPAHs)包括BaA、Chr、BbF、BkF、BaP、InP和DBA,其中A河段∑CPAHs占∑PAHs的比例为41%,B、C和D河段依次为27%、22%和24%。虽然A河段∑PAHs质量浓度整体较低,但∑CPAHs所占比例较高仍需引起重视。
2.2 京津潮白河中SPAHs分析
A、B、C和D河段中总SPAHs(∑SPAHs)质量浓度范围为92.37~109.53、88.51~227.33、145.20~179.75和132.72~226.26 ng·L-1,平均值为100.10、167.48、160.20和168.24 ng·L-1。所有河段中∑SPAHs浓度均高于∑PAHs,A河段∑SPAHs与B、C和D河段相比总质量浓度较低(图2)。潮白河SPAHs与北京5条典型纳污河流(154~326、91~243、145~1 822、151~316和229~528 ng·L-1,平均值分别为213、163、383、213和310 ng·L-1)相比,质量浓度较低[20]。
根据目标物的不同取代基,将SPAHs分为MPAHs、OPAHs和ClPAHs。由图3(a)可知,OPAHs对SPAHs贡献率最大,尤其是B河段(71%),可能由于OPAH极性较强,在水中的溶解度较大,另外,也可能由于PAHs更易转化为OPAH[5,21]。其次是ClPAHs和MPAHs。如图3(b)所示,其中,OPAHs中,AQ和9-FL贡献较大,分别为28%~44%和24%~29%,其次为AT(8%~16%)、BAT(10%~15%)、2-MAQ(6%~13%)和BA-7,12-D(4%~7%)。9-FL、AT、2-MAQ、BAT和BA-7,12-D质量浓度与其母体Fluo、Ant和BaA相差不大,而AQ的质量浓度远远高于其母体Ant,原因可能是潮白河中氮污染严重,某些硝基PAHs在氮存在的条件下,通过光照可生成AQ[22]。如图3(c)所示,ClPAHs中,1-ClAQ和2-ClAnt贡献较大,分别为32%~39%和28%~34%,其次为3-ClFlua(15%~19%)、DCN(6%~13%)、2-CN(2%~3%)、1-ClPyr(1%~3%)和9-ClPhe(0~2%),1-CN和6-ClBap低于检出限,未检出。1-ClAQ和2-ClAnt的质量浓度均高于母体Ant的浓度,而其他ClPAHs均低于其母体PAHs,可能是AQ和Ant更容易转化为ClPAHs,据文献报道,ClPAHs的来源主要是汽车的尾气排放、含氯化学工业过程、聚氯乙烯燃烧、自来水氯化消毒以及光化学反应等[23-27]。如图3(d)所示,MPAH中,2-MN所占比例最高,为51%~73%,其次为2,6-DMN(14%~24%)、3,6-DMP(5%~13%)和1-MF(6%~12%),由此可见,MPAHs的质量浓度随芳环数增加而减小,随甲基取代个数的增加而减小[28]。
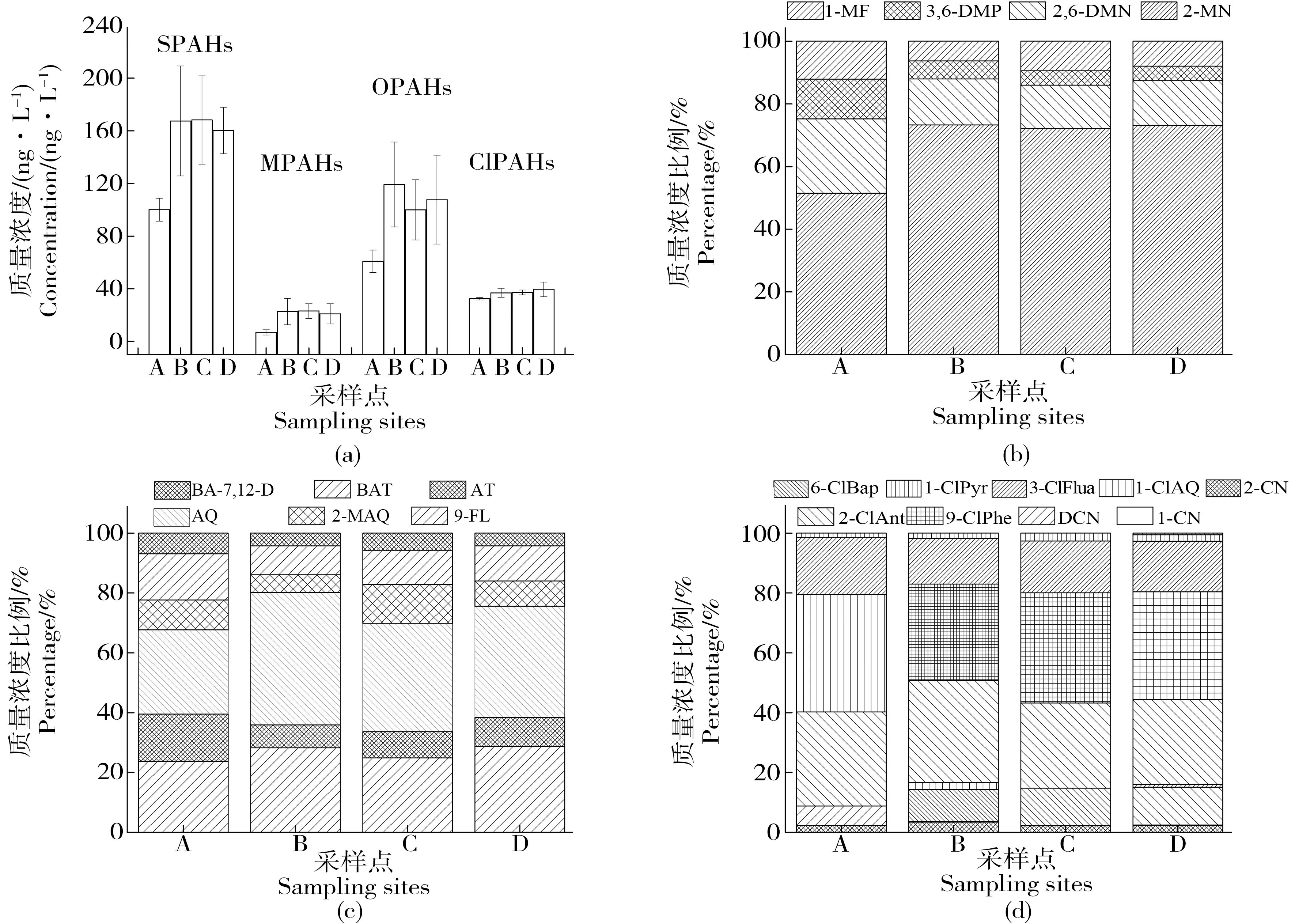
图3 京津潮白河各河流段中不同种类SPAHs质量浓度及所占比例注:图例的简称中,SPAHs为3种多环芳烃衍生物总称,MPAHs为甲基多环芳烃,OPAHs为氧化多环芳烃,ClPAHs为氯代多环芳烃; 2-MN为2-甲基萘,1-MF为1-甲基荧蒽,2,6-DMN为2,6-二甲基萘,3,6-DMP为3,6-二甲基菲,9-FL为9-芴酮,AT为蒽酮,AQ为蒽醌, 2-MAQ为2-甲基蒽醌,BAT为苯并蒽酮,BA-7,12-D为苯并蒽-7,12-二酮,1-CN为1-氯萘,2-CN为2-氯萘,DCN为1,4-二氯萘, 9-ClPhe为9-氯菲,2-ClAnt为2-氯蒽,1-ClAQ为1-氯蒽醌,3-ClFlua为3-荧蒽,1-ClPyr为1-氯芘和6-ClBap为6-氯苯芘。Fig. 3 The mass concentration and proportion of different SPAHs in different river segments of Chaobai River of Beijing-Tianjin Area Note: The abbreviations in the legend are respectively: SPAHs, three types of substituted polycyclic aromatic hydrocarbons in this study; MPAHs, methyl polycyclic aromatic hydrocarbons; OPAHs, oxygenated polycyclic aromatic hydrocarbons; ClPAHs, chlorinated polycyclic aromatic hydrocarbons; 2-MN, 2-Methylnaphthalene; 1-MF, 1-Methylfluoranthene; 2,6-DMN, 2,6-Dimethylnaphthalene; 3,6-DMP, 3,6-Dimethylphenanthrene; 9-FL, 9-Fluorenone; AT, Anthrone; AQ, Anthraquinone; 2-MAQ, 2-Methylanthraquinone; BAT, Benzanthron; BA-7,12-D, Benz(a)anthracene-7,12-dione; 1-CN, 1-Chloronaphthelene; 2-CN, 2-Chloronaphthelene; DCN, 1,4-Dichloronaphthelene; 9-ClPhe, 9-Chlorophenanthrene; 2-ClAnt, 2-Chloroanthracene; 1-ClAQ, 1-Chloroanthraquinone; 3-ClFlua, 3-ChloroFluoranthene; 1-ClPyr, 1-Chloropyrene; 6-ClBap, 6-Chlorobenzo[a]pyrene.
2.3 京津潮白河中自由态PAHs/SPAHs和结合态PAHs/SPAHs的分布
京津潮白河中6个采样点(2、5、9、13、16和19)TOC浓度分别为1.33、3.64、5.97、5.14、5.02和5.97 mg·L-1,结合态PAHs/SPAHs质量浓度为总PAHs/SPAHs与自由态PAHs/SPAHs质量浓度的差值,由图4可知,总PAHs/SPAHs与自由态PAHs/SPAHs质量浓度相差不大,其中自由态PAHs占总PAHs的比例为93%~100%,自由态SPAHs占总SPAHs的比例为78%~100%,表明京津潮白河中PAHs和SPAHs的存在形式主要为自由态。结合态物质不易被生物富集,可以降低污染物的生物有效性、毒性、降解程度和迁移能力,只有真正自由溶解态的物质会更好地被生物富集,所以自由态物质更容易被生物利用,生态风险可能更大[29-30]。潮白河中PAHs和SPAHs主要为自由态,表明可用总浓度估计污染物的风险,而不会高估其环境风险。

图4 京津潮白河6个采样点总PAHs/SPAHs和游离态PAHs/SPAHs的质量浓度Fig. 4 The mass concentrations of total PAHs/SPAHs and freely dissolved PAHs/SPAHs in 6 points of Chaobai River of Beijing-Tianjin Area
综上表明:京津潮白河A、B、C和D河段中∑PAHs和∑SPAHs质量浓度范围为55.06~215.02 ng·L-1和92.37~227.33 ng·L-1,上游(A河段)中∑PAHs和∑SPAHs平均值仅为75.52和110.10 ng·L-1,表明上游河段水质较好,受人类活动影响程度较低,但是∑CPAHs占∑PAHs的比例为41%,远高于下游河段,所以也应当在日常的城市水环境管理中给予重视。SPAHs主要以OPAHs为主,OPAHs极性较强,故在水中的溶解度较大。AQ、1-ClAQ和2-ClAnt的质量浓度远高于其母体Ant,可能是因为潮白河中氮污染严重,某些硝基PAHs在氮存在的条件下,通过光照可生成AQ,而AQ和Ant更容易转化成ClPAHs。京津潮白河中PAHs/SPAHs的存在形式主要为自由态,结合态较少,说明可用总浓度替代自由态浓度估计污染物的环境风险。
