MicroRNA在非酒精性脂肪性肝病发病过程中作用的研究进展
2019-09-17何占娣刘迎娣
何占娣,刘迎娣
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)包括单纯性脂肪肝(simple fatty liver, SFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)、脂肪性肝纤维化和脂肪性肝硬化[1-2]。NAFLD的患病率呈逐年上升趋势,NAFLD患者占全球总人口的25%~45%[1-2],在肥胖症、糖尿病或代谢综合征人群中,NAFLD的患病率高达70%~90%[1-2]。目前,该病已成为严重威胁人类健康的常见疾病之一。有报道称 NAFLD相关的肝硬化仍无有效的治疗措施,肝移植是其最终选择[1]。故探究NAFLD的发病机制并寻找有效的治疗潜在靶点成为研究者们关注的焦点。
微小RNA(microRNA, miRNA)是一种小的非编码RNA,大小约为20~25个核苷酸,与信使RNA(messenger RNA, mRNA)靶向结合后形成RNA诱导的沉默复合体,进而抑制mRNA翻译或促进其降解,在转录后水平调控基因表达[3]。miRNA参与了人体内几乎所有的生理和病理过程,包括细胞的分化和增殖、信号转导、炎症和免疫反应、物质代谢、病毒宿主相互作用以及肿瘤的发生[3]。miRNA可能是某些疾病发生、发展过程中的重要节点,也可能是诊断这些疾病的潜在标志物以及治疗的潜在靶点[3]。在过去的20年中,miRNA在肝脏炎症、纤维化和硬化中扮演的角色已经被广泛描述[4]。本文就miRNA在NAFLD中的异常表达情况、致病作用、潜在的临床应用以及有待解决的问题作一综述。
1 miRNA参与NAFLD的发病过程
与健康对照者相比,NAFLD患者体内多种miRNA的表达出现异常(上调或下调),详见表1。当miRNA表达上调或下调时,其对靶点蛋白合成的抑制作用增强或减弱,导致靶点蛋白的合成减少或增加,若靶点蛋白恰好又参与肝脏脂肪代谢和转运,则会引起肝脏脂肪代谢和转运障碍,进而导致NAFLD的发生。
2 miRNA在NAFLD发病机制中的作用
在NAFLD的发病机制中,SFL向NASH、脂肪性肝纤维化和脂肪性肝硬化发展的潜在机制均未完全阐明。传统的“二次打击”学说已获得广泛认可。“第一次打击”主要是肥胖症、糖尿病、代谢综合征等伴随的胰岛素抵抗,导致肝细胞内脂肪过量沉积;“第二次打击”是脂肪过量沉积的肝细胞发生氧化应激,导致线粒体功能障碍,炎症介质产生和释放,肝星状细胞激活,进而引起肝细胞损伤、肝脏炎症和纤维化[29]。近年来,随着与NAFLD的发病机制密切相关的因素越来越多地被发现,“二次打击”学说已被“多次打击”学说所取代[29]。“多次打击”包括胰岛素抵抗、脂肪组织功能障碍、线粒体功能障碍、内质网应激、饮食因素、铁超载、肠道微生态失衡、慢性炎症状态以及遗传学和表观遗传学因素。在表观遗传学因素中,又以对miRNA的研究最为深入。以下是在NAFLD发生、发展过程中发挥重要作用的相关miRNA的总结。
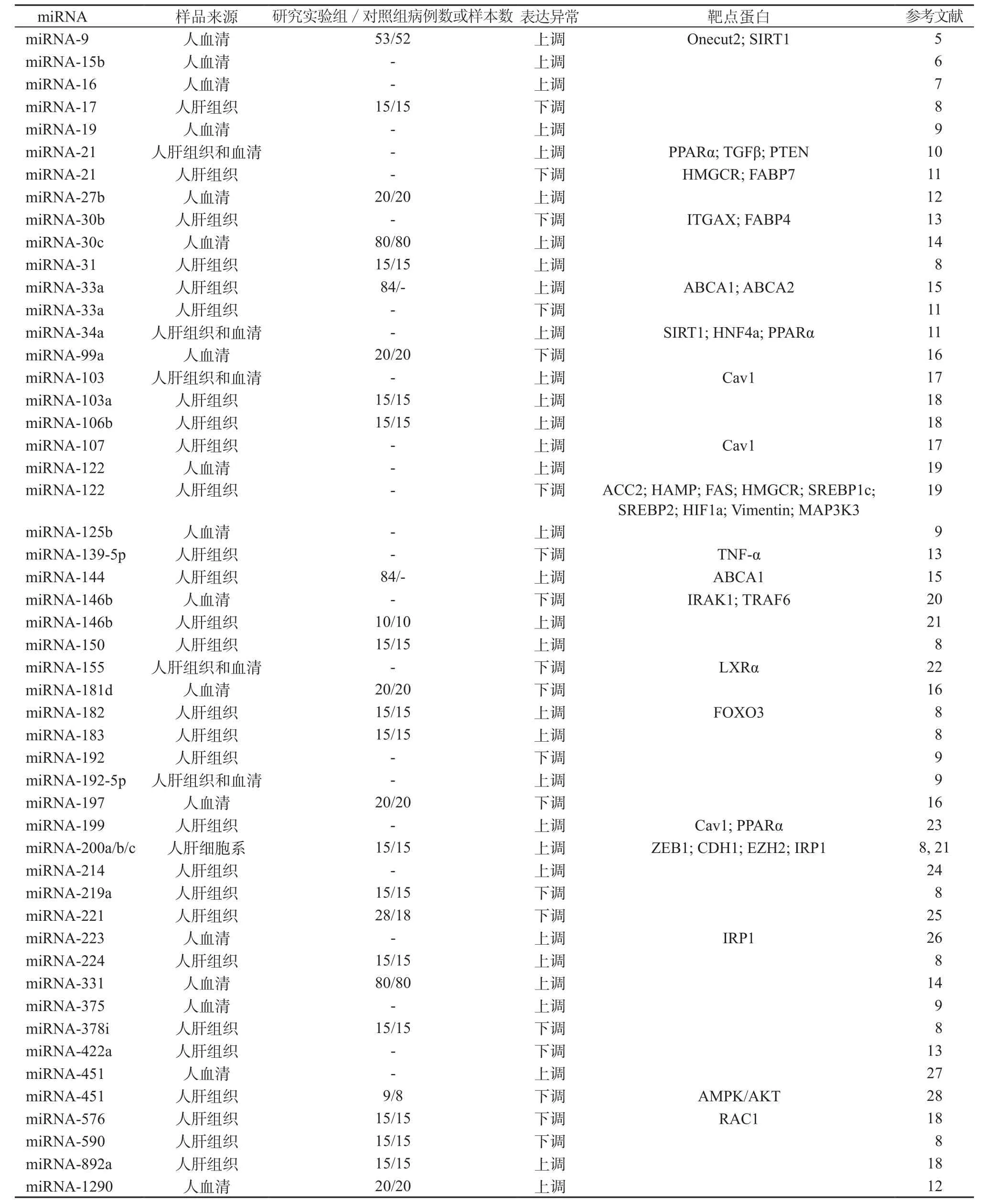
表1 NAFLD中表达异常的miRNATable 1 Abnormal expression of miRNA in NAFLD
2.1 miRNA-34a 研究发现NAFLD小鼠模型和NAFLD患者的肝组织和血清中miRNA-34a表达均上调(见表1)。miRNA-34a的主要靶点蛋白是Sirtuin 1(SIRT1),SIRT1通过激活过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptors α, PPARα)和肝脏X受体(liver X receptor, LXR),或者抑制PPARγ的共激活物1a、甾醇调节元件结合蛋白1c(sterol regulatory element binding protein 1c, SREBP1c)和法尼醇X受体(farnesoid X receptor, FXR)等转录因子维持脂代谢平衡。NAFLD患者miRNA-34a表达上调导致SIRT1合成减少[31],而抑制miRNA-34a表达则能恢复SIRT1的合成,从而激活腺苷一磷酸激活的蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)和PPARα,促进脂肪的分解代谢。
2.2 miRNA-122 miRNA-122是肝脏中最丰富的miRNA,在肝脏生理和脂肪代谢中发挥重要作用[32]。miRNA-122可与人体内多种重要的脂肪代谢酶相互作用,比如乙酰辅酶A羧化酶2(acetyl co-enzyme A carboxylase 2, ACC2)和 SREBP[33]。与健康对照者相比,NAFLD患者肝组织miRNA-122表达下调[9],血清miRNA-122表达上调[9]。尽管结果相反,但miRNA-122与NAFLD发病机制的关系已得到确切的证实。研究发现抑制NAFLD小鼠模型miRNA-122表达可以减轻肝脏脂肪变性,降低血浆胆固醇水平,这与降低肝脏甾醇和脂肪酸合成速率以及激活AMPK介导的脂肪分解代谢有关[34]。此外,体外细胞实验还证实miRNA-122通过靶向脯氨酸4-羟化酶亚基α1调节肝星状细胞增殖及胶原蛋白合成[35],进而引起肝纤维化的发生、发展。
2.3 miRNA-155 在NAFLD患者中,促进脂肪合成的因子如CCAAT/增强子结合蛋白α(CCAAT/enhancer binding protein α, C/EBPα)、C/EBPβ、PPARγ和LXRα[36],促进纤维化的因子如血小板衍生生长因子、SMAD3和C/EBPβ[37],抑制肿瘤的因子如细胞因子信号抑制因子1均可引起miRNA-155表达异常[38]。在NAFLD动物模型中,则呈现出相互矛盾的结果。例如,高脂饮食饲喂miRNA-155表达缺陷小鼠模型出现肝脏脂肪变性加重[38],而蛋氨酸-胆碱缺乏饮食饲喂miRNA-155基因敲除小鼠模型则出现肝脏脂肪变性减轻,而且不伴有肝脏损伤或炎症[37]。这些结果提示,miRNA-155在肝病患者中可能发挥不同的作用[37]。
3 miRNA在NAFLD诊断中的作用
如表1所示,与健康对照者相比,NAFLD患者血清或肝组织的多种miRNA表达异常(上调或下调)。此外,不同阶段的NAFLD患者(包括SFL、NASH、脂肪性肝纤维化和脂肪性肝硬化),血清或肝组织miRNA的表达水平也是不同的。因此,这些表达异常的miRNA可以作为NAFLD诊断和分期的潜在生物标志物。
3.1 miRNA-34a 多项研究表明,与健康对照者相比,NAFLD患者血清和肝组织miRNA-34a表达上调[33]。此外,不同阶段的NAFLD患者,血清miRNA-34a表达水平也不同,miRNA-34a表达水平与血清转氨酶水平、肝脏脂肪变性程度、炎症活动度分级和纤维化分期均呈现正相关[33]。
3.2 miRNA-122 与miRNA-34a相似,miRNA-122也被证明有可作为NAFLD诊断和分期生物标志物的潜力。与健康对照者相比,NAFLD患者血清miRNA-122水平升高[33],远早于血清转氨酶水平升高的时间[39]。此外,miRNA-122作为生物标志物也可以扩展应用到NAFLD的分期中[9]。
3.3 miRNA-192 NAFLD小鼠模型血清miRNA-192水平与NAFLD特征性病理改变的严重程度呈现正相关[40]。另外,与健康对照者相比,NAFLD患者血清miRNA-192表达上调已被证实[9]。此外,还有研究表明,血清miRNA-122和miRNA-192的水平呈现高度正相关[9]。
3.4 miRNA组合 除对单个miRNA的检测,对多个miRNA的联合检测(包含miRNA-122-5p、miRNA-1290、miRNA-27b-3p和 miRNA-192-5p)在NAFLD诊断方面显示出更高的准确性[12]。此外,另一联合检测(包含miRNA-122、miRNA-192、miRNA-19a、miRNA-19b、miRNA-125b和miRNA-375)也有较高的准确性[9]。
4 miRNA在NAFLD治疗中的作用
如前所述,miRNA在NAFLD发生、发展的不同阶段(从SFL到NASH、脂肪性肝纤维化和脂肪性肝硬化)均发挥重要作用,因此也成为NAFLD治疗的潜在靶点[41]。基于miRNA的治疗方案已经在NAFLD动物模型中广泛开展,疗效确切的方案甚至已经进入到临床试验阶段。
4.1 miRNA-34a miRNA-34a的拮抗剂circRNA_0046366能够抑制miRNA-34a的活性,使PPARα信号通路恢复正常,应用于NAFLD小鼠模型后,肝脏脂肪变性获得改善[42]。而另一项将miRNA-34的模拟物(MRX34)用于原发性肝癌治疗的Ⅰ期临床试验(ClinicalTrials.gov注册号:NCT01829971)却由于严重的免疫相关不良事件而提前终止[43]。
4.2 miRNA-103和miRNA-107 在肥胖小鼠模型中,miRNA-103和miRNA-107表达上调,应用miRNA-103/miRNA-107的拮抗剂,能够使靶点蛋白caveolin1(胰岛素受体的关键介质)的合成恢复正常,减轻胰岛素抵抗[19]。但是,另有两项正在进行的临床试验(ClinicalTrials.gov注册号:NCT02826525和NCT02612662)显示,Regulus公司开发的治疗NAFLD和2型糖尿病的miRNA-103/miRNA-107拮抗剂(RG-125/AZD4076)疗效并不令人满意[43]。
4.3 miRNA-122 miRNA-122也是NAFLD治疗的潜在靶点。miRNA-122在肝组织中高度表达,在肝脏的发育、分化过程中扮演重要角色[44]。过表达miRNA-122可以抑制YY1-FXR-SHP调节轴,减少肝内甘油三酯的合成[44]。但是,miRNA-122也是HCV复制的重要因子,过表达miRNA-122治疗脂肪肝的同时,也促进了HCV的复制[45]。
5 尚待解决的问题
随着研究的不断拓展,NAFLD中表达异常的miRNA越来越多地被发现,其影响人体脂肪代谢和转运的机制越来越清楚,基于miRNA的诊断试剂和治疗药物正在开发当中。但是,miRNA代表了一种基因表达调控的新方法,与其他新方法类似,在临床应用之前,首先要解决该方法本身存在的一些问题。
5.1 miRNA下游的靶点不具有惟一性 miRNA下游的靶点不是惟一的,单个miRNA可以调控几十个甚至数百个基因表达[4]。调节某个miRNA的表达会影响下游多个靶点蛋白的合成,这些靶点蛋白的生物学效应可能是相互抵消的,最终显示不出疗效[43]。即使这些效应没有相互抵消,其中一些效应确实是我们需要的,但另一些效应也可能是对机体有害的。
5.2 miRNA对下游靶点的调节具有相互性 在疾病的发病过程中,miRNA与靶点之间经常存在相互调节的现象,我们称之为“反馈环”。例如,miRNA-17-5p可以靶向翻译PPARα的mRNA,抑制其合成。反过来,PPARα可以结合miRNA-17-5p的启动子,促进其表达。通过人工干预过表达miRNA-17-5p,虽然能使PPARα合成减少,但反过来也会使自身的表达下调[46]。
5.3 miRNA药物不具器官/细胞靶向性 动物模型研究表明静脉注射miRNA模拟物/抑制剂是一种有价值的疗法。但是,这些小分子药物进入机体后,并不会靶向特定的器官/细胞,在修复靶器官/细胞功能的同时,也会对正常的器官/细胞造成损伤。此外,这些小分子药物如果未经适当的修饰,进入机体后会引起强烈的免疫反应,造成广泛的免疫损伤[43]。
5.4 miRNA药物的理化性状具有不稳定性 miRNA的模拟物/抑制剂均为小分子物质,大小约为20~25个核苷酸,需要在超低温环境中才能保持正常的理化性状和生物学功能。脱离了超低温环境后,其理化性状是不稳定的,很容易在短时间内降解,失去生物学功能。如何提高miRNA药物稳定性,使其能够在常规条件下长期储存,是有待解决的一大难题[43]。
6 小 结
近年来,有大量的研究关注了miRNA在不同阶段NAFLD中发挥的作用。这些研究包括应用微阵列芯片技术的基因表达数据,应用下一代测序技术的动物模型和人体标本数据,以及应用原位杂交和传感器技术的细胞表型数据。基于这些研究,本文综述了miRNA在NAFLD中的表达异常、致病作用、潜在的临床应用以及尚待解决的问题。miRNA在NAFLD发病机制中的作用已经得到了充分的证实,因此,其作为NAFLD诊断的生物标志物或治疗的潜在靶点是有根据的。由于miRNA表达异常只是NAFLD等慢性多因素疾病的致病因素之一,因此,大多数miRNA的调节作用也是有限的。实际上,多数miRNA仅在疾病的发病过程中扮演着“精密调谐器”的角色。此外,它们也缺乏器官/细胞特异性。尽管如此,许多研究人员相信,只要不断提高对它们在相关疾病中所扮演角色的认知,miRNA终将会给这些疾病的治疗带来新的希望。
