运动调节衰老的表观遗传机制研究进展
2019-09-17杨园叶啟发杨翼
杨园 叶啟发 杨翼
1 武汉体育学院研究生院(湖北430079)
2 武汉大学中南医院(湖北430030)
3 武汉体育学院健康科学学院(湖北430079)
运动对衰老的影响具有双面性,不当的运动能引起机体损伤从而影响衰老进程,而适宜运动则能延缓衰老。不同个体采取不同的运动形式、运动强度及运动时间,对衰老的影响不同。进行长期低强度的有氧运动与短时间大强度的抗阻运动,可改善个体的生理机能,如抗氧化酶活性、肌肉含量、炎性表达、蛋白活动等,以改善与衰老相关的代谢类、心血管类及免疫低下等疾病来延缓衰老。结合当前衰老的研究进展,运动可从改善氧自由基、调节端粒长度及端粒酶活性、促进长寿基因表达、诱发细胞凋亡及延缓干细胞衰老等方面影响衰老进程。本文在Pubmed 数据库检索相关自由词及主题词(“Epigenomic”or“Epigenetics”or“Epigenetic” or “Epigenomics” and “Exercises” or“Physical Activity”or“Activities”or“Exercise”),搜索相关文献,归纳分析,主要从DNA 甲基化、组蛋白修饰、非编码RNA 调控等表观遗传因素的角度,梳理出近10年基于表观遗传机制的运动对衰老调节作用的研究进展,为后续研究提供参考。
1 个体衰老及表观遗传的改变
衰老是机体出现器质损伤和功能弱化的生理过程,主要表现为自身抵抗力的降低及对外界环境刺激反应力的下降,导致生长停滞、机能减退并诱发疾病的易感性,最终引起死亡。表观遗传学是研究在DNA 序列不发生改变的条件下,由于DNA 甲基化、组蛋白修饰、非编码RNA 调控等因素的改变,基因功能发生可遗传的变化并最终导致表型变异的遗传学机制。衰老的发生伴随着DNA 结构稳定性的降低,表观遗传漂移理论可解释与年龄相关的病理变化,即主要发生DNA甲基化漂移。另外,改变表观遗传相关酶(甲基化与去甲基化、乙酰化与去乙酰化)的动态平衡也可影响与衰老相关基因的表达作用。表观遗传信息提供了基因选择性表达的指令,任何异常都将影响染色质结构和基因表达,是衰老及相关疾病发生发展的主要原因之一[1,2],原则上该过程可逆转且具有可塑性。而在理论上针对具有表观遗传属性的可修饰因素予以外在干预(如运动),可在一定程度上实现表观遗传信息的重编以维持正常的基因表达,进而缓解衰老(见图1)。
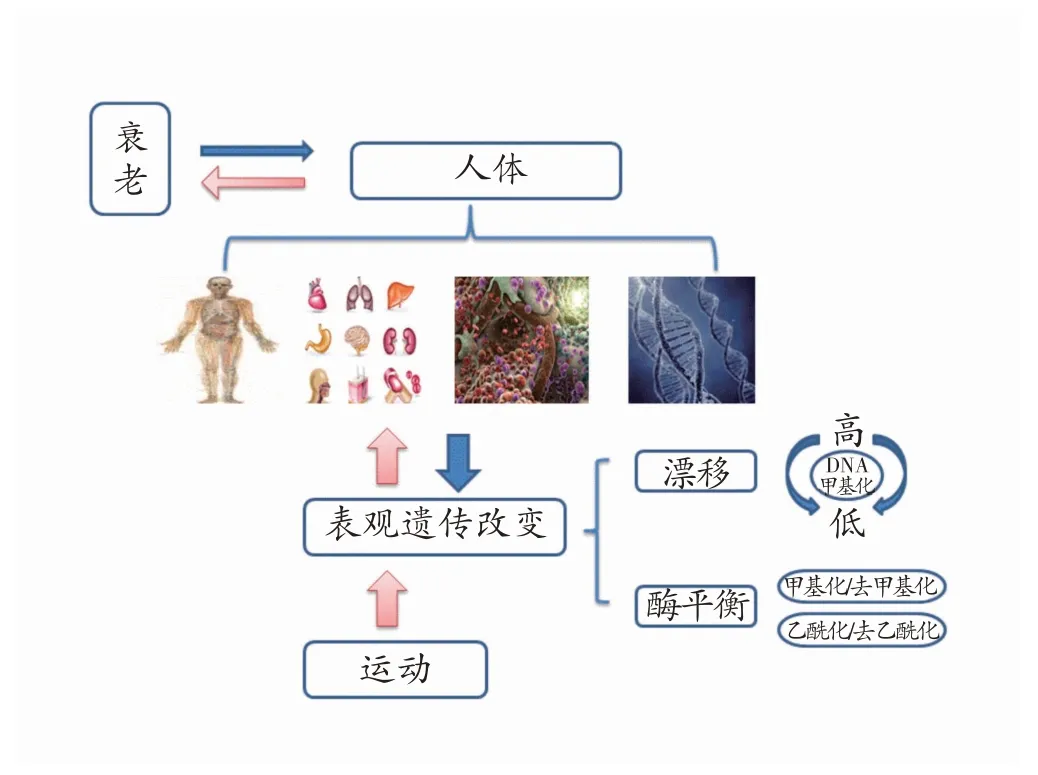
图1 衰老的表观遗传机制及运动干预
2 运动对衰老相关的物质代谢及能量代谢的调节
人类血液表观遗传年龄的分析印证了个体衰老的程度及快慢与遗传因素、环境因素及生活方式的密切关联,其主要病理改变是物质代谢与能量代谢的异常[3]。运动作为外在干预的主要途径,可通过激活机体表观遗传学机制来诱导其代谢过程的适应[4,5]。运动对机体物质代谢的应激途径有多种,如呼吸链基因、组蛋白亚基、小核仁RNA 和核糖体蛋白等介导衰老相关信号通路,均可影响核糖体、氧化磷酸化、蛋白酶体及其他物质的代谢途径[6,7]。另外,不同运动的代谢产物还能调控相关表观遗传酶的活性,并激活以上信号通路,因此表观遗传酶也能调节衰老机体代谢的相关基因表达[8]。
适量运动能促进机体的能量代谢,如利用代谢中间产物干预转录因子、生肌调节因子和线粒体生物合成及功能活化因子等基因表达来调节表观遗传信号,从而促进线粒体的生物合成并缓解机体的衰老进程[9]。Perla等[10]指出运动训练能引起衰老相关的神经-生理保护性反应,主要是通过增强外周及脑细胞内抗氧化防御通路和诱导线粒体生物合成实现的。此外,运动过程中肌肉细胞的应激代谢会使基因特异性表达,而肌肉干细胞的功能和再生能力也会因衰老相关的表观遗传改变而受损[11]。Brown 进行Meta 分析[12]发现1580例个体中387个基因DNA甲基化状态在运动后降低(占60%),并在肌肉基因调节网络中发现了5个与运动相关的印迹位点(KCNQ1,MEG3,GRB10,L3MBTL1,PLAGL1)。Sharples 等[13]则借由“肌肉记忆”假设指出表观遗传信息可反馈于骨骼肌细胞,在代谢及衰老过程中可通过表观调控来改善肌肉的流失及再生。
3 运动通过表观遗传机制对衰老的调节
3.1 DNA甲基化
研究表明,随着年龄的增长,全基因组逐渐发生甲基化,而一些病理状态下基因位点的启动子区域会出现异常的高甲基化[14,15]。适量运动可引起DNA甲基化模式发生改变,即降低衰老个体的高甲基化状态(见图2)。随着器官的衰老,表观基因的异常改变(DNA甲基化)逐渐堆积,与年轻个体相比,衰老个体可去甲基化或复位的基因更多[16]。因此,相较于年轻人,老年人群运动可引起更明显的DNA 甲基化改变,即运动可以通过延缓衰老来改变生物体的“表观遗传年龄”。

图2 运动调节衰老的表观遗传机制[8]
William等[12]指出三种运动类型(骑自行车、练太极拳、步行)均能不同程度地改善机体DNA 甲基化的状态。其中,与骑自行车者相比,太极拳和步行者的DNA甲基化程度更大,但后两者的差异无统计学意义(P=0.25)。另外,运动干预下中老年群体(>40 岁)相关的DNA 甲基化改变更为明显,占到整个甲基化变化人群(1580人)的30%。即随着年龄的增长,运动与DNA甲基化修饰呈负相关,使“表观遗传时钟”发生倒退。Gelson等[17]提出运动可改善衰老大鼠脑组织全基因甲基化状态,尤其对与衰老相关DNA 甲基转移酶1(DNA methyltransferase 1,DNMT1)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)去甲基化的调控。有研究指出衰老人体骨骼肌线粒体氧化能力相对降低,氧化磷酸化有所下调,与受基因调控的呼吸链中细胞色素C 亚单位7A 多肽1(COX7A1)启动子DNA甲基化表观遗传有关[18]。还有研究显示老年女性5 个月间歇步行运动结合摄入高乳制品后能增强大腿肌肉力量、改善炎症的易感性以及核转录因子κB(nuclear factor kappa B,NF-κB)基因甲基化[19]。
而Zhou 等[20]认为衰老基因组DNA 甲基化不受运动影响,小鼠肝脏组织中发生区域性DNA 甲基化的改变主要是受TET(ten-eleven translocation)/DNMT 靶向调控。这与前面运动调节甲基化的研究结果不一致,或许不同的运动形式对机体产生的表观遗传作用具有差异性,如Barres 等[21]检测到的急性运动20 min 内DNA甲基化降低10%(P<0.05),而Robinson等[22]发现青年组和老年组进行高强度有氧伴或不伴抗阻运动12周后,各组位点甲基化与运动前比较均无显著差异。随着年龄的增加,运动对去甲基化的作用与运动时间及强度有关,中低强度且持续6 个月左右的运动更易调节高甲基化状态,而高强度及短期运动则无明显影响,不排除短期内DNA 甲基化在转录过程中发生急剧变化的可能。
3.2 组蛋白修饰
组蛋白不同位点上发生的不同修饰,能够招募不同的效应蛋白,影响衰老相关基因的表达调控或染色质结构状态。运动能作用于组蛋白甲基化修饰部分位点,进而从干细胞、染色质结构及下游衰老基因等多个水平调节衰老过程[23](见图2)。其能诱导与组蛋白修饰有关的组蛋白转乙酰酶/脱乙酰酶(HAT/HDAC)活性的变化,复合调节衰老相关的表观遗传通路。组蛋白甲基酶(SMYD)是组蛋白赖氨酸甲基转移酶的一个亚家族,如SMYD2可通过直接结合特定的DNA共同位点和(或)间接地与辅因子一起通过蛋白质互作调控基因表达[24]。其可作用于转化生长因子-β(TGF-β)通路参与调控细胞的生长抑制、诱导细胞凋亡、细胞自稳态的维持,或通过骨形态发生蛋白(BMP)通路参与胚胎干细胞(ESC)干性维持,以此调节机体衰老。另外,SMYD2 不仅可以甲基化组蛋白,还可以甲基化与衰老相关的非组蛋白如抑癌基因p53、视网膜母细胞瘤基因1(RB1)、DNA 修复酶PARP1、抑癌基因PTEN、热休克蛋白Hsp90和雌激素受体α(ERα)等标志底物[25]。
SIRT1(沉默信息调节蛋白1)是一种经典的组蛋白去乙酰化酶,可直接去乙酰化修饰组蛋白N末端,改变染色体构架及活性,发挥表观遗传学调控功能,进而参与促进细胞及生物体寿命延长[26]。实验表明,在大鼠骨骼肌中,衰老与SIRT1活性下降有关,运动可以对抗这种效应[27]。与年轻大鼠(3月龄)相比,老年大鼠(26月龄)胞浆和核提取物中SIRT1 的水平显著提高(P<0.01),而该酶的活性未随老化而变化;运动训练(跑步)6 周后,老年大鼠SIRT1 的水平显著降低(P<0.01)。研究认为规律运动增加SIRT1活性的具体机制是其能通过逆转衰老个体NAD+和NAMPT水平进而激活Sirturn 通路[28]。这与Brewer 等[29]提出的表观遗传氧化还原转变理论相应,即运动能干预衰老过程代谢组及转录组相关的氧化还原途径,进而调控HAT 及HDACs 作用的表观基因及蛋白,以保证供应充足的NAD+需求量,进而促进细胞物质代谢、能量合成等生理活动。
在临床研究中,运动与增强AMP 依赖的蛋白激酶(AMPK)活性、HDAC4和HDAC5核排斥以及骨骼肌组织中增加的组蛋白H3 第36 位赖氨酸(H3K36)乙酰化有关[30]。如运动可通过调控内源性HDAC 抑制剂β-OHB 的活性作用于酮体代谢,以增加组蛋白乙酰化和改变基因表达,进而上调寿命、下调与衰老相关的老年疾病[31,32]。衰老细胞中HDAC1、HDAC2水平均下降,后者与运动的不适性有关,而运动能增强骨骼肌组织的特异位点(如H3K56)乙酰化[30],以此抑制衰老。实验[33]显示衰老伴记忆下降的大鼠在老化过程中组蛋白乙酰化趋势并不明显,但适度的运动能改善记忆及增加海马H4K12乙酰化水平。
3.3 非编码RNA调控
非编码RNA 包括小非编码RNA 和长链非编码RNA。主要作用是降解靶mRNA或者阻遏靶mRNA的翻译,促使下游基因的沉默。在众多非编码RNA 中,microRNA(miRNA)的表观调控是研究热门之一。运动能干预与年龄相关的骨骼肌的肌肉质量、成分和功能,可能与骨骼肌中的miRNA 调节作用有关[34](见图2)。关于衰老改变骨骼肌miRNA 表达谱的实验研究有很多,如Patricia 等[35]从年轻和老年小鼠腓肠肌中提取的总RNA 进行miRNA 芯片筛选,发现117 个信号强度≥500 的相关miRNAs,其中高度下调的miRNA 有miR-194-5p、miR-101b-3p、miR-148a-3p、miR-199b-5p、miR-335-5p、miR-127-3p、miR-379-5p、miR-541-5p、miR-382-5p、miR-329-3p、miR-299-5p 和miR-434-3p;高度上调的有miR-146b-5p 和miR-146a-5p 等。这些特异位点的miRNA 能靶向作用于翻译因子进而影响细胞凋亡以调节机体衰老。近期研究显示,衰老可改变小鼠骨骼肌miRNA 的表达谱,其骨骼肌中存在低水平的miR-434-3p 和高水平的真核细胞翻译起始因子5A1(eIF5A1),而miR-434-3p 能通过靶向作用于eIF5A1来抑制细胞凋亡[35]。
衰老个体与骨骼肌原始miRNA 的表达增高及外在刺激(如运动、饮食)后miRNA 反应失调有关。如Micah 等[36]研究发现,实验中6 名老年人在运动前primiRNA-1-1、pri-miRNA-1-2、pri-miRNA-133a-1 和pri-miRNA-133a-2 表达比年轻组高(P<0.05),予以抗阻力运动干预后,以上表达在年轻组中下降,而primiRNA-206表达在老年组显著增高。以上结果提示年轻人群骨骼肌中原代和成熟miRNA 的表达较老年人群更容易被抗阻运动与氨基酸摄入的合成刺激所改变。
另外,循环miRNA(c-miRNA)在机体内能直接作用于基因靶点,多向地促进衰老。如Margolis等[37]采用抗阻运动对比年轻人与老年人c-miRNA 的表达情况,发现miR-19b-3p、miR-206、miR-486、miR-19a-3p、miR-19b-3p、miR-20a-5p、miR-26b-5p、miR-143-3p和miR-195-5p 的表达有所差异,提出机体c-miRNA表达失调可以作为衰老的预测指标。Recchioni等[38]也提出通过c-miRNAs 调节机制来讨论运动对衰老及老年心血管病的影响。
4 运动对衰老相关疾病的表观调节作用
表观基因的环境敏感性反映了机体的自适应机制,而机体适应不当或异常表观遗传表达会导致与衰老相关的一系列病理改变,如认知能力的下降、血管病变、血脂代谢异常、骨质疏松症,等。也有研究[39]指出加速衰老与死亡相关的指标如肺功能、步行速度、握力和认知能力的下降无关,至少在相对较短的随访时间内结论如此。但基因组表观遗传修饰仍是对抗人类衰老及相关疾病的有效途径之一,而机体可以通过适量运动调整代谢稳态系统以维持健康、缓解衰老。在衰老过程中,与认知相关的表观遗传差异会发生改变,个体与组织DNA 修饰的特异性表达随着衰老而缩小,即发生表观遗传同化,这也是诱导神经退行性病变等衰老疾病发生的原因[40]。但环境、生活方式等因素却可以改善衰老病变,如适量的有氧运动能改善大脑认知功能,延缓认知下降[41]。Thomas等[42]指出由运动引起的抗氧化作用有益于衰老及心血管疾病的缓解。另外,运动还能促进胰岛细胞DNA 甲基化,降低过氧化物酶体增殖剂激活受体(PPAR-/δ)、丙酮酸脱氢酶激酶4(PDK4)及过氧化物酶体增殖物激活受体C 辅激活因子1α(PGC-1α)等基因表达,进而改善与衰老机体糖脂异常代谢相关的血脂异常、肥胖、胰岛素抵抗和2型糖尿病等[4]。
5 小结与展望
在衰老机制的研究中,表观遗传学的相关理论具有重要意义,可从表观修饰的角度探究机体多通路之间相互作用、共同调节生物体衰老的进程。运动与表观遗传的双向作用是一个复杂而有趣的调控网络,其中与衰老相关的基因转录及表达机制还有很大的研究空间。通过检索中文网站,我们发现与衰老相关的表观遗传研究甚少,原因可能如下:⑴全基因组表观修饰聚类分析的工作量大,但临床样本量偏少,研究进程受限;⑵相关实验与检测技术的高标准及昂贵性,研究难开展;⑶对衰老人群追踪研究的社会调研工作未受重视,研究难深入。
目前基于分子层面的衰老机制(尤其是表观遗传修饰)的研究在国内运动领域还未全面开展,但势必会成为未来的研究重点。国外关于运动对表观遗传的作用已有一定基础研究,但运动改善衰老的具体机制及探讨表观遗传相关路径的工作仍有待开展,这也将是人类主动干预生命进程的重要突破口。
