基于磁共振成像评价不同异柠檬酸脱氢酶分型脑胶质瘤的影像学特征分析
2019-09-17冯宇宁周钊光张瀚文
冯宇宁,雷 益,林 帆,周钊光,张瀚文
(1.汕头大学医学院,广东 汕头 515041; 2.深圳市第二人民医院医学影像科,广东 深圳 518035)
脑胶质瘤是中枢神经系统最常见的原发性肿瘤,以恶性胶质瘤更为常见。我国胶质瘤年发病率为(3~6.4)/10万,恶性胶质瘤发病率高达5.8/10万,年死亡人数为3万。由于胶质瘤细胞具有高度的侵袭能力及增殖能力,患者的预后常表现为高复发率和低生存率[1-2]。胶质瘤的发病机制目前仍在探讨中,可能来源于外在的电离辐射及基因的突变。胶质瘤主要存在异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)1和IDH2突变,超过90%的IDH突变为IDH1突变,以R132类型最为常见,而IDH3突变较少,以下将IDH1和IDH2突变均简称为IDH突变。IDH1突变和胶质瘤患者的生存时间及预后具有相关性[3-4]。Cochrance数据库已经将IDH1基因突变引用为预后评估的重要参考指标[5]。近年来,神经肿瘤分子病理取得了重大进展,目前发现IDH突变有助于脑胶质瘤临床诊断和预后判断。本文将分析不同IDH分型所对应的磁共振成像(magnetic resonance imaging,MRI)特征,探讨两者相关性。
1 资料与方法
1.1 临床资料回顾性分析2014年1月至2018年5月我院收治的80例脑胶质瘤患者。纳入标准:接受MRI检查前均未进行放疗或化疗;行MRI平扫、增强扫描,经手术病理证实,有完整的病理及IDH分型结果。符合纳入标准的80例患者中,男38例,女42例;年龄23~71岁,中位年龄46.18岁。临床症状主要为时间长短不一、不同程度的头晕、头痛、恶心、呕吐,肢体乏力,意识障碍甚至昏迷。
1.2 检查方法MRI检查采用德国Siemens公司Avanto 1.5T、Prisma 3.0T MRI仪器。80例患者术前均行全脑MRI平扫及增强扫描。MRI平扫采用快速自旋回波序列,常规横轴面、冠状、矢状面扫描。扫描参数:体液衰减反转恢复序列:回波时间(TE)=126ms,重复时间(TR)=6 000 ms,反转时间(TI)=863 ms,视野(FOV)=24 cm;T1增强序列:TE=2.8 ms,TR=6.5 ms,TI=450 ms,角度=8度,FOV=24 cm。MRI增强对比剂为钆喷酸葡胺(gadolinium diethylenetriamine pentaacetic acid,Gd-DTPA)对比剂静脉注射,剂量 0.2 mmol·kg-1,注药后即行横轴面、冠状、矢状面扫描。磁共振波谱分析采用多体素检查。所有胶质瘤手术标本均用质量分数4%中性多聚甲醛固定,常规石蜡包埋和HE染色。肿瘤的免疫组化染色均由全自动免疫组化机完成,测定IDH分型。
1.3 结果判读由2位高年资影像科医师共同观察评估病灶的以下表现:部位、大小、信号、边界、扩散加权成像(DWI)信号、强化方式及程度等。结果由2位医师讨论后达成一致意见。
2 结果
胶质瘤病灶位于额叶14例(图1)、颞叶7例(图2)、顶叶8例、枕叶6例、小脑10例、左侧丘脑9例、右侧丘脑8例、脑干9例、胼胝体9例。信号均匀者38例,信号不均匀且发生钙化、囊变坏死者42例。不强化、小斑片状强化者52例,明显不均匀环状强化者28例。病理结果:星形细胞瘤32例,胶质母细胞瘤20例,少突胶质细胞瘤10例,间变性星形细胞瘤9例,间变性少突胶质细胞瘤9例。免疫组化分子病理检测结果显示,IDH突变型45例,IDH野生型35例。45例IDH突变型中有40例(88.9%)发生在单个脑叶,5例(11.1%)发生在脑叶结合部;35例IDH野生型中6例(17.1%)发生在单个脑叶,29例(82.9%)发生在脑叶结合部。45例IDH突变型中有28例(62.2%)信号均匀,17例(37.8%)信号不均匀;35例IDH野生型中13例(37.1%)信号均匀,22例(62.9%)信号不均匀。45例IDH突变型中38例(84.4%)无强化或斑片状强化,7例(15.6%)明显不均匀强化;35例IDH野生型中5例(14.2%)强化较均匀,30例(85.8%)不均匀环形强化,部分坏死囊变,呈花环状。
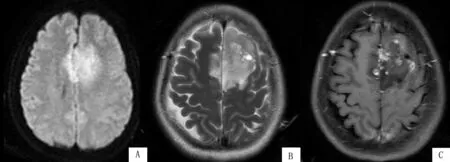
图1 额叶胶质瘤的MRI特征
患者,女,55岁,病理证实为间变性少突胶质细胞瘤,IDH突变型,病灶累及双侧额叶,以左侧为著,DWI(A)显示病灶呈稍高信号,T2(B)显示病灶信号不均,T1增强(C)扫描呈轻度不均匀强化
患者,男,65岁,病理证实为星形细胞瘤,IDH野生型,病灶位于右侧颞枕叶交界区,T2(A)显示病灶信号不均,内可见部分囊变,边界欠清,T1增强(B)扫描呈不均匀环形强化。
3 讨论
2016年最新版《WHO中枢神经系统肿瘤分类》颠覆性改变了胶质瘤传统形态学分型方法,并第一次以分子分型作为肿瘤分型的核心依据。IDH突变状态对胶质瘤预后的影响被认为优于组织学分级。在各级别胶质瘤中,相对于IDH野生型,IDH突变型患者预后较好。基于IDH1和IDH2基因的突变,新分类将所有弥漫浸润性胶质瘤(星形细胞/少突胶质细胞肿瘤)归于一类。IDH1基因突变是脑胶质瘤最常见的基因突变[6]。主要机制是IDH1突变破坏了异柠檬酸脱氢酶的亲和力,使该酶与底物结合的能力急剧下降,并且突变型IDH1能够与野生型IDH1相互竞争底物,突变型IDH1与底物结合形成二聚体,进而使得IDH1的活性降低,最终酮戊二酸生成量大幅度下降。一系列的改变使得脯氨酸羟基化酶活力被降低,增加了细胞缺氧诱导因子(hypoxia-mduciblefactor,HIF)的稳定活性,HIF信号通路被激活,最后导致了肿瘤的生长[7]。
最近有研究分析了IDH1表型与胶质瘤的位置以及影像特征的关系[8],但关注的重点是幕上胶质瘤的MRI表现。本研究中的病例不仅包括幕上,还包括幕下小脑及脑干等部位。研究[9]报道IDH突变与胶质瘤MRI表现密切相关,在60%~93%的弥漫型星形细胞瘤、间变型星形细胞瘤、胶质母细胞瘤、少突胶质细胞瘤、间变型少突胶质细胞瘤中均检测到IDH突变。本研究发现,突变型脑胶质瘤通常情况下位于一侧脑叶,比如额叶、颞叶或小脑,IDH突变型脑胶质瘤最常见顺序依次为额叶、顶叶、枕叶和颞叶,好发于单侧,病灶的边界清晰,信号强度较均匀,增强扫描病灶大部分没有显著强化或轻度强化。国内学者曾经分析了手术及病理证实82例低级别胶质瘤的影像学特征[10],结果是IDH突变低级别胶质瘤好发于右侧额叶,其次为右侧颞叶和左侧颞叶,与本研究结果基本一致。但是其认为IDH野生型低级别胶质瘤好发于左侧额叶,其次为左侧颞叶和右侧颞叶,本组病例与文献报道不尽相同,可能与我们收集的病例包括幕上、幕下有关。文献报道IDH突变型胶质瘤的信号较均匀,本组研究信号不均匀者较多,45例中有17例信号不均匀,可能与本组病例中少突胶质细胞瘤例数较多有关,因为少突胶质细胞瘤多发生钙化,MRI表现为低信号,所以病灶信号不均。而我们研究发现IDH1野生型脑胶质瘤好发于脑叶结合部位,比如丘脑、基底节、胼胝体或脑干;部分病灶位于额叶、颞叶,但是病灶累及范围较广,增强扫描强化程度可见多种强化方式,包括轻度强化、中等强化及明显强化,其中不规则明显环形强化较多,这与国外文献一致[11]。IDH-1突变型脑胶质瘤大多位于肿块能被容易切除的区域,我们的研究也验证了这一结果。
综上所述,IDH突变型脑胶质瘤MRI检查特点是病灶好发于单侧脑叶,多为不强化或斑片状强化;IDH野生型脑胶质瘤好发于脑叶结合部位,多为不规则环形强化。通过影像和病理的相关特点,有望初步判断不同IDH分型脑胶质瘤的生物学行为和预后。
