沉默细胞周期检测点激酶1基因对肺腺癌顺铂敏感性的影响
2019-09-17杨红梅牛朝霞李宜培
杨红梅,陈 洁,牛朝霞,李宜培
(河南医学高等专科学校基础医学部,河南 郑州 451191)
化疗药物激活细胞周期检测点,引发细胞周期阻滞,为受损脱氧核糖核酸(deoxyribonucleic acid,DNA)修复提供充足的时间,使肿瘤细胞逃逸凋亡,是肿瘤细胞对化疗药物敏感性和疗效下降的机制之一[1]。细胞周期检测点激酶1(checkpoint kinase 1,Chk1)是细胞周期检测点信号转导通路中重要的丝氨酸/苏氨酸激酶,在G2期DNA损伤应答反应中发挥重要效应[2-3]。以铂类药物为基础的联合化疗是目前非小细胞肺癌(non-small cell lung cancer,NSCLC)的一线治疗方案[4]。本实验采用小干扰核糖核酸(small interfering ribonucleic acid,siRNA)技术靶向沉默肺腺癌A549细胞中Chk1基因的表达,阻断细胞周期检测点信号转导通路,探讨沉默Chk1基因对肺腺癌A549细胞顺化疗敏感性的影响。
1 材料与方法
1.1 材料RPMI-1640培养基购自杭州四季青生物工程材料有限公司;Chk1 siRNA(基因序列:5’-GATCCG CTGAAGAAGCAGTCGCAGT TTCAAGAGA ACTGCGACTGCTTCTTCAGTTTTTTGGAAA-3’;5’-AGCTTTTCCAAAA AACTGAAGAAGCAGTCGCAGT TCTCTTGAA ACTGCGACTGCTTCTTCAGCG-3’)由苏州吉玛基因股份有限公司合成;LipofectamineTm2000转染试剂盒购自美国Invitrogen公司;兔抗人Chk1多克隆抗体购自美国Santa Cruz公司;Annexin V-FITC/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒、Western杂交显影用增强化学发光试剂盒(ECL)购自美国BioLegend公司;顺铂注射液(商品名:诺欣,江苏豪森药业股份有限公司,规格6 mL30 mg)。
1.2 细胞培养肺腺癌A549细胞来自中国科学院上海细胞学研究所。常规培养于含体积分数10%胎牛血清,1%双抗(青霉素100 u·mL-1和链霉素100 μg·mL-1)RPMI-1640培养基中,于37.0 ℃、体积分数5% CO2、饱和湿度条件下培养。质量分数0.25%胰蛋白酶消化传代,收集对数生长期细胞备用。
1.3 细胞分组及siRNA转染取对数生长期肺腺癌A549细胞,按1×105/孔接种于6孔板培养过夜,细胞贴壁至70%~80%融合时,进行转染(严格按照脂质体转染试剂盒说明书进行)。实验细胞共分为4组:联合组(Chk1 siRNA+顺铂,即Chk1 siRNA转染肺腺癌A549细胞24 h后,再用浓度为10 μmol·L-1顺铂处理肺腺癌A549细胞12 h)、Chk1 siRNA组(Chk1 siRNA转染肺腺癌A549细胞24 h)及顺铂组(10 μmol·L-1顺铂处理肺腺癌A549细胞12 h)和对照组(肺腺癌A549细胞不经任何处理)。各组设重复孔12个。
1.4 Western Blot法检测Chk1蛋白表达收集细胞,预冷磷酸盐缓冲液(phosphate buffered saline,PBS)洗2次,裂解提取细胞总蛋白,聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)蛋白定量测定法检测蛋白浓度。煮沸5 min使蛋白变性,质量分数10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳后湿转至硝酸纤维素膜,50 g·L-1脱脂奶室温封闭1 h,TBST(Tris-HCl 20 mmol·L-1,NaCl 137 mmol·L-1含体积分数0.1% Tween-20)洗3次,一抗37.0 ℃孵育2 h,TBST洗3次,加入相应二抗37 ℃孵育1 h,TBST洗3次,ECL曝光显影,以磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)作为内参,凝胶成像系统检测蛋白表达灰度值,计算Chk1/GAPDH比值表示Chk1蛋白的相对表达量。
1.5 流式细胞仪检测细胞周期收集各组细胞,制备单细胞悬液,预冷PBS洗涤,体积分数70%冰乙醇4 ℃固定过夜,PBS重悬细胞,调整细胞浓度,依次加入50 μg·mL-1PI和1 mg·mL-1核糖核酸酶A,室温避光孵育30 min后,流式细胞仪检测细胞周期分布。
1.6 细胞凋亡情况检测收集各组细胞,PBS洗涤,调整细胞浓度为2×105·mL-1,按Annexin V-FITC试剂盒说明操作,流式细胞仪检测细胞凋亡情况。
2 结果
2.1 肺腺癌A549细胞Chk1蛋白表达情况Chk1蛋白在肺腺癌A549细胞中高表达,转染siRNA后Chk1蛋白表达水平明显降低。与对照组比较,顺铂组Chk1蛋白表达减少,但差异无统计学意义(P>0.05);Chk1 siRNA组和联合组Chk1蛋白表达明显降低(P均<0.05);联合组Chk1蛋白表达明显低于顺铂组(P<0.05)。见图1、表1。
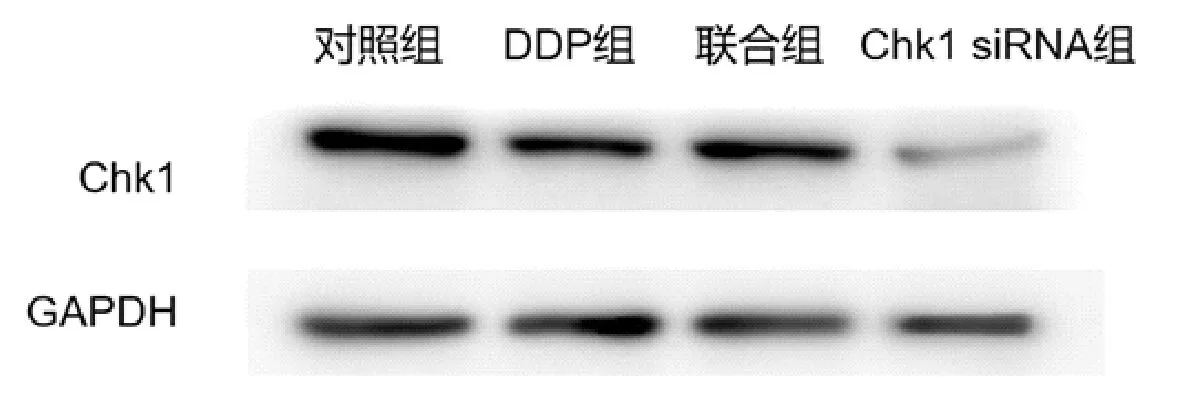
图1 Western blot法检测各组肺腺癌A549细胞Chkl蛋白表达情况
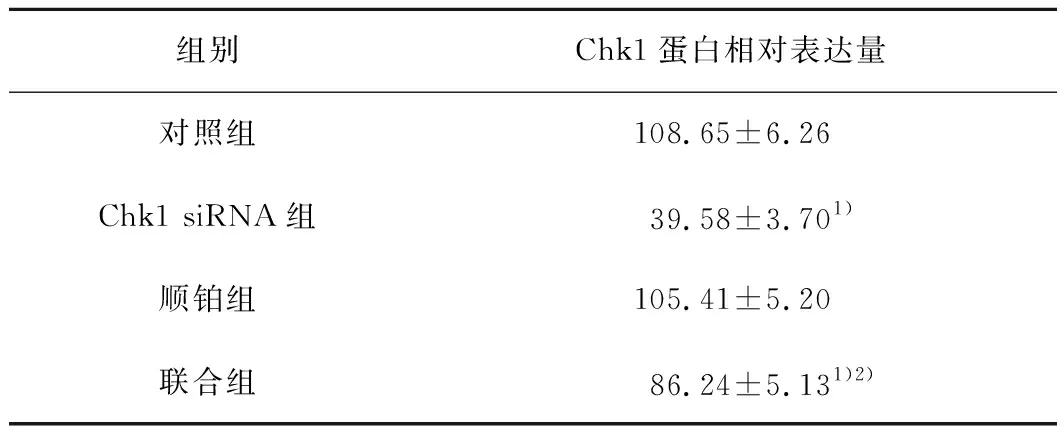
表1 各组肺腺癌A549细胞Chk1蛋白表达比较
注:与对照组比较,1)P<0.05;与顺铂组比较,2)P<0.05
2.2 Chk1 siRNA转染对顺铂处理肺腺癌A549细胞的细胞周期分布的影响正常培养的肺腺癌A549细胞以G0/G1期为主,顺铂组和联合组肺腺癌A549细胞出现明显的G2/M期阻滞,S期、G2/M期细胞比例较对照组和Chk1 siRNA组明显增多(P均<0.05),而联合组S期、G2/M期细胞比例又低于顺铂组(P均<0.05)。见图2、表2。
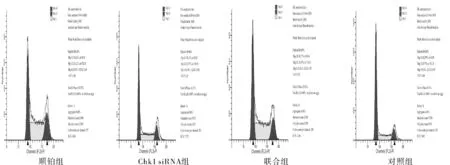
图2 流式细胞仪检测各组肺腺癌A549细胞的细胞周期分布情况

G0/G1期S期G2/M期对照组82.09±2.979.16±1.548.75±1.23Chk1 siRNA组70.12±2.2316.31±2.701)13.57±1.571)联合组50.17±2.1829.36±1.081)2)20.47±3.82 1)2)顺铂组38.26±3.5735.52±2.131)26.22±2.441)
注:与对照组比较,1)P<0.05;与顺铂组比较,2)P<0.05
2.3 Chk1siRNA转染对顺铂处理肺腺癌A549细胞凋亡的影响联合组、Chk1 siRNA组及顺铂组早期凋亡细胞数和晚期凋亡细胞数均高于对照组(P均<0.05);联合组与Chk1 siRNA组及顺铂组比较,早期凋亡细胞数和晚期凋亡细胞数增多(P均<0.05)。见图3、表3。
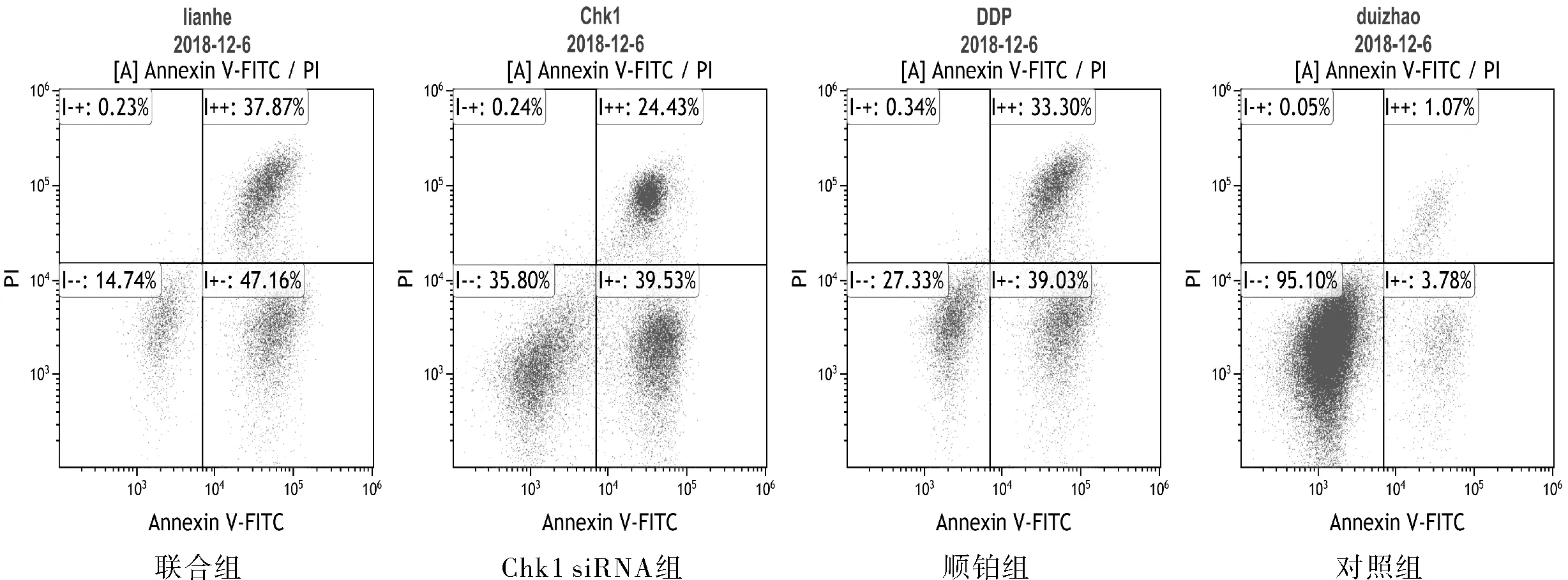
图3 流式细胞仪检测各组肺腺癌A549细胞的细胞凋亡情况

组别存活细胞早期凋亡细胞晚期凋亡细胞损伤细胞对照组95.10±2.893.78±0.611.07±0.460.05±0.00Chk1 siRNA组35.80±1.7639.53±1.0124.43±2.250.24±0.02顺铂组27.33±1.6339.03±2.3633.30±1.420.34±0.08联合组14.74±0.7847.16±2.5237.87±1.760.23±0.06
注:各实验组凋亡细胞数与对照组两两比较,P均<0.05;联合组与Chk1 siRNA组及顺铂组比较,P均<0.05
3 讨论
肺癌发生率在我国呈逐年上升趋势,约85%为非小细胞肺癌,肺腺癌占非小细胞肺癌的30%以上[5]。顺铂是治疗非小细胞肺癌的基础药物,为细胞周期非特异性药物,通过作用于DNA引起DNA复制障碍而发挥抗肿瘤的效应,然而由铂类引发的多药耐药使含铂类的联合方案临床有效率仅为30%~40%[6]。
肿瘤细胞对化疗药物敏感性降低产生耐药与化疗药物引起肿瘤细胞凋亡逃逸有关[1,7],化疗药物引起肿瘤细胞DNA损伤,激活细胞周期检测点信号转导通路,使细胞分裂停止,细胞周期阻滞,从而为受损的DNA修复提供充足的时间,因此认为化疗药物引起细胞周期检测点激活是肿瘤细胞的一种自我保护机制[8]。Chk1是细胞周期检测点信号转导通路中的重要蛋白激酶,细胞周期检测点信号转导通路主要由共济失调毛细血管扩张症突变蛋白(atsxia telangiectasia mutant,ATM)基因和ATM/Rad3相关蛋白基因-Chk1/2-细胞分裂周期蛋白25A、25B、25C轴组成,且认为Chk1是G2期DNA损伤应答反应中的重要效应分子[2],刘志祥等[9]研究发现利用RNA干扰技术靶向沉默胃癌SGC-7901细胞的Chk1基因表达可显著消除G2/M期阻滞,增强二烯丙基二硫诱导胃癌SGC-7901细胞凋亡的敏感性。因此,以Chk1为靶点干扰细胞损伤修复机制,提高恶性肿瘤化疗敏感性成为目前肿瘤领域研究热点。
本研究利用siRNA特异性沉默肺腺癌A549细胞Chk1基因,探讨沉默Chk1基因对肺腺癌A549细胞顺铂敏感性的影响。Western Blot检测结果显示Chk1 siRNA可明显抑制肺腺癌A549细胞Chk1蛋白表达,表明Chk1基因沉默有效;流式细胞术检测细胞周期变化显示,顺铂作用后出现G2/M期阻滞,Chk1 siRNA转染后G2/M期细胞比例明显降低,同时流式细胞术检测结果显示联合组细胞凋亡率明显高于顺铂组和Chk1 siRNA组,说明通过siRNA沉默Chk1基因可抑制Chkl蛋白表达,消除顺铂引起的肺腺癌A549细胞的G2/M期阻滞,导致肿瘤细胞的自我保护能力下降,促进肿瘤细胞凋亡,从而提高肺腺癌对顺铂的敏感性。
