多层螺旋CT血管造影对急性主动脉综合征诊断价值
2019-09-17青岛市市立医院东院区放射科山东青岛266071
青岛市市立医院东院区放射科(山东 青岛 266071)
张专昌 赵 宏
急性主动脉综合征(acute aortic syndromes,AAS)是一组病理生理学机制不同但合并存在或相互转变的心血管危急重症,常见类型包括主动脉夹层(aortic dissection,AD)、主动脉壁内血肿(intramural aortic hematoma,IMH)及主动脉穿通性溃疡(penetrating aortic ulcer,PAU)等组成[1]。AAS起病急且预后差,患者主要症状为急性胸痛,其诊断主要依赖影像学检查结果,随着影像学技术发展和设备改善,临床对AAS认识水平不断加深,为早期诊断和治疗创造了良好条件,X线数字减影血管造影(Digital Subtraction Angiography,DSA)目前仍是AAS诊断金标准,但多层螺旋CT(multislice CT,MSCT)在图像分辨率、扫描范围及安全性等各方面已体现出较大优势,且强大的后期图像处理能力有利于从多个角度显示病变细节信息,对评估病情严重程度和指导临床治疗均具有重要意义[2-4]。本研究主要探讨MSCT血管成像(multislice CT angiography,MSCTA)在AAS诊断中的应用情况及临床价值,为推广其临床应用提供参考依据。
1 资料与方法
1.1 一般资料 选取2016年10月至2018年10月我院48例AAS患者临床资料进行回顾性分析,其中男性27例、女性21例,年龄37~82岁,平均(62.78±13.49)岁,体质量指数(BMI)19.7~28.6Kg/m2,平均(24.86±3.54)Kg/m2,其中因胸背部剧烈疼痛入院者41例、因其它检查怀疑主动脉病变者7例。纳入标准:①经手术或DSA检查确诊;②年龄>18岁;③均完成MSCTA检查且图像质量清晰完整;④患者及家属知晓本研究并签署同意书。排除标准:患者临床资料不全。
1.2 检查方法 患者入院后均采用Philips 256层MSCT进行检查,扫描范围为胸廓入口至双侧髂动脉分叉处,参数设置为电压80~100kV、电流100~200mA、螺距1.0~1.5、准直宽度0.5~1.0 mm、重建层厚1.0~1.5.mm、重建间隔0.75~1.0mm,采用高压双筒注射器根据患者体重按1.0~1.6g/s注射对比剂,注射完成后以相同速率注射30~60mL生理盐水,选择气管分叉下2cm处胸主动脉为感兴趣区域(ROI)采用团注追踪扫描技术设置延迟扫描,触发阈值100~150Hu,延迟时间4~6s,扫描参数为电压120kV、电流200~500mA、准直宽度128×0.625mm、层厚1.0mm、层间隔0.5mm、螺距0.984:1,将扫描数据导入EBW工作站进行处理,采用多平面重组(MPR)、容积重现(VR)及最大密度投影(MIP)等技术进行三维重建,计算升主动脉至双侧髂动脉等个层面CT值和层面对比噪声(CNR),由两名经验丰富的影像科医师在不知道金标准结果的情况下评估图像质量并进行诊断。
1.3 统计学方法 数据分析采用SPSS19.0软件,计数资料以率(%)表示,组间对比进行χ2检验或Fisher精确检验,计量资料采用表示,两组间比较进行独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 MSCTA诊断AAS准确性分析 48例患者中经手术证实为AAS者37例,经DSA检查证实者11例,其中AD患者36例(75.00%)、IMH患者9例(18.75%)、PAU患者3例(6.25%);MSCTA检查发现主动脉病变48例,诊断和鉴别准确率均为100.00%。
2.2 AD图像特征分析 36例AD患者中Standford A型7例,占比19.44%;Standford B型29例,占比80.56%,MSCT平扫图像特征包括主动脉增宽25例(69.44%),主动脉腔内高密度线样内膜11例(30.56%),主动脉壁高密度新月征或弧形增厚7例(19.44%),管腔内钙化灶斑块3例(8.33%),此外金标准检出36例患者42个破口,单破口患者32例、占比88.89%,多破口患者4例,占比11.11%;MSCTA共发现36例患者41个破口,两者破口数量、位置及大小比较差异均无统计学意义(P>0.05)。见表1。
2.3 IMH图像特征分析 9例IMH患者MSCT平扫图像基本特征为主动脉壁增厚,其中管壁新月形高密度影7例(77.78%),管壁环形增厚2例(22.22%),受累升主动脉血肿厚度为(13.04±2.76)mm,主动脉弓为(10.97±3.41)mm,降主动脉为(10.49±2.35)mm。
2.4 PAU图像特征分析 3例PAU患者共发现8处溃疡,主动脉弓1处、胸主动脉5处、腹主动脉3处,MSCTA图像特征为主动脉中下段溃疡性突起和龛影,其中乳头状2例、扁平状1例、蘑菇状3例、火山口状2例。
3 讨 论
AAS又称急性胸痛综合征,最早由Vilacosta等于1998年首次提出,其发病率约2~3.5/10万,其中以AD最为常见,占比超过60%,其次为IMH约10%~30%,PAU约2%~7%以及不稳定性主动脉瘤等,故而临床对AD研究最多,而对IMH或PAU认识相对不足[5-6]。目前普遍认为AAS是因遗传、高血压或冠状动脉粥样硬化等因素作用所致且具有相似临床特征的一组主动脉疾病,起病较急且进展迅速,常因主动脉破裂等各种并发症死亡,早期准确诊断和规范治疗是改善患者预后的关键因素[7]。
AAS因缺少典型症状和敏感实验室指标导致早期诊断较为困难,多普勒超声及心电图等常规检查仅可与冠脉急性病变进行鉴别,采用影像学检查对进一步明确病变性质具有重要参考价值,MSCT用于AAS诊断可在10s内完成整个扫描过程,其标准扫描方案包括平扫、增强扫描,其中平扫对IMH诊断和鉴别具有独特优势,同时也有利于显示心包、胸腔或纵隔积液或积血,为评估病情严重程度提供参考依据,MSCTA还有利于显示破口、夹层、血肿或溃疡等病变位置、大小及累及范围等细节信息并对病情严重程度进行定量评价,对指导临床治疗具有重要意义[8]。本研究中48例AAS患者全部经手术或DSA检查证实,其中AD患者36例、IMH患者9例、PAU患者3例,回顾性分析结果显示MSCTA诊断AAS准确率为100%,与谢超贤[9]研究结果一致。
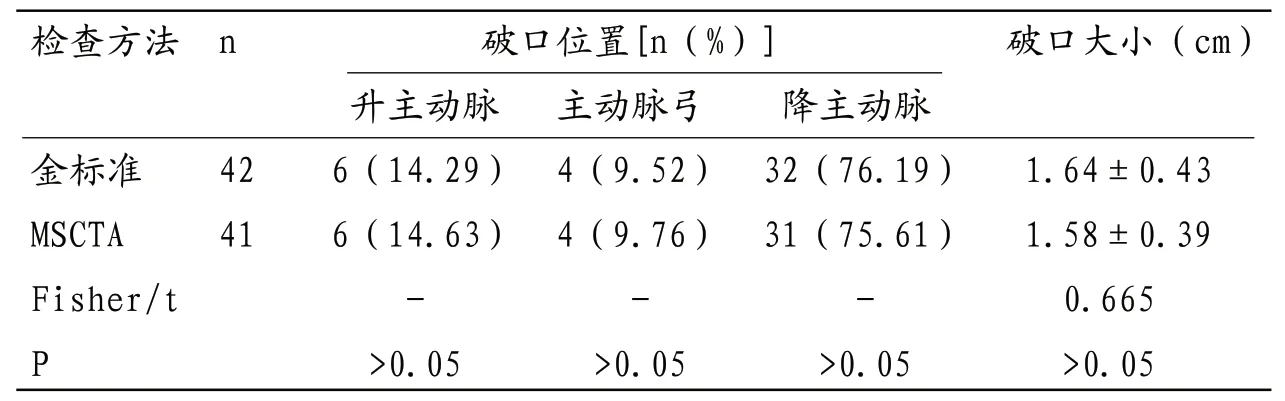
表1 破口位置及大小检查结果比较
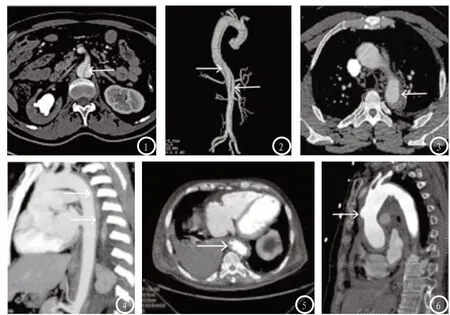
图1-2 AD患者MSCTA检查,图1 MPR轴位重建可见真假腔和线样低密度内膜影;图2 VR重建显示螺旋形撕裂内膜片。图3-4 IMH患者MSCTA检查,图3 轴位增强扫描图像显示新月状低密度影;图4矢状位MIP重建显示病变累及主动脉弓和降主动脉。图5-6 PAU患者MSCTA检查,图5 轴位图像可见主动脉壁不规则突起和溃疡龛影;图6 MIP重建显示动脉壁内龛影和壁间血肿。
AD是AAS中最常见的类型,其病理学基础为主动脉中层退行性病变累及胶原纤维和弹性纤维,受高血压和年龄等因素影响,内膜发生破裂,血液进入主动脉中层造成管壁剥离和扩张[10]。本研究中48例AAS患者中AD患者36例(75.00%),其中Standford A型7例,Standford B型29例,MSCT平扫可见主动脉增宽25例(69.44%),主动脉腔内高密度线样内膜11例(30.56%),主动脉壁高密度新月征或弧形增厚7例(19.44%),管腔内钙化灶斑块3例(8.33%),此外本研究显示MSCTA对破口数量、位置及大小检测结果与“金标准”无明显差异,表明其在AD诊断中具有重要临床价值,并可准确显示病变位置、真假腔、破口位置以及分支血管受累情况,对外科手术治疗具有重要参考价值,多数患者在MSCT平扫图像上表现为真腔管径偏小而假腔管径偏大,增强扫描显示假腔密度稍低并可见附壁血栓,MSCTA和三维重建则有利于发现内膜破口位置和数量,从而指导临床分型和治疗方案选择。
IMH是局限于主动脉中层的内涵性血肿,好发于主动脉右侧壁或峡部近端等承受压力较高的地方,与AD主要区别为主动脉内膜保存完整,其具体病因也尚未明确,目前主要有主动脉中层滋养血管破裂所致出血或AD内膜破裂加强血栓形成两种推测观点[11]。IMH在MSCT检查主要表现为主动脉直径增加以及管壁环形或新月形等或低密度影,本研究48例AAS患者共发现IMH患者9例(18.75%),其中MSCT图像显示管壁新月形高密度影7例(77.78%),管壁环形增厚2例(22.22%),后者提示病变累及主动脉全周,测量各部位血肿厚度显示按升主动脉、主动脉弓和降主动脉顺序逐渐减小,提示离心脏越近,主动脉所受压力越大,患者病情可能越严重。
PAU是溃疡性动脉硬化破坏主动脉内膜所致,其发病与年龄、高血压和动脉粥样硬化有关,且好发于胸主动脉中下段,可穿透弹力层形成IMH或造成主动脉扩张、AD及主动脉破裂等并发症[12]。MSCTA是PAU首选检查方法,其特征性表现为龛影,并可显示龛影形态及其与主动脉腔的解剖关系,本研究中3例PAU患者共发现8处溃疡,分别位于主动脉弓1处、胸主动脉5处及腹主动脉3处,形态特征为乳头状2例、扁平状1例、蘑菇状3例和火山口状2例,表明MSCT可准确评估溃疡发生位置及形态特征,为溃疡稳定性评估和治疗方案选择提供参考依据。
综上所述,MSCTA用于AAS诊断可准确鉴别AD、IMH和PAU,并详细显示不同病变发生位置、累及范围及主动脉整体情况等信息,对评估病情严重程度和指导临床治疗具有重要意义。