低剂量阿帕替尼联合卡培他滨在多线治疗失败的晚期乳腺癌中的疗效观察
2019-09-16单宏杰肖迎利
单宏杰,肖迎利,李 红,马 骖
(安徽医科大学附属宿州医院:1.肿瘤外科;2.肿瘤内科,安徽宿州 230032)
我国每年乳腺癌新发病27.9万,居女性恶性肿瘤第1位,病死率居第5位,严重危害广大妇女的健康[1]。虽然影像学筛查使得早期乳腺癌的发现率得到明显提高,但仍有部分患者出现复发、转移且更有患者在就诊时病期已较晚,导致治疗效果较差。对于多线治疗失败的晚期乳腺癌目前仍无标准治疗方案。 阿帕替尼是一种抗血管生成靶向药物,在多种肿瘤治疗中均显示了良好的治疗效果。有研究显示低剂量阿帕替尼较高剂量更具有效性[2]。本文主要研究低剂量阿帕替尼联合卡培他滨在多线治疗失败的晚期乳腺癌治疗中的疗效及安全性。
1 资料与方法
1.1一般资料 分析本院肿瘤外科及肿瘤内科2015年3月至2018年1月收治的40例多线治疗失败的晚期乳腺癌患者的临床资料,其中观察组22例,对照组18例,其入组标准:(1)局部复发,肺、肝等转移均经穿刺病理证实,骨、头颅转移通过椎体核磁共振(MRI)、发射型计算机断层扫描仪(emission computed tomography,ECT)及头颅MRI筛查,并经正电子发射计算机断层显像(PET-CT)证实,所有患者均合并1种及以上转移病灶;(2)所有患者均经至少三线以上化疗失败且使用过紫杉类、蒽环类、吉西他滨、铂类等药物,人表皮生长因子受体2(Her-2)阳性者已采用曲妥珠单抗;(3) 卡式(KPS)评分大于或等于70分;(4)告知患者目前阿帕替尼主要适应证为胃癌、乳腺癌的应用仍处于实验阶段,并签署同意书;(5)血常规及肝肾功能检查均无明显异常;(6)肿瘤4 cm以上或腋窝淋巴结转移3个以上均予以放疗。年龄35~63岁,平均48岁,其中三阴性乳腺癌28例(对照组12例,观察组16例),Her-2阳性型7例(对照组3例,观察组4例),激素受体阳性Lumina型5例(对照组3例,观察组2例),两组患者分子分型结果差异无统计学意义(χ2=2.00,P=0.391),所有患者均经本院伦理委员会通过,见表1。
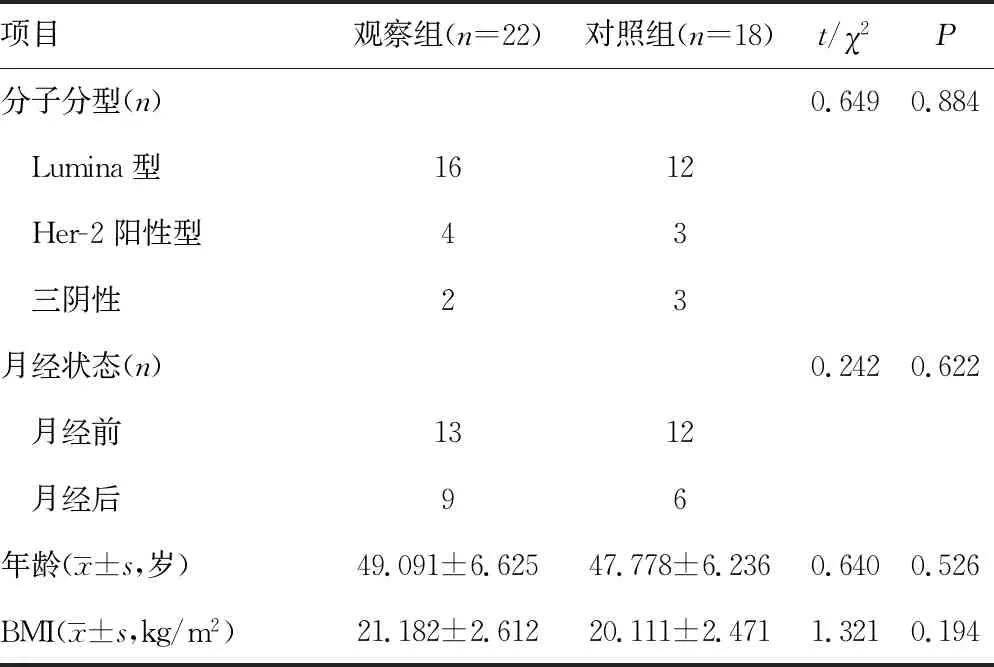
表1 两组患者一般资料比较(n)
1.2方法 所有患者入院后分为观察组和对照组,其中观察组患者入院后予以评估患者一般情况及有无心脏病、高血压、肾脏病、出血疾病。如患者一般情况尚可且无明显并发疾病者给予低剂量阿帕替尼(江苏恒瑞公司)5 00 mg/d,1次/d,28 d为1个疗程,餐后服用,直到疾病进展,同时口服卡培他滨1 000 mg·m2·d-1,分2次口服,饭后服用,连用14 d,休息7 d,21 d为1个周期。对照组用卡培他滨治疗,口服方式同观察组。治疗终点为:(1)不良反应不能耐受;(2)无效或进展或死亡。每周复查血常规及肾功能、监测血压等情况。
1.3观察指标 根据实体肿瘤的疗效评价标准1.0 RECIST(response evaluation criteria in solid tumors),完全缓解(complete response,CR):所有可见病灶完全消失,并至少维持4周以上;部分缓解(partial response,PR):肿瘤病灶减少50%及以上,维持4周以上;稳定(stable disease,SD):病灶稳定或肿瘤增加小于或等于25%,减少小于50%,并至少维持6周;进展(progressive disease,PD):出现新病灶或原有病灶增加大于25%;计算疾病控制率(disease control rate,DCR),DCR=(CR+PR+SD)/总病例数×100%;客观反应率(objective response rate,ORR),ORR=(CR+PR)/总病例数×100%,观察患者无进展生存时间(PFS,从阿帕替尼治疗至疾病进展或死亡时间)以及患者不良反应。所有患者随访采用门诊病房随诊及电话随访方式进行,随访至2018年7月。

2 结 果
2.1近期疗效 观察组22例患者中CR 0例,PR 9例,SD 7例,PR 6例;对照组18例患者中CR 0例,PR 2例,SD 6例,PD 10例。观察组ORR为40.9%,对照组为11.1%,观察组DCR为77.3%,对照组为44.4%,两组患者ORR、DCR差异有统计学意义(P<0.01)。按分子分型Lumina型观察组ORR为43.8%,对照组为16.7%,Her-2阳性型观察组ORR为25.6%,对照组为16.7%,三阴性乳腺癌观察组为50.0%,对照组为0。Lumina型观察组DCR为75.0%,对照组为16.7%,Her-2阳性型观察组DCR为75.0%,对照组为100%,三阴性乳腺癌观察组DCR为100%,对照组为100%,各分型两组比较差异均有统计学意义(P<0.01)。其中观察组胸壁复发、肺转移缓解较明显。见表2。

表2 两组患者分子分型治疗情况比较[n(%)]
2.2生存分析 两组患者治疗随访至2018年7月,中位随访时间20个月,观察组22例中死亡8例,中位PFS为4.69个月,95%CI:3.44~5.76。对照组18例患者中死亡13例,中位PFS为2.11个月,95%CI:1.29~2.93,两组PFS比较差异有统计学意义(P<0.05),见图1。
2.3不良反应情况 观察组轻-中度高血压发生13例,其中重度高血压发生4例,均通过口服降压药予以缓解,轻度蛋白尿发生8例,中-重度蛋白尿2例,观察组和对照组高血压、蛋白尿发生率比较差异有统计学意义(P<0.05)。观察组发生手足综合征17例,其中重度4例;出血包括口腔、鼻腔及皮肤黏膜出血共4例;轻-中度粒细胞减少11例,重度粒细胞减少约4例;转氨酶轻度升高5例;胃肠道反应轻-中度约12例,重度5例。以上不良反应发生率观察组和对照组比较差异无统计学意义(P>0.05)。见表3。
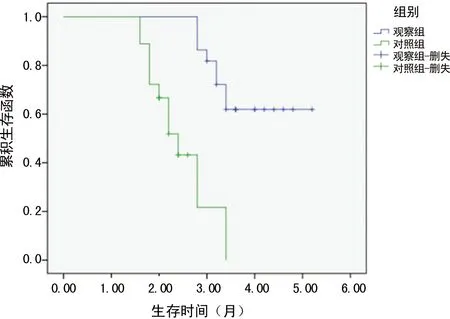
图1 生存曲线分析
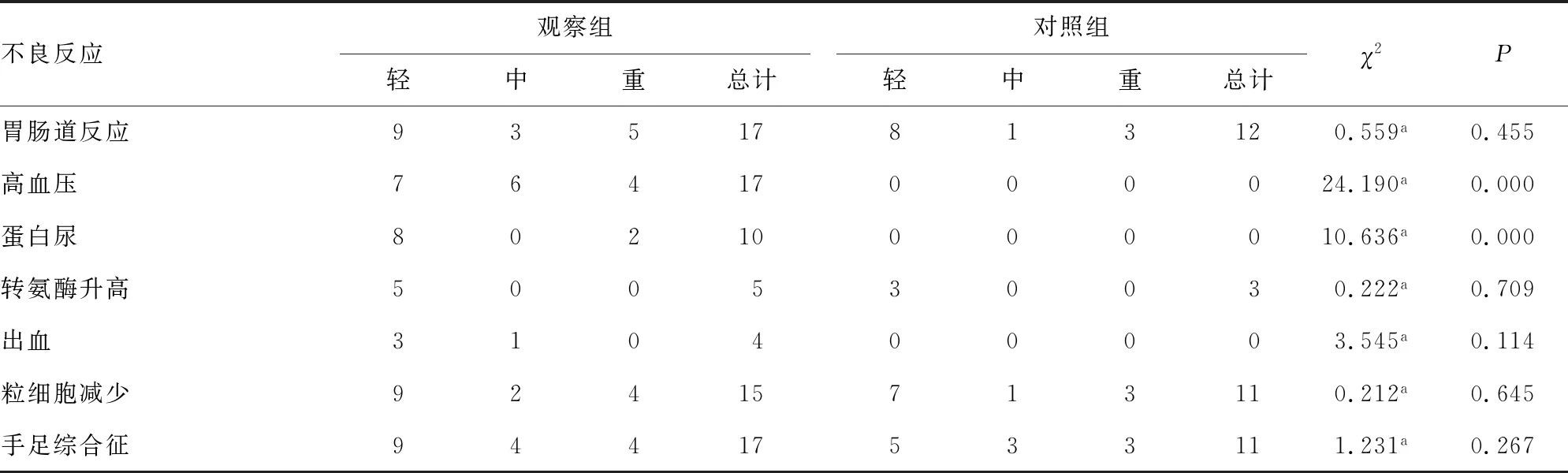
表3 两组患者不良反应情况(n)
a:Fisher精确检验法
3 讨 论
美国2017年统计转移性乳腺癌5年生存率为26%[3]。靶向治疗是继手术、化疗、放疗后的另一重要肿瘤治疗方式。对于乳腺癌Her-2阳性患者,曲妥珠单抗已取得了巨大的成功,在各种版本指南中均予以Ⅰ类推荐,其明显降低了复发的风险并延长了生存期,已经成为标准的治疗方式。在晚期乳腺癌的治疗中血管内皮生长因子-A(VEGF-A)抑制剂贝伐单抗可明显延长患者PFS,但对于患者总体生存期并无明显延长。新生血管在肿瘤的形成和转移中具有重要的作用,阿帕替尼是一种小分子受体拮抗剂,其作用机制目前主要为特异性作用于血管内皮生长因子受体2(VEGFR-2),有潜在的抗血管生成和抗肿瘤的作用[4]。阿帕替尼是一种广谱口服抗肿瘤药物,其在胃癌[5]、肝癌[6]及肺癌[7]治疗中均取得了良好的效果。李旭等[8]在研究阿帕替尼对于乳腺癌MDA-MB-231细胞抑制作用中发现阿帕替尼不仅可抑制肿瘤新生血管的形成,还可以诱导肿瘤细胞的凋亡和直接抑制肿瘤细胞的生长。安改丽等[9]研究发现阿帕替尼联合5-氟尿嘧啶(5-FU)较单用-FU,可使乳腺癌MCF-7细胞凋亡明显增加,且其抗肿瘤活性增强。本实验研究中发现阿帕替尼联合卡培他滨应用可明显提高晚期乳腺癌的治疗效果。观察组和对照组均无CR病例,但观察组22例患者中有9例患者达到PR,8例患者达到SD。对照组PR 2例,6例SD,观察组ORR为40.9%,对照组为11.1%,观察组DCR为77.3%,对照组为44.4%,两者组间差异均有统计学意义(P<0.05),表明阿帕替尼联合卡培他滨明显优于单独卡培他滨治疗。两组分子分型中比较,Lumina型观察组ORR为43.8%,对照组为16.7%,Her-2阳性型观察组ORR为25.0%,对照组为0,三阴性乳腺癌观察组ORR为50.0%,对照组为0;Lumina型观察组DCR为75.0%,对照组16.7%,Her-2阳性型观察组DCR为75.0%,对照组为100%,三阴性观察组DCR为50.0%,对照组为100%,考虑与Her-2阳性及三阴性病例数偏少有关。两组比较差异有均有统计意义(P<0.05),阿帕替尼联合卡培他滨明显优于单独卡培他滨组。两组生存分析研究采用Kaplan-Meier法发现观察组中位PFS为4.69个月,95%CI:3.44~5.76,对照组中位PFS为2.11个月,95%CI:1.29~2.93,根据生存曲线发现观察组PFS明显优于对照组。HU等[10]研究阿帕替尼治疗非三阴性乳腺癌PFS为4.0个月,三阴性乳腺癌PFS为3.3个月[11],与本研究结论相似。除高血压和蛋白尿外,其余差异无统计学意义(P>0.05),说明阿帕替尼联合卡培他滨治疗晚期乳腺癌是安全的,其不良反应是可控的。
阿帕替尼作为国产口服广谱靶向药物具有安全性高、治疗效果良好[12-15],尤其对于晚期多线治疗失败的乳腺癌患者是一种非常有效的治疗选择,其达到的效果是令人鼓舞的,当然因研究病例数偏少,随访时间较短,故仍需进一步研究。
