线粒体肌病的临床诊治现状和研究进展*
2019-09-14宋腾腾
宋腾腾, 李 倩
(皖南医学院弋矶山医院全科医学科/急诊内科,安徽 芜湖 241001)
1962年,Luft等首先报道了一位衰弱、极度易疲劳和易出汗的成年女性,其生化检查显示线粒体出现明显的氧化-磷酸化脱耦联反应,从而提出了线粒体肌病(mitochondrial myopathy,MM)的概念。近年来,随着对MM认识的不断深入,该病也从广义的概括逐渐被精分为更具体的病变综合征。根据其临床表现主要分为线粒体心肌病(mitochondrial cardiomyopathy,MCM)和线粒体脑肌病(mitochondrial encephalomyopathies,ME),大部分患者往往因心脏和脑部不适首先就诊于心内科和神经内科,也有部分患者因眼部及胃肠不适就诊于眼科和消化内科。为了加强临床医生对MM的认识,避免对其漏诊及误诊,并给予患者准确的诊断及有效的治疗,本篇将从MCM和ME常见表型的分子遗传学致病角度,对其临床诊断和治疗作一综述。
1 MM的分子遗传学发病机制
1.1MCM的相关发病机制MCM是MM中的一种常见表型,其临床表现具有多样性和异质性,其中最常见的症状是肥厚型心肌病(hypertrophic cardiomyopathy,HCM)、扩张型心肌病(dilated cardiomyopathy,DCM)、左室心肌致密化不全心肌病(left ventricular noncompaction cardiomopaction,LVNC)以及心律失常等。MCM的致病机制主要与mtDNA突变有关。其中mtDNA中的tRNA基因、rRNA基因以及某些结构基因突变均可引起细胞氧化磷酸化功能障碍,继而引发MCM。2017年诸葛瑞琪等针对MCM发病机制进行概述[1],指出tRNA突变是MCM最主要、最常见的致病因素。另有研究证实,tRNA点突变约占MCM所有致病机制的50%[2]。现已明确可直接导致MCM的tRNA突变有:tRNAleu、tRNAIle、tRNALys和tRNAGly。另外,MCM还与nDNA突变有关。一方面,nDNA负责编码大部分的呼吸链复合体亚基以及mtDNA复制和表达所需要的酶;另一方面,nDNA编码的产物可直接参与线粒体氧化呼吸链的构成。最后,MCM还可与过氧化物酶体增殖激活受体家族(peroxisome proliferator activated receptors,PPARs)及其共激活剂过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferators activated receptor γ coactivator-1α,PGC-1α)有关[3]。其中,PPARs作为配体激活的核转录因子,有PPARα、PPARβ/δ和PPARγ三种表型,参与协调机体的脂质及糖代谢过程。PGC-1α作为PPARs的重要协同因子,不仅参与协调脂质及糖代谢过程,而且在线粒体生物发生过程中,发挥主导因子的作用,参与协调nDNA和mtDNA编码的蛋白质表达[4]。见表1。
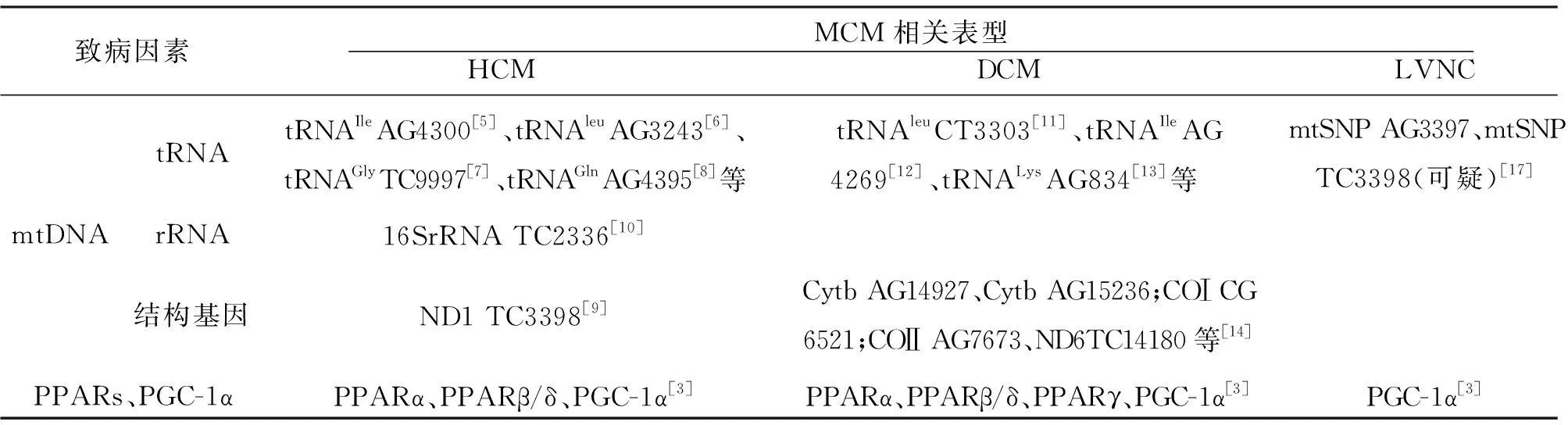
表1 MCM的分子遗传学发病机制
1.1.1HCMHCM是mtDNA突变损伤心肌的一种常见表型,与其相关的tRNA突变位点有tRNAIleAG4300[5]、tRNAleuAG3243[6]和tRNAGlyTC9997[7]等。2015年,李雨浓等[8]选取中国西南地区185例原发性心肌病患者(其中HCM 65例,家族性HCM 2例)与200例健康者进行病例对照研究。该试验筛选了7个最易发生突变的tRNA基因序列作为目的基因进行扩增,然后将扩增结果与正常线粒体基因库进行对比,结果发现HCM家系患者中存在tRNAGlnAG4395点突变,而其余非家系HCM患者及健康者均未发现该位点突变,于是推测tRNAGlnAG4395点突变可能是家族性HCM的致病因素。另外,2016年国外还发现了ND1结构基因上的TC3398点突变[9]。以上这些突变均可导致线粒体电子传递链的复合体亚基失活及呼吸链蛋白和心肌收缩蛋白合成障碍,最终引发心室肌肥厚。
1.1.2DCMDCM的病因比较复杂,但主要与遗传因素有关(25%~35%)。现已发现与DCM相关的tRNA点突变有:tRNAleuCT3303[11]、tRNAIleAG4269[12]、tRNALysAG834[13]等。同时多项研究指出,mtDNA的结构基因突变也可导致DCM。比如结构基因Cytb上的AG14927、AG15236、CA15452;COⅠ上的CG6521;COⅡ上的AG7673以及ND6上的TC14180等[14]。另外,mtDNA的缺失突变也与DCM具有相关性。以上这些突变均可引起ATP合成障碍,同时激发活性氧自由基产生,继而导致呼吸链相关酶失活及心肌细胞受损。2013年Cardena等报道了一例mtDNA新重复突变的DCM患者[15],在16018和16032之间检测出15bp的tRNA新重复序列,该重复序列位于tRNA脯氨酸基因(tRNAPro)上。报道还指出,该重复突变可破坏tRNAPro的稳定性,进而破坏心肌细胞的氧化应激平衡。
1.1.3LVNCLVNC表现为X-连锁遗传、母系遗传及常染色体显性遗传,其具体致病机制尚不十分清楚。对于LVNC的mtDNA突变,多项研究结果显示不同程度的差异。2013年,柳胜华等在LVNC患者的mtDNA全长序列中检测出227个异常变异[16],后经家系分析,这些异常突变并不是LVNC的致病因素。而Zhang Y等[17]对20例LVNC患者的线粒体基因组进行了Illumina平行测序,并进行MitoMaster分析,结果显示某些稀有线粒体单核苷酸多态性(rare mitochondrial single nucleotide polymorphisms ,mtSNP)(SNP是基因组中单个核苷酸的变异,可用于对某些复杂性状及疾病的遗传分析)比如mtSNP AG3397和mtSNP TC3398可导致线粒体功能受损而引发LVNC。其中,mtSNP TC3398不仅可引起结构基因ND1突变,也可导致呼吸链复合体Ⅰ出现异常,该现象在一般群体中极少见,故怀疑mtSNP TC3398与LVNC的发病有关。另外,LVNC与常染色体基因突变也有关。Klaassen S等曾利用基因测序技术和变性高效液相色谱分析对LVNC的常染色体基因进行检测,结果发现ACTC、TNNT2、MYH7等多处基因均有不同程度变异[18]。结合上述发现,关于LVNC的具体致病机制尚需进一步探究。
1.2ME的相关发病机制ME是由于mtDNA或nDNA缺陷而引起的一种遗传代谢性疾病,不仅可累及中枢神经系统,还可引起眼部、皮肤等多处异常。例如,累及中枢神经系统可表现为线粒体脑肌病伴高乳酸血症和卒中样发作综合征(mitochondrial encephalomyopathy, lactic acidosis and stroke-like episodes,MELAS)、线粒体神经胃肠型脑肌病 (mitochondrial neurogastrointestinal encephalomyopathy,MNGIE);累及眼部可表现为kears-sayre综合征(kears-sayre syndrome,KSS)、慢性进行性眼外肌瘫痪(chronic progressive external ophthalmoplegia,CPEO)等;以上这些疾病的致病基因均可表达为错义突变、缺失-插入突变等,其突变的结果是线粒体中tRNA或rRNA数量不足,进而导致蛋白质合成异常。见表2。
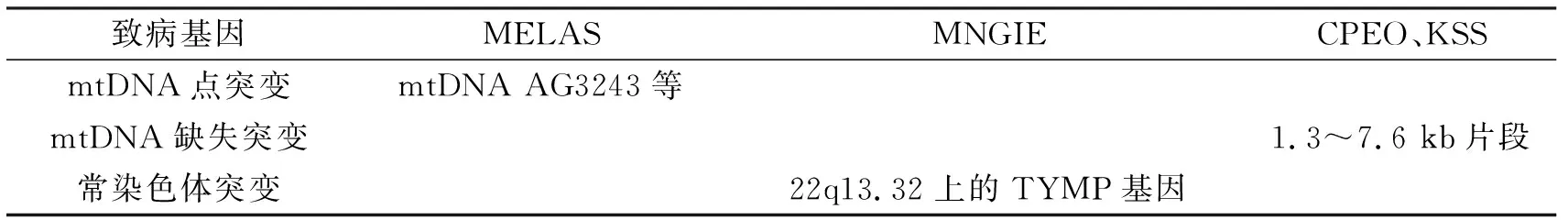
表2 ME的分子遗传学发病机制
1.2.1MELASMELAS的致病因素主要与mtDNA AG3243点突变有关,大约占所有致病基因的80%[19],另有10%的mtDNA TC3271突变以及5%的mtDNA AG3252突变等[20]多个突变位点。2013年郭章宝等搜集了6例MELAS患者,其中有2例因发现mtDNA AG3243点突变而得到确诊[21]。mtDNA AG3243突变引起线粒体翻译障碍和蛋白质合成受损,致使电子传递链的复合体亚基及线粒体相关酶合成异常。这些异常可造成细胞能量缺失,继而刺激血管平滑肌及内皮细胞增殖,最终因组织器官的血液灌注受损而致病。另外,这些异常也造成线粒体功能失调,各组织器官因不能得到代谢所需求的能量而衰竭。
1.2.2MNGIEMNGIE主要表现为常染色体隐性遗传,其致病因素与常染色体 22q13.32上的胸腺嘧啶核苷酸磷酸化酶基因(thymidine phosphorylase,TYMP)突变有关。TYMP突变使胸苷磷酸化酶(thymidine phosphorylase,TP)合成异常,导致胸苷和脱氧尿苷在血浆和组织中积聚过多而引发多系统病变。随着对MNGIE认识的不断深入,还发现了TYMP的新重复突变。2015年范剑剑等在MNGIE先证者的TYMP 9号外显子上发现c.1193-1216 dup纯合重复突变[22],该突变被认为是MNGIE的致病突变,为国内外首次报道。另外,MNGIE通常表现为周围神经病变及胃肠道不适,而该患者主要表现为眼外肌受累及视力下降,考虑其特殊表现与该纯合重复突变有关。研究还发现,c.1193-1216 dup纯合重复突变并不影响TYMP的基因转录,而是通过破坏TP酶结构稳定性而致病。
1.2.3CPEO、KSSCPEO和KSS具有明显的相关性,即CPEO如果同时合并视网膜色素变性和心肌传导阻滞即为KSS,二者均与mtDNA片段缺失有关,表型的差异主要取决于mtDNA缺失的部位和比例不同。另外,mtDNA突变的时间对其临床表现也有影响。随着年龄增加,mtDNA的缺失突变逐渐积累,故年老患者往往比年轻患者病情重。Lópezgallardo E等曾对313例CPEO和KSS患者的mtDNA突变进行荟萃分析[23],结果发现,mtDNA突变时间不仅可影响缺失突变的数量及部位,还可影响其组织表型。同时指出,大部分患者的mtDNA缺失突变范围在1.3~7.6 kb之间[24],其突变结果是丢失部分线粒体基因比如tRNA,进而导致mtDNA蛋白质合成异常。
目前发现的ME表型还有很多,但由于基因检测技术有限及临床可见病例较少,对其表型研究仍不够深入,关于其致病机制也缺乏有效证据。因此,研究人员应在既往探测MM致病技术的基础上,探究更加精细的检测技术,以利于未来充分认识ME。
2 MM的诊断
2.1基因检测目前基因检测技术尚不成熟,但已成为临床诊断MM的新趋势。2016年张哲等搜集190例MELAS患者,报道显示190例中有175例经基因检测而得到确诊[25]。多重连接探针扩增技术(multiplex probe amplification,MLPA)可用于筛查MM,MLPA法是Schouten等首次研发且灵敏度极高的基因测序技术[26]。2013年北京协和医院曾利用MLPA法对281例线粒体异常的病例进行检测[27],结果显示有38例出现mtDNA突变,其中包括mtDNA AG3243、AG8344、TG8993等点突变以及mtDNA的缺失突变,最终证实MLPA法可用于筛查MM。另外,聚合酶链反应扩增技术、直接核苷酸测序技术以及下一代测序技术(next generation sequencing,NGS)等均可用于诊断MM。其中,NGS是许多实验室用于测试遗传性疾病和肿瘤突变的方法,该技术以相对较低的成本对外显子组、转录组和基因组进行快速测序[28],可帮助临床医生充分认识MM。
2.2病理及影像检查选择中度受累的肌肉组织进行改良Gomori三色染色(mitochondria gomori tricolor,MGT)、细胞色素氧化酶(cytochrome oxidase,COX)染色以及琥珀酸脱氢酶(succinate dehydrogenase,SDH)染色等,以明确MM的线粒体功能状态。其中,COX及SDH是细胞有氧代谢的重要酶,属于线粒体的标志酶。COX可反应呼吸链复合体Ⅳ的状态(由mtDNA编码),用于评价线粒体电子传导酶异常。SDH可代表呼吸链复合体Ⅱ的状态(由nDNA编码),用于评估细胞内的呼吸功能情况[29-30]。2015年高美钦等使用改良Seligman的二氨基联苯胺法和Nachlas的硝基盐四唑法对MM的COX及SDH进行检测[31],结果显示:肌纤维大小不一,COX未见棕黄色(阴性),SDH可见蓝色颗粒增加(阳性)。该结果表明mtDNA突变可对COX产生影响,而对SDH无影响。该试验采用双重染色技术,有助于对线粒体功能障碍的细胞进行定位,并对诊断倾向于MM的病例提供参考价值。另外,影像学作为临床常规检查,对明确MM也发挥良好的诊断作用。2016年王柳仙等[32]收集了16例MELAS患者,指出急性期的MRI表现为脑组织轻度肿胀,慢性期表现为脑萎缩,颞叶、枕叶、顶叶等多处脑叶可见楔形或斑片状脑梗死样病灶。最新报道指出[33],ME患者磁共振波谱成像 (1H-magnetic resonance spectronscopy,1H-MRS)的乳酸峰在脑脊液区成像价值显著高于脑内病灶区。1H-MRS在一般情况下主要对脑内病灶区进行勘察,但当脑组织出现代谢异常时,乳酸等代谢废物会在脑脊液区堆积,进而使脑脊液区乳酸峰成像呈现出比病变区更具特异性的信号。因此,临床医生应对这两种情况进行鉴别,以避免发生误诊。
3 线粒体肌病的治疗
绝大多数的MM缺乏确切有效的治疗,主要集中于对症治疗。(1)药物治疗:可采用“线粒体鸡尾酒疗法”即给予多种能量合剂如三磷酸腺苷、多种辅酶合剂如辅酶Q10以及补充多种维生素如维生素C、E等。其中,辅酶Q10可清除自由基对细胞的损伤,还可参与线粒体氧化磷酸化反应,为细胞提供能量。有研究指出,“改良线粒体鸡尾酒疗法”即在传统鸡尾酒疗法基础上添加丁苯酞可明显缓解MM的脑部症状[34]。另外,新型抗癫痫药如左乙拉西坦等可控制肌肉阵挛而减缓MM进展。牛磺酸可一定程度上减少MM患者的氧耗量以预防卒中发作[35]。(2)饮食治疗:应避免空腹,提倡高脂低糖饮食即生酮饮食。通过脂肪酸代谢产生ATP,为MM患者提供能量。(3)手术治疗:比如kears-sayre综合征,针对其心脏传导阻滞,通过植入心脏起搏器来缓解症状。(4)中医治疗:从肝论治法、补肝强筋法、活血祛风法、针药联合法等均可减缓MM短期进展。总之,对MM的对症治疗应遵循三个原则:改善线粒体能量障碍、清除体内代谢废物以及避免服用损害线粒体功能的物质。
药物治疗仅在一定程度上缓解症状,结合MM的致病机制特点,我们应试图从病因上寻找减轻患者病痛的新思路。由于MM的临床病例较少,又不易做出明确诊断,往往给探究此病的临床医生及科研人员带来许多困难。为攻克本病,业内人士可尝试利用基因疗法来减少致病基因的突变比例。比如植入异源性基因[36]、同种异体骨髓移植以及造血干细胞基因疗法[37]等。另外,建立合适的体外MM模型,可辅助探究病因并为其治疗寻找新突破点。2015年国外学者首次对该思路进行实践,Kodaira M等试图利用原代MELAS成纤维细胞转变为MELAS特异性诱导多能干细胞(specific induced pluripotent stem cells iPSCs),并尝试建立体外MELAS-iPSCs模型。该试验通过对体内外mtDNA AG3243突变异质性对比分析得出,MELAS-iPSC可以作为MELAS的模型,并为未来治疗MM提供有效的药物筛选方法[38]。之后,Yang Y等利用线粒体靶向转录激活因子样效应核酸酶(mitochondriatargeted transcriptional activatorlike effector nuclease,mitoTALENs)成功消除了MELAS-iPSCs模型中的mtDNA AG3243突变[39]。该研究表明,线粒体靶向核酸内切酶可靶向破坏mtDNA的突变位点及诱导异质性移位,为今后治疗MM提供新的研究方向。
4 结语及展望
对MM的诊断可采用多种方法,结合临床症状及影像学改变,积极采用肌肉病理活检及基因检测等手段,对患者进行早期诊断、早期治疗。目前对MM的治疗仍处于探索阶段,除了对症治疗外,应积极探究病因治疗,并充分利用最新技术对MM实施诊治。医学界人士可借鉴建立体外MELAS-iPSCs模型的新思路,充分利用靶向治疗对mtDNA的突变位点进行攻击,或许可为未来治疗MM提供新的方式。另外,种系间植入、促进肌肉再生以及选择性针对呼吸链治疗等理论方法,也可为治疗MM创建新思路。
尽管对MM的研究还不够深入,但随着医学技术的不断发展,越来越多的诊断和治疗方法被发掘。临床医生可结合最新指南对MM进行诊断,并采取确切有效的治疗方法对其进行干预。学者们应结合前人经验进行回顾性总结,并积极进行前瞻性研究,进而全方位的认识MM。
