MitoQ对模拟高原缺氧大鼠脑组织的保护作用
2019-09-13景临林高迎春李玉芳马慧萍
蒙 萍,景临林,何 蕾,高迎春,李玉芳,马慧萍
(1. 中国人民解放军联勤保障部队第九四○医院药剂科全军高原环境损伤防治重点实验室;2. 甘肃省妇幼保健院麻醉手术科,甘肃 兰州 730050)
高原低压性缺氧是人类在高海拔区域面临的重要挑战,是引起急性高原反应和高原脑水肿、高原肺水肿等高原性疾病的首要因素[1]。缺氧引起氧化应激,活性氧(reactive oxygen species,ROS)大量产生,造成机体过氧化损伤、线粒体功能障碍等[2]。多年来,研究人员致力于抗氧化剂的研究,认为抗氧化剂能够清除机体过多产生的ROS,缓解氧化应激损伤[3]。然而,大量的ROS主要产生于线粒体,基于线粒体的双层膜结构,普通的抗氧化剂并不能穿过其双层膜到达线粒体内部发挥作用,使得抗氧化剂的效果并未能得到最大程度的发挥,人们开始研究线粒体靶向抗氧化剂来治疗相关疾病[4]。其中一个很好的方法是结合阳离子脂质体如三苯基膦,磷的衍生物已经被广泛的用于靶向药物的设计,使药物有靶向线粒体内膜的特性。线粒体靶向抗氧化剂MitoQ(Mitoquinol mesylate)是内源性抗氧化剂辅酶Q10与三苯基磷共价结合得到的一个化合物,是一种具有线粒体靶向特性的抗氧化剂,已经被广泛用于多种疾病的预防和治疗[5]。有研究显示,MitoQ对神经退行性疾病的细胞和动物模型都有神经保护作用,能明显抑制6-羟基多巴胺诱导的SH-SY5Y细胞帕金森病(Parkinson′s disease,PD)模型中Drp1向线粒体迁移,阻碍线粒体分裂机制的激活,同时抑制促凋亡蛋白Bax转位到线粒体,抑制PD的发生[5]。但MitoQ对高原缺氧损伤防治方面尚无相关研究,因此,本研究采用大型低压氧舱模拟海拔8 000 m高原缺氧环境,通过脑组织病理切片观察,测定大鼠脑组织氧化应激水平、线粒体呼吸链复合物活性和凋亡蛋白的表达,研究MitoQ对高原缺氧大鼠脑组织的保护作用。
1 材料与方法
1.1 材料
1.1.2药物与试剂 MitoQ为本课题组景临林博士合成惠赠;丙二醛(malondialdehyde,MDA)测定试剂盒(批号:20150417)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(批号:20150421)、线粒体呼吸链复合物Ⅰ测定试剂盒(批号:20151020)、线粒体呼吸链复合物Ⅱ测定试剂盒(批号:20150513)、线粒体呼吸链复合物Ⅳ测定试剂盒(批号:20150513)、Ga2+测定试剂盒(批号:2014.12.20),均购自南京建成生物工程研究所;膜电位测定试剂盒(碧云天,批号:C2006);抗体Bax(货号:ab32503)、细胞色素C (cytochrome C,Cyt C)(货号:ab133504),均购自Abcam公司;caspase-3抗体(Cell Signaling,批号:0071);β-actin抗体(中杉金桥,批号:150120)。
1.1.3仪器 大型低压氧舱(贵州风雷军械有限公司);低温高速离心机(德国Sigma公司);MULTISKAN MK3型酶标仪(上海雷勃分析仪器有限公司);免疫印迹分析仪(Bio-Rad公司)。
1.2 方法
1.2.1MitoQ对常压密闭缺氧小鼠的保护作用 取♂BALB/c小鼠,共18只,随机分为6组,每组3只。分别腹腔注射不同剂量的MitoQ(1、3、5、10、20 mg·kg-1),对照组腹腔注射等剂量的生理盐水,给药0.5 h后,依次将小鼠放入250 mL广口瓶中(为了避免小鼠因为自呼吸产生的CO2而酸中毒产生多因素死亡原因,加入了5 g钠石灰,用来吸收CO2[6]),瓶口涂抹适量的凡士林并拧紧瓶塞,立即开始计时至其死亡,记录存活时间,计算存活时间延长率。
1.2.2模拟海拔8 000 m高原缺氧实验 将60只♂Wistar大鼠随机分成5组,包括正常组、缺氧12 h模型组、缺氧12 h MitoQ组、缺氧24 h模型组、缺氧24 h MitoQ组,每组12只。按小鼠常压密闭缺氧实验得到的MitoQ最佳给药剂量,换算成大鼠给药剂量为3.5 mg·kg-1,将大鼠分别称重后腹腔注射给药,MitoQ为每天早上新配,连续给药3 d。d 3早上给完药后0.5 h,放入大型低压低氧模拟舱。将大鼠按组别放入实验舱,关闭实验舱舱门,以20 m·s-1的速度升高至海拔8 000 m,缺氧12 h后,实验人员进入操作间,关闭操作间舱门,以2 m·s-1的速度升高海拔至3 500 m,同时将实验舱海拔降低至3 500 m,打开实验舱舱门,实验人员进入实验舱后迅速取出缺氧12 h组大鼠,实验舱复升压至海拔8 000 m,实验人员在海拔3 500 m操作间麻醉大鼠解剖采集大鼠脑组织。缺氧24 h组与缺氧12 h组操作步骤一致,正常组大鼠正常饲养24 h后麻醉取材。
1.2.3HE染色 将大鼠解剖,取出脑组织皮层,漂洗,纵切厚1 mm切片,放入含有4%甲醛的固定液中。固定1周后,制样与显微镜观察、拍片。
1.2.4氧化应激相关指标的测定 按脑组织(重量) ∶生理盐水(体积)=1 ∶9的比例,使用电动匀浆器冰浴制备10%脑组织匀浆,按照MDA、SOD试剂盒说明书测定。
首先,高中化学教职人员必须要准确有效地了解每一位学生的实际学习情况,然后依照学生的综合素质对其进行准确的划分,同时在对学生进行层次划分的过程当中,必须要时刻关注学生的心理变化情况,准确地告知学生将其进行小组划分对于学生自身化学水平提升的重要性。
1.2.5线粒体功能与能量代谢相关指标的测定
1.2.5.1大鼠脑组织Ga2+含量的测定 制备10%脑组织匀浆,按照Ga2+试剂盒说明书进行测定。
1.2.5.2大鼠脑组织线粒体的提取 参考文献[7],解剖取出大鼠脑组织,彻底漂洗干净至无血迹,称重0.1 g,转移至玻璃匀浆器中,按如下步骤提取线粒体:① 加入1 mL大鼠脑线粒体分离介质,匀浆破碎组织块释放出细胞器;② 将匀浆好的样品转移至2 mL离心管内,1 000×g离心10 min;③ 将上清转移至2 mL离心管,10 000×g离心10 min;④ 用棉签将液面以及附着在管壁的油脂擦拭干净,弃上清;⑤ 用线粒体分离介质重悬沉淀,10 000×g离心10 min;⑥ 弃上清,用线粒体分离介质重悬沉淀,分装,-80 ℃保存。
1.2.5.3大鼠脑线粒体膜电位的测定 将线粒体一定量稀释,先在96孔荧光酶标板中加入180 μL JC-1工作液,之后在测定孔加入20 μL待测样品,对照孔每孔加入20 μL PBS,充分混匀,37 ℃孵育20 min,使用荧光酶标仪,激发波长488 nm,发射波长530 nm(绿光)、585 nm(红光)。结果以红光荧光强度/绿光荧光强度表示。
1.2.5.4大鼠脑线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ的测定 使用南京建成线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ测定试剂盒,按照说明书进行测定。
1.2.6蛋白免疫印迹分析 称取一定质量的脑组织,加入9倍体积的蛋白质裂解液,中速冰水浴电动匀浆1 min后,冰上裂解45 min,每间隔5 min涡旋5 s,随后12 000 r·min-1离心10 min,吸取上清20 μL用于测定蛋白浓度。定量转移剩余上清于新的离心管中,按比例加入蛋白质上样缓冲液,混匀,变性,-20 ℃冰箱保存。12%的分离胶,5%的浓缩胶,上样50 μg,浓缩胶80 V,分离胶110 V。TBST洗膜后湿法转膜,110 V转膜1.5 h,5%脱脂奶粉封闭2 h。一抗Bax(1 ∶2 000)、caspase-3(1 ∶1 000)、Cyt C(1 ∶2 000)、β-actin(1 ∶1 000)4 ℃孵育过夜后取出,1×TBST洗膜4次,每次10 min;二抗孵育2 h,再次洗膜4次,每次10 min,ECL超敏发光液A液 ∶B液=1 ∶1配制发光液,曝光仪曝光。
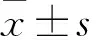
2 结果
2.1 MitoQ对常压密闭缺氧小鼠的保护作用MitoQ对常压密闭缺氧小鼠存活率的影响见Tab 1,给予不同剂量MitoQ后,与缺氧模型组比较,低剂量组并未显现出明显的保护作用,MitoQ(5、10、20 mg·kg-1)明显延长了小鼠的存活时间,小鼠存活率分别提高了47.69%、49.08%和49.05%。由结果可以看出,大于5 mg·kg-1后随着MitoQ给药剂量的增加,其对常压密闭缺氧小鼠的存活率并没有明显变化,因此,最佳剂量选择为5 mg·kg-1。
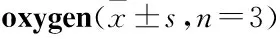
Tab 1 Effect of MitoQ on survival rate of mice under conditionof atmospheric airtight which lack of
#P<0.05,##P<0.01vsControl
2.2 MitoQ对缺氧大鼠脑组织显微结构的影响如Fig 1所示,正常组大鼠脑组织结构致密,缺氧12 h组细胞间隙增宽,空泡化,血管明显水肿,缺氧24 h组变化更为明显;与模型组相比较,12 h MitoQ组与24 h MitoQ组细胞间隙均减小,血管水肿程度减弱,提示MitoQ对缺氧大鼠脑组织发挥保护作用。
2.3 MitoQ对缺氧大鼠脑组织MDA和SOD的影响SOD被认为是阻止机体免受ROS攻击的首要的防御酶。Tab 2结果显示,缺氧12 h和24 h均能明显提高缺氧大鼠脑组织中MDA水平,对机体产生损伤;MitoQ能够降低MDA的含量,在24 h时降低作用差异具有显著性(P<0.05)。缺氧能够明显降低大鼠脑组织中SOD活力,降低机体对O2-·等氧自由基的清除能力;MitoQ能够在一定程度上提高缺氧大鼠脑组织SOD的活性,增加机体对ROS的清除能力。
2.4 MitoQ对缺氧大鼠脑组织Ga2+的影响如Fig 2所示,与正常组比较,缺氧增加了大鼠脑组织Ga2+含量,引起机体钙超载,在缺氧12 h时差异具有显著性(P<0.05);给予MitoQ能够明显降低缺氧12 h大鼠脑组织Ga2+含量。缺氧24 h组大鼠脑组织Ga2+含量与正常组相比差异无显著性。
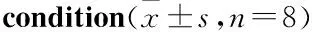
Tab 2 Effect of MitoQ on activity of MDA, SODon rats under hypoxia
**P<0.01vsnormal;#P<0.05vshypoxia
2.5 MitoQ对缺氧大鼠脑组织线粒体膜电位的影响如Fig 3所示,与正常组相比,缺氧能够明显降低线粒体膜电位,对线粒体功能造成损伤;给予MitoQ后,缺氧12 h组大鼠脑组织线粒体膜电位明显升高(P<0.05),即MitoQ对缺氧大鼠脑线粒体功能具有一定的保护作用。缺氧24 h MitoQ组与模型组相比无明显变化(P>0.05)。
2.6 MitoQ对缺氧大鼠脑线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ的影响Tab 3结果显示,缺氧12 h和24 h均使得大鼠脑组织线粒体呼吸链复合物Ⅰ、Ⅱ活性明显下降(P<0.01),线粒体呼吸链复合物Ⅳ活性有一定程度的下降;在缺氧24 h时,MitoQ对大鼠脑组织线粒体呼吸链复合物Ⅰ活性有一定程度提高,但差异无显著性,能够明显提高大鼠脑组织线粒体呼吸链复合物Ⅱ的活性(P<0.01)。
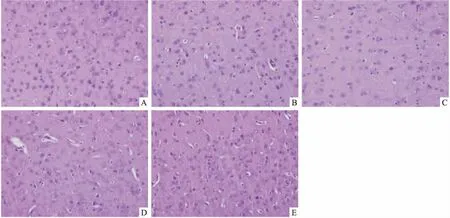
Fig1EffectofMitoQonbraintissuesofhypoxicratsbyHEstaining(×200) A: Normal; B:Hypoxia 12 h;C: Hypoxia+MitoQ 12 h; D: Hypoxia 24 h; E: Hypoxia+MitoQ 24 h.
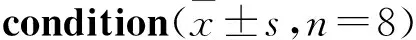
Tab 3 Effect of MitoQ on activity of mitochondrial respiratory chain complexes Ⅰ, Ⅱ, Ⅳon rats under hypoxia
*P<0.05,**P<0.01vsnormal;#P<0.05,##P<0.01vshypoxia
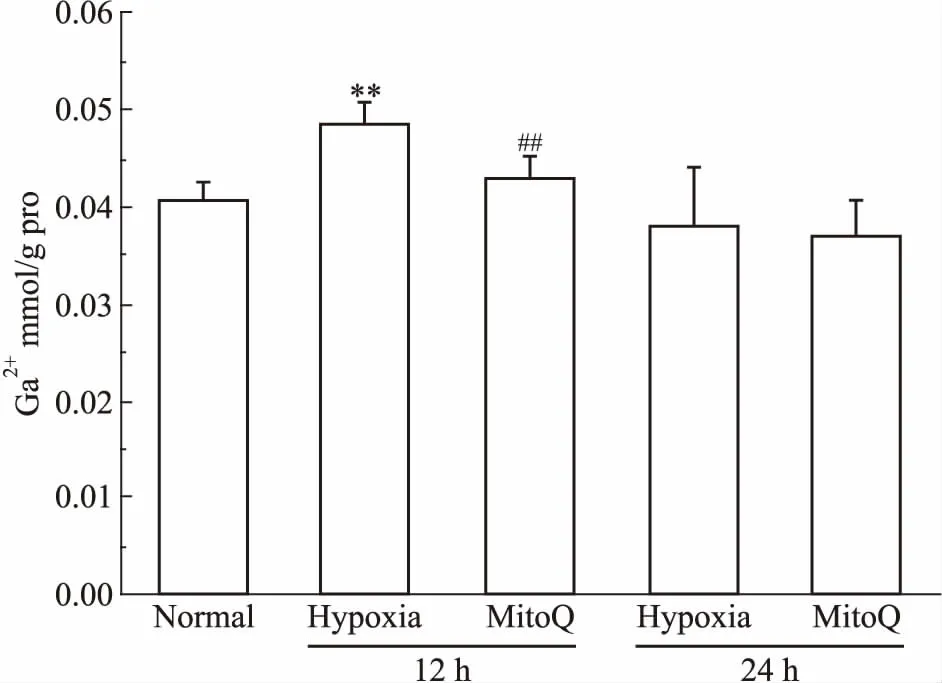
Fig 2 Effect of MitoQ on Ga2+ content inbrain tissues of hypoxic
**P<0.01vsnormal;##P<0.01vshypoxia
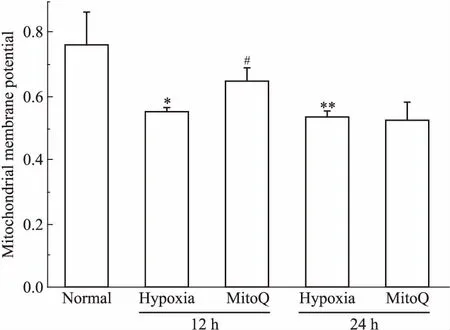
Fig 3 Effect of MitoQ on mitochondrial membrane potential inbrain tissues of hypoxic
*P<0.05,**P<0.01vsnormal;#P<0.05vshypoxia
2.7 MitoQ对缺氧大鼠脑组织凋亡蛋白的影响如Fig 4所示,缺氧24 h组Cyt C、caspase-3、Bax表达较正常组明显提高(P<0.01);MitoQ组Cyt C、caspase-3、Bax表达较模型组明显下调(P<0.05,P<0.01)。提示缺氧促进大鼠脑组织细胞凋亡,MitoQ能够抑制缺氧条件下大鼠脑组织凋亡蛋白的表达,对缺氧大鼠发挥保护作用。
Fig 4 Effect of MitoQ on expression of Cyt C, caspase-3and Bax in brain tissues of hypoxic
**P<0.01vsnormal;#P<0.05,##P<0.01vshypoxia
3 讨论
高原缺氧使初上高原的人产生各种不适症状,限制了高原地区的发展,严重影响了部队高原作战能力。低压性缺氧是产生高原病的主要因素,造成心功能降低、微循环障碍、氧自由基大量产生,使得机体脂质过氧化水平升高,能量代谢和线粒体呼吸功能障碍,ATP合成减少,诱发一系列细胞凋亡反应,促进机体凋亡蛋白表达,引起细胞凋亡[8-9]。线粒体是人体许多重要的代谢发生的部位,通过氧化磷酸化合成细胞内绝大多数的ATP,三羧酸循环氧化反应的中间产物提供H+和电子进入电子传递链,最终提供能量将ADP磷酸化形成ATP,维持细胞活力。
既往研究显示,MitoQ作为线粒体靶向抗氧化剂,对神经退行性疾病、代谢综合征、多发性硬化、缺血/再灌注损伤、脓毒症等与机体抗氧化系统失衡、氧化应激、线粒体功能障碍相关的疾病,均具有一定的防治作用。在PD模型中,能够明显上调Mfn2蛋白和mRNA水平,并以Mfn2依赖的方式促进线粒体融合,还可以稳定6-OHDA存在下线粒体的形态和功能,抑制ROS的形成,改善线粒体破碎和细胞凋亡[10-11]。此外,MitoQ能够降低高脂饮食小鼠线粒体ROS水平,对动物模型代谢综合征具有一定作用,并且能明显抑制自身免疫性脑脊髓炎模型小鼠的神经炎症,通过抑制炎性细胞因子IL-6、趋化因子及脱髓鞘作用,增加对轴突的保护作用。在脓毒症模型中,MitoQ通过减少ROS和过氧亚硝酸盐的形成,维持脓毒症条件下的线粒体膜电位[5]。
本研究显示,MitoQ明显降低缺氧条件下胞内Ga2+含量,缓解缺氧引起的线粒体膜电位的降低,提高缺氧24 h大鼠脑组织线粒体呼吸链复合物Ⅱ的活性,改善缺氧引起的大鼠线粒体功能障碍。并且明显降低Cyt C、caspase-3和Bax的表达,抑制缺氧条件下凋亡的发生。
综上所述,大型低压氧舱模拟海拔8 000 m高原缺氧环境,引起大鼠脑组织氧化应激,线粒体功能障碍。线粒体靶向抗氧化剂MitoQ可以明显降低缺氧条件下大鼠脑组织脂质过氧化程度,提高抗氧化酶活性,从而提高缺氧大鼠抗氧化水平。同时,MitoQ能够提高线粒体呼吸链复合物活性,维持其线粒体功能,对缺氧大鼠发挥保护作用。
