特应性皮炎患儿血清中microRNAs芯片的生物信息学分析
2019-09-13韩悦姚煦
韩 悦 姚 煦
特应性皮炎(Atopic dermatitis,AD)是一种常见的慢性复发性炎症性过敏性皮肤病,好发于儿童,可伴有过敏性鼻炎、哮喘和食物过敏,临床表现为剧烈瘙痒,严重影响患儿的生活质量和身心发育,是皮肤科最受关注的疾病之一[1,2]。近年来AD的发病率呈迅速升高的趋势,有报道显示我国多城市儿童AD发病率为12.94%[3]。然而目前AD发病机制尚未完全揭示,因此,积极探索AD的发病机制具有十分重要的意义。随着科技的发展,生物信息学已成为预测基因功能、调控信号通路最重要的手段之一[4],如果能应用生物信息技术手段预测AD患儿血清中的某些基因功能和参与的信号通路,那么对辅助AD的临床诊治具有非常重要的科学意义。
microRNAs(miRNA)是一类真核生物体内分泌的长度为21~25个核苷酸的非编码单链微小RNA,它能与mRNA转录因子结合并参与基因的调控,是重要的基因表达调控因子[5,6]。所以,我们可以通过分析AD患儿外周血中miRNA芯片信息并通过生信学软件和数据库预测其靶基因的功能和调控的信号通路来研究其对AD诊治的意义。故本文拟基于高通量测序技术利用生物信息学方法分析miRNA在儿童AD中的表达差异及潜在的应用价值,为临床寻找潜在的药物靶点提供理论依据。
1 资料与研究方法
1.1 芯片信息 从NCBI(美国国立生物技术信息中心,https://www.ncbi.nlm.nih.gov/)公共数据平台GEO(Gene Expression Omnibus)数据库中下载的GSE 62404数据集,为人类芯片miRNAs表达谱数据,芯片平台是GPL 9460(Applied Biosystems Human TaqMan Low Density Array,TLDA, v1.0),该芯片数据包括8例AD患儿和8名健康儿童血清中miRNAs表达谱,本研究选择全部的芯片信息来进行下一步的分析。
1.2 数据归一化及差异miRNA分析 用R语言软件包对芯片表达矩阵进一步预处理及差异miRNA分析。利用R 3.4.1软件edgeR包运用RMA 算法对下载数据进行背景校正、标准化,即将测序数据归一化。利用R gplots包绘制热图,计算差异表达miRNA的筛选符合以下条件:①P<0.05 ;②|logFC|≥2。结合文献选取最具差异表达的miRNA-126进行后续分析,并利用miRBase数据库(http://www.mirbase.org/)分析其序列及保守性。
1.3 靶基因的预测 利用mirTarbase数据库(http://mirtarbase.mbc.nctu.edu.tw/php/index.php)来预测miRNA-126靶基因,并统计相关靶基因总数。
1.4 靶基因的GO功能注释及KEGG信号通路富集 利用cytoscape3.5.1及其插件ClueGO、CluePedia对靶基因进行GO(gene ontology)功能注释和KEGG(Kyoto Encyclopedia of Genes and Genomes)信号通路富集。GO注释功能富集主要有:生物学过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cellular component,CC)。绘制KEGG网络互作图,以明确靶基因参与调控的信号通路之间的关系。对富集的GO注释和KEGG信号通路注释做统计学分析通过计算差异P值,筛选出P<0.05差异的GO功能注释和KEGG信号通路富集。
1.5 标本采集 选取2017年5月至2018年5月期间我院收治的AD患儿与正常健康儿童各20名为实验对象,分别采集清晨空腹外周血10 mL。本次研究均获受试者知情并签署知情同意书。纳入标准:符合AD的诊断标准,年龄小于18岁,性别不限,心、肝、肾功能良好,无其他严重疾病者;排除标准:伴有其他皮肤疾病者、心脑血管疾病、酒精药物滥用史、精神疾病史等。所采集的标本2000 rpm离心取上清后均于-80℃冰箱中保存备用。
1.6 试剂盒提取纯化血清总RNA 使用miRNeasy Mini Kit试剂盒(QIAGEN,德国)提取标本中miRNA,操作严格遵照试剂盒内说明书进行:将1mL RNA-Solv加入血清中,静置3 min后加入200 μL氯仿冰中孵育10 min,4℃离心12000 g 15 min,将上清液加入一半体积乙醇,将硅胶柱套入集液管,吸取混合液700 μL加到HiBind RNA Mini column,离心10000 g 30~60 s,流出液放入新收集管中,加入0.9倍体积的乙醇,将MicroElute RNA column放入新收集管中,加入硅胶柱,离心10000 g 30~60 s,弃去滤液,把硅胶柱套回收集管中,加入500 μL RWB Wash Buffer,重复上述过程一次,最后用20 μL的DEPC水洗脱miRNA。将纯化后的RNA于-80℃中保存备用。
1.7 荧光定量PCR检测miRNA 采用HiScript® II Reverse Transcriptase试剂盒(南京诺唯赞生物科技有限公司)将提取出来的总RNA逆转录合成cDNA,反应体系为20 μL,反应条件为42℃ 3 min,60℃ 15 min,85℃ 5 min。以cDNA为模板,利用ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司)进行PCR扩增,反应体系为20 μL,反应条件为95℃ 2 min,1循环;60℃ 5 s,95℃ 10 s,40 个循环。以U6作为实验的内参基因,相对表达量以2-△△Ct形式表示,其中△CT=CT(miRNA)-CT(U6)。每孔共设副孔两个,重复三次。miRNA-126上游引物序列:5’- ACACTCCAGCTGGGCATTATTACTTTTGG-3’,下游引物序列:5’- CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCGCGTACC-3’;U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’。
1.8 统计学方法 文中实验结果数据在SPSS 20.0 软件中统计分析,统计图在Graghpad Prism 8软件中绘制和编辑加工,采用独立t检验比较AD患儿和健康对照组间均数差异,实验数据中计量资料以均数±标准差(mean±SD)形式表示,以P<0.05为差异有统计学意义。
2 结果
2.1 差异表达miRNAs筛选结果 通过对两组数据的差异表达miRNAs的筛选,共获得7个差异表达的miRNAs,其中上调miRNAs 2个,下调miRNAs 5个。图1是芯片间数据用RMA 法进行校正后的箱图。绘制两组血清中miRNA的表达谱热图,见图2。表1列出了AD患儿血清中对比正常儿童的差异表达的miRNAs。

图1 芯片间数据进行校正后的箱图

图2 芯片中两组血清的miRNAs表达
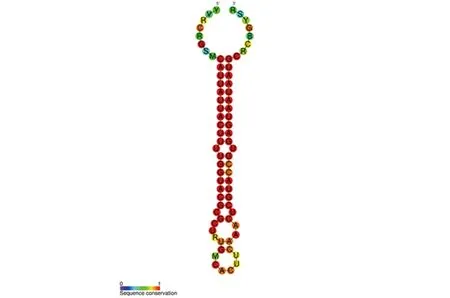
图3 miRNA-126序列及保守性
2.2 选取最具差异表达的miRNA并预测其靶基因 根据logFC值和P值并结合文献选取最具差异表达的miRNA-126进行后续生信学分析,并利用miRBase数据库分析其序列及保守性,序列为5’端 CAUUAUUACUUUUGGUACGCG 3’端,茎环结构的保守性低于序列,详见图3。利用mirTarbase数据库对miRNA-126的靶基因进行预测,结果见表2。
为了检验miRNA-126是否在实际中具有差异表达,我们筛选了本院收治的AD患儿与正常健康儿童各20例,其中AD组年龄为(16.18±9.57)岁,男/女比例为1.86;对照组年龄为(14.63±7.09)岁,男/女比例为1.22。采用q-PCR法检测两组血清中miRNA-126的表达水平。相对于对照组,AD组miRNA-126的表达水平显著降低(1.0±0.30 vs 0.46±0.19),两组间有明显的统计学差异(P<0.001),如图4。

表2 利用mirTarbase数据库分析miRNA-126靶基因(前12项)
2.3 GO功能注释结果 针对以上预测的靶基因,然后我们进行GO注释和KEGG通路富集分析。通过GO注释描述共得到11个分子功能注释信息、28个生物学过程注释信息,细胞组分注释信息缺如。分析显示miRNA-126预测靶基因集合富集在血管通透性的调节、RAC蛋白信号转导、内皮细胞增殖的调节、基质黏附依赖性细胞扩散、活化MAPKK活性、磷蛋白结合等生物学过程和分子功能中(P<0.05),见表3、表4。
2.4 KEGG 信号通路富集结果 在GO注释分类的基础上,利用已有生物通路数据,对基因集合中的12个基因进行生物通路富集分析。结果显示,在经典通路数据库KEGG中miRNA-126显著富集于FoxO信号通路、NF-κB信号通路、B细胞受体信号通路、VEGF信号通路等17个通路(P<0.05),见图5。

表3 miRNA-126靶基因进行GO功能富集(生物学过程)
注:表中所列基因于GO功能富集中P<0.001

表4 miRNA-126靶基因进行GO功能富集(分子功能)
注:表中所列基因于GO功能富集中P<0.001

图4 两组血清中miRNA-126的表达水平

图中红色字体代表靶基因,绿色及灰色字体代表靶基因参与的信号通路,圆形大小代表其权重,圆形直径越大,说明靶基因参与该信号通路越多
图5KEGG信号通路富集结果
3 讨论
特应性皮炎是迄今为止最常见的小儿过敏类皮肤病之一,具有一定的遗传易感性[7],目前其发病机制尚未清楚,涉及多个基因位点和多条信号通路。为明确AD的发病机制,我们应深入探索AD发生发展中调控的基因及其背后的分子机制,为找出新的药物治疗靶点提供一定的理论依据。近年来,世界上开展的人类基因组计划令高通量基因芯片技术广泛应用于疾病的miRNAs表达谱分析、基因克隆和寻找疾病特异分子标志物等[8,9]。为深入了解AD发生发展的分子机制,我们筛选了可作为AD诊断的关键miRNA并预测其靶基因,本研究利用生物信息学方法对GEO数据库下载的AD患儿血清和正常儿童血清中的生物芯片数据进行差异miRNAs分析、靶基因预测、功能聚类及信号通路富集,并利用q-PCR进行了实验验证。
经过AD患儿血清和正常儿童血清中miRNAs的差异比较,共筛选出7个差异表达miRNAs,其中上调miRNAs 2个:hsa-miR-590-5p、hsa-miR-106b;下调miRNAs 5个:hsa-let-7g、hsa-miR-126、hsa-miR-491-5p、hsa-miR-483-5p、hsa-miR-146a。研究显示,上调miRNA-590-5p可能以TGFβ1为靶点,促进软骨细胞凋亡和自噬,从而促进骨关节炎的发病机制[10];miRNA-106b参与多种细胞因子的分泌,如IL-10、IL-17、IL-23,可以干扰白塞病患儿外周血中Th17/Treg的平衡[11];基于二代测序技术发现let-7g参与调控肌萎缩侧索硬化的发生发展,与其他的miRNAs、基因形成一个复杂的分子调控机制[12];在CD8+T细胞中,miRNA-491直接靶向细胞周期蛋白依赖激酶4、转录因子T细胞因子1,同时,TGF-β在CD8+T细胞中诱导了miRNA-491的表达,说明miRNA-491可以作为T淋巴细胞,特别是CD8+T细胞的负调节因子[13];软骨细胞mTORC1可以激活miRNA-483通过靶向HDAC4基因调控骨关节炎的进展[14];miRNA-146a在关节炎患者组织中过表达,且参与关节炎的炎症形成[15]。综合以上,说明这些表达差异的miRNAs在各种免疫、炎症性疾病中均有异常表达,并通过各种机制调控该类疾病的发生发展。
在差异表达的miRNAs,我们结合既往文献选取了最具表达差异的miRNA-126进行下一步生信学分析。近年来,miRNA-126作为一个热门非编码RNA一直以来被广泛的研究。我们通过生信学数据库对miRNA-126进行了序列、二级结构及保守性的分析,发现miRNA-126具有标志性的发夹结构,经典的茎环结构且序列均处于发夹结构的臂上,茎环结构中的碱基保守性略低。很多学者发现miRNA-126参与多种免疫性炎症性疾病的分子调控机制。最新研究显示[16],在皮肤伤口愈合过程中,miRNA-126表达上调。miRNA-126的过度表达通过靶向抑制PLK2基因参与促进角质形成细胞(KC)的增殖和迁移。miRNA-126的过表达还激活了PI3 K/AKT信号通路。作为表皮中的重要组成细胞,KC在AD患者的经皮致敏中扮演着非常重要的角色。所以基于既往文献及芯片数据,我们在筛选出的miRNA中选取miRNA-126来进行后续分析。此外,我们收集了我院AD患儿和健康儿童各20例,利用q-PCR方法检测两组人外周血血清中miRNA-126的表达水平,结果显示,AD组中miRNA-126的表达显著下调,与生信学分析结果吻合。
我们利用生信学数据库对miRNA-126的靶基因进行预测,结果显示共有110个基因,然后利用生信学软件对这些基因进行GO功能注释及KEGG信号通路富集分析。通过GO注释描述共得到11个分子功能注释信息、28个生物学过程注释信息。分析显示靶基因主要富集在血管通透性的调节、RAC蛋白信号转导、内皮细胞增殖的调节、基质黏附依赖性细胞扩散、活化MAPKK、磷蛋白结合等生物学过程和分子功能中。这些均与免疫与炎症的调节具有一定的关联性。
在GO注释分类的基础上,利用已有生物通路数据,对基因集合中的12个基因进行生物通路富集分析。结果显示基因显著富集于FoxO信号通路、NF-κB信号通路、B细胞受体信号通路、VEGF信号通路等17个通路。Kumagai等[17]KC通过NF-κB信号通路可以激活增加TSLP的释放,从而影响AD的发生发展。最近有文献显示[18],通过阻断小鼠NF-kB信号通路可以下调Th2的比例,说明AD可以激活NF-κB信号通路。我们从分析结果中可以看出,miRNA-126靶向基因VCAM1、CXCL12、BCL2、NFKBIA参与NF-κB信号通路,由于miRNA-126抑制靶基因的表达,所以AD患儿血清中下调miRNA-126的表达会解除对这些靶基因的抑制作用,从而激活NF-κB信号通路。图5结果显示,NF-κB信号通路在靶基因参与调控的所有信号通路所占权重最大,以上生信学分析结果与既往文献的结论相一致,说明NF-κB信号通路在AD的发病机制中发挥着重要的作用。
综合以上所述,本文采用生物信息学和分子生物学实验的方法对AD患儿miRNAs芯片数据进行深度挖掘和有效验证,从整体和微观的角度对AD相关miRNA及其调控基因、分子功能和生物学过程进行分析,以期在AD发生的机制研究、分子标志物的筛选及药物靶点选择奠定理论基础。
