CCK-8法测定纤维蛋白胶对人脂肪干细胞的细胞毒性
2019-09-12熊龑徐涛龚良国
熊龑 徐涛 龚良国
[摘要]目的 探讨CCK-8法测定纤维蛋白胶对人脂肪干细胞的细胞毒性。方法 选取2018年11月12日来我院进行成人吸脂术的某位28岁健康女性的术后废弃脂肪组织,并从中得到人脂肪干细胞,分别制成50%浸提液组、100%浸提液组、阴性对照组、阳性对照组,采用CCK-8检测试剂盒测定各组纤维蛋白培养液中的吸光值。结果 原代脂肪干细胞(ASCs)生长缓慢,传代后生长加速,且脂肪干细胞呈成纤维样细胞形态;阴性对照组的吸光值与50%、100%形态放置24 h和72 h的纤维蛋白胶浸提液组比较,差异无统计学意义(P>0.05)。50%及100%纤维蛋白胶浸提液组、阴性对照组的吸光值均小于阳性对照组,差异有统计学意义(P<0.05)。结论 纤维蛋白胶在与脂肪干细胞相混合的情况下无显著细胞毒性,能够为探索基于纤维蛋白胶作为支架材料的有关脂肪结构提供参考。
[关键词]CCK-8法;纤维蛋白胶;脂肪干细胞;细胞毒性
[中图分类号] R628 [文献标识码] A [文章编号] 1674-4721(2019)6(c)-0038-03
[Abstract] Objective To explore the cytotoxicity of fibrin glue to human adipose stem cells by CCK-8 method. Methods Human adipose stem cells were obtained from the waste adipose tissue of a 28-year-old healthy woman who came to our hospital on November 12, 2018 for adult liposuction, and made into the 50% fibrin glue leaching solution group, the 100% fibrin glue leaching solution group, the negative control group and the positive control group respectively. The absorbance values in each fibrin glue medium was determined by CCK-8 method. Results The growth of primary adipose stem cells (ASCs) was slowly. The growth of ASCs was accelerated after passage, and ASCs appeared fibroblast-like morphology. There were no significant differences in the absorbance between the 50% fibrin glue extract group, the 100% fibrin glue extract group and the negative control group at 24 and 72 hours (P>0.05). The absorbance values of 50% and 100% fibrin glue extract group and the negative control group were lower than that of the positive control group, with statistical significance (P<0.05). Conclusion Fibrin glue has no significant cytotoxicity when mixed with ASCs, which can provide a reference for the exploration of adipose structure based on fibrin glue as scaffold material.
[Key words] CCK-8 method; Fibrin glue; Adipose stem cells; Cytotoxicity
在整形外科的臨床实践活动中常常可以看到软组织缺失的情况,目前存在着两类能够作为软组织充填物的材料,首先是经过人工方式合成的正常肌理组织为主的临时性填充物,诸如胶原蛋白、透明质酸等,这些物质的良好生物相容性和可降解性让其应用范围广泛,但其填充效果却不能持续很长时间;其次是通过人工方式合成的惰性材料,诸如硅胶等,但这样的填充物等于异物植入,无法获得自然的整形术后效果[1-2]。目前快速崛起的自体脂肪颗粒一直存在着较低的术后脂肪存活率,这无形之中让以最终填充效果为目标的手术次数增多[3-4]。近年来,以组织再生理论为基础的脂肪组织工程因为脂肪干细胞(adipose stem cells,ASCs)的出现实现了飞跃,也让基于脂肪肝种子细胞为基础的脂肪组织工程日渐受到医学界关注[5]。本研究采用CCK-8法测定纤维蛋白胶对人ASCs的细胞毒性,旨在为基于纤维蛋白胶支架为基础的脂肪组织工程深化提供参考,现报道如下。
1资料与方法
1.1试剂与仪器
胎牛血清(FBS)、低糖DMEM培养基、胰蛋白酶(Gibco)均购自美国Gibco公司;Ⅰ型胶原酶、纤维蛋白原、凝血酶(Sigma)购自美国Sigma公司;CCK-8试剂购自日本同仁化学研究所;倒置相差显微镜购自日本Olpmpus公司,型号为CKX41;CO2培养箱购自美国Thermo公司,多功能酶标仪购自美国Thermo公司,型号为Skan Spertrum。
1.2研究方法
1.2.1人脂肪干细胞的获取 选取2018年11月12日来我院进行成人吸脂术的某位28岁健康女性的术后废弃脂肪组织并从中得到人脂肪干细胞,本研究在医院医学伦理委员会和患者本人的授权下进行。将5 ml废弃的吸脂术后人体脂肪组织与Ⅰ型胶原酶溶液混合,溶液浓度与脂肪组织相同且浓度为1.0 mg/ml,简单摇匀后在37℃的水浴箱内部静置消化30 min,之后在离心机上按照1000 r/min的速度连续离心5 min来消去表面油脂和液体。利用FBS DMEM培养基来对细胞进行重悬,培养基的FBS浓度为10%,细胞浓度设置为(5×105~10×105)个/L,然后将细菌接种到规格为25 cm2的培养瓶中培养48 h再进行第一次液体更换,融合度达到80%后利用胰蛋白酶消化传代,传代数目为3代,完成后的干细胞留作后用。
1.2.2纤维蛋白胶浸提液的制備 纤维蛋白胶浸提液的萃取参照ISO 10993医疗用具的生物学评价准则来进行。将浓度分别为50 mg/ml和500 U/ml的纤维蛋白原溶液和凝血酶溶液按照等体积抽吸到双联注射器之中,并将其转注到6孔板上,令纤维蛋白胶在6孔板底层均匀铺开。将培养基加注到已经成型的纤维蛋白胶上,加入时材料表面积和液体体积之间的比值为3 cm2/ml,将在37℃的孵化箱内部完成3 d浸提后形成的纤维蛋白胶百分百纯度浸提液和等量体积的DMEM培养基相融合,并让浸提液的浓度降低到50%。然后将10%浓度的胎牛血清放置其中并按照4℃低温保存以备后用。
1.2.3 CCK-8试剂测定各组培养液中吸光值 将制备的纤维蛋白胶制成不同浓度的纤维蛋白胶浸提液,分别为阴性对照组(DMEM培养基)、50%纤维蛋白胶浸提液组、100%纤维蛋白胶浸提液组和阳性对照组(DMEM培养基,内含6.4%苯酚溶液),完成细胞毒性检测。令第3代ASCs胰酶完成消化,之后按照1×107/L的浓度制造细胞悬液,按照每孔100 μl的比例在96孔板中完成接种,24 h以后提取培养完成的细胞贴壁并吸收废弃培养液。将制备的培养液分别添加到阴性对照组、50%纤维蛋白胶浸提液组、100%纤维蛋白胶浸提液组和阳性对照组4个分组中,4个分组培养液均包括5个复孔配置,细菌种版2个,培养箱温度为37℃。培养24 h和72 h时,将一块96孔板取出并对培养液进行吸收,每孔加入10 μl CCK-8溶液。将培养板在培养箱内培养2 h,采用酶联免疫检测仪在450 nm双波长处测得相应的吸光值(A值)。
1.3观察指标
观察传代后的ASCs生长速度以及人脂肪干细胞形态学的形态学状况,比较各组的A值,A值越大,表示物质对光的吸收越大,毒性也越大。
1.4统计学方法
采用SPSS 17.0统计学软件对数据进行分析,计量资料以均数±标准差(x±s)表示,组内比较采用单因子方差法,跨组别比较采用SNK-q检验法,以P<0.05为差异有统计学意义。
2结果
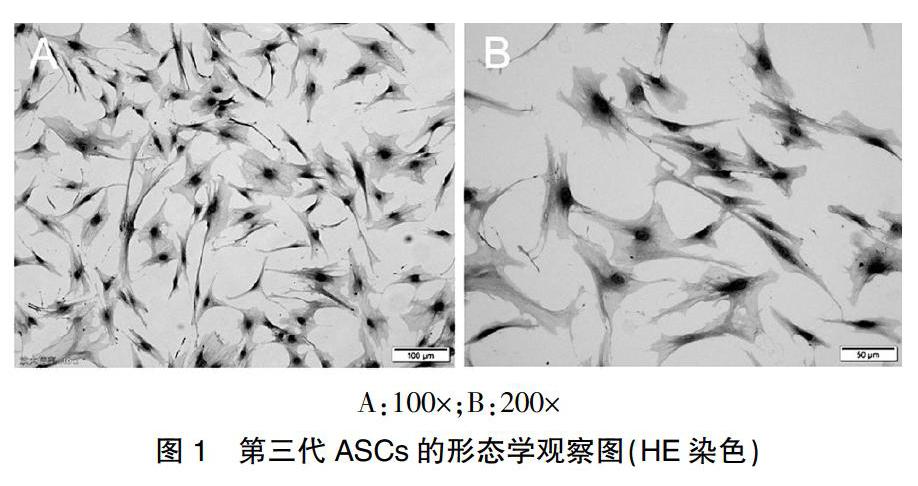
2.1人脂肪干细胞的形态学观察
利用酶消化手段从提取的人体脂肪吸收物中提取第一代ASCs,7 d以后,第一代ASCs才完全布满培养瓶。但是传代后的生长速度加快,代际传递时间只需要3 d。传代完成的ASCs有着最典型化的纤维细胞形状,足突与细胞核大而且明显。密集生长的细胞之间还呈现出涡状排布。
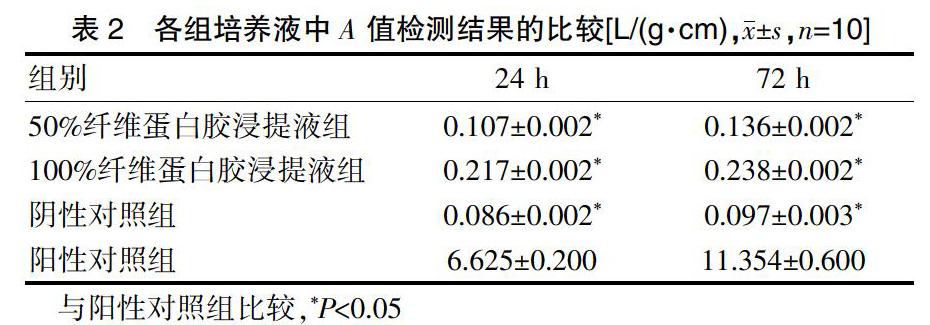
2.2各组培养液中A值检测结果的比较
对所有完成24 h和72 h培养的分组细胞上清液进行A值测试,结果显示两个培养时长内的50%及100%纤维蛋白胶浸提液组的A值与阴性对照组比较,差异无统计学意义(P>0.05)。完成24、72 h培养时,50%及100%纤维蛋白胶浸提液组、阴性对照组的A值均小于阳性对照组,差异有统计学意义(P<0.05)(表2)。
3讨论
支架材料是搭建脂肪组织工程的重要环节,须满足包括优良生物相容性和固定时间段高降解特性等一系列性质。在凝血反应的拟态之下,凝血酶与纤维蛋白原发生作用,产生了带有一定物理强度的胶状纤维蛋白胶(fibrin gel)。将纤维蛋白胶作成多种组织架构的支架材料已经有了多次见诸报端的实例[6]。然而,融入复合ASCs的纤维蛋白胶支架材料被用于搭建脂肪组织工程的研究范例还较为少见[7]。本研究中,ASCs被按照酶消化模式从脂肪组织中萃取出来,采用CCK-8模式对这一物质进行体外培养后与纤维蛋白胶相融合产生的细胞毒性进行测试,结果显示纤维蛋白胶与ASCs相融合后并没有明显的毒性,从而为该物质与复合ASCs相容共同作为脂肪组织工程支架材料的探索提供了参考。
一般情况下,组织搭建的工程思路是把支架材料和种子细胞的合成材料按照一定诱导模式植入人体,但这就需要种子细胞和支架材料两个关键性的东西。在2001年,Zuk等[8]第1次对基于脂肪吸取物培养而成的命名为ASCs的间充质干细胞特质种群进行报道。基于脂肪组织的大获取量和低获取难度,将脂肪作为ASCs的提取来源有着良好的实际潜力。脂肪组织工程因为ASCs的出现而实现了飞跃,也让基于脂肪肝种子细胞为基础的脂肪组织工程日渐受到医学界关注[9-10]。
种子细胞在组织工程的环境下必须在三维支架上实现种植,这也让支架材料在构建组织的过程中起到了重要的作用。支架可以基于塑型特质分为预塑型多孔材料和注射性凝胶材料[11-12],在脂肪组织工程的状态下,注射型凝胶支架搭建的注射型软组织填充物更具有常态化的优点,创面小、填充均匀、可以更好地完成对不规则缺失的填补[12]。
纤维蛋白原加上凝血酶造就的纤维蛋白胶其实就是凝血反应的最后拟态,水凝胶由纤维蛋白聚合而成,注射填充的活动只需要双联注射器即可轻松完成。良好的降解性让纤维蛋白胶在作为支架材料时可以拥有更好的组织工程潜力,在诸如平滑肌、骨骼、软组织等多个组织工程领域对纤维蛋白胶的利用探索已经多次出现在相关报道中[13-15]。
生物相容性是测试任何机体植入材料的必须标准,而对这些机体植入材料的生物相容性的国际通用测试活动主要分三步:①基于体外培养细胞繁殖干扰力的体外细胞毒性检测;②测试材料对于机体的局部或全身毒性的动物实验;③病患活体实验。这也让细胞毒性作用的测试成为了材料生物相容性测试的第一步,而测试细胞毒性的主要标准就是CCK-8标准。
本研究存在100%浓度液和50%浓度液的纤维蛋白胶浸提液,检测时间均在培养活动的第1、3 d进行。测试结果显示,两组浸提液的A值与阴性对照组比较,差异无统计学意义(P>0.05)。完成24、72 h培养时,50%及100%纤维蛋白胶浸提液组、阴性对照组的A值均小于阳性对照组,差异有统计学意义(P<0.05)。通过CCK-8法测定各组各时段的A值,结果显示,ASCs下纤维蛋白胶不存在显著细胞毒性。
在脂肪组织工程内部应用纤维蛋白胶支架材料尚无足够研究实例,本研究也只是纤维蛋白胶在体外ASCs内部所产生独行的CCK-8检测,未来对于纤维蛋白胶组织结构支架材料的实用安全研究还需要更加全面。
[参考文献]
[1]Chang Q,Lu F.A novel strategy for creating a large amount of engineered fat tissue with an axial vascular pedicle and a prefabricated scaffold[J].Med Hypotheses,2012,79(2):267-270.
[2]徐涛,易阳艳.LDH法测定纤维蛋白胶对人脂肪干细胞的细胞毒性[J].中国现代医生,2017,55(13):38-40.
[3]Eto H,Suga H,Matsumoto D,et al.Characterization of structure and cellular components of aspirated and excised adipose tissue[J].Plast Reconstr Surg,2009,124(4):1087-1097.
[4]唐芳芳.海藻糖对脂肪细胞冻存后活性影响的实验研究[D].衡阳:南华大学,2017.
[5]徐涛.LDH法测定纤维蛋白膠对人脂肪干细胞的细胞毒性[D].南昌:南昌大学,2017.
[6]张雪松,李正南,荆丹峰,等.外胚层间充质源神经干细胞-纤维蛋白支架复合体移植修复大鼠脊髓损伤[J].解剖学杂志,2016,39(2):207-210.
[7]阳水发,易阳艳,黄艳,等.人脂肪干细胞与不同浓度纤维蛋白胶的相容性研究[J].重庆医学,2017,46(2):165-168.
[8]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[9]黄艳,易阳艳.MTT法检测纤维蛋白胶对人脂肪源干细胞增殖的影响[J].中国美容医学杂志,2015,11(5):37-39.
[10]赵刚,刘微微,高伟玮,等.不同组织来源间充质干细胞体外成骨分化能力的比较研究[J].中国骨质疏松杂志,2017,23(5):561-566.
[11]李雅梅.HA/β-TCP/CS/MC可注射组织工程支架材料的制备与分析[D].乌鲁木齐:新疆医科大学,2017.
[12]黄亮节,翁土军,张春丽,等.Pellet培养与纤维蛋白凝胶支架体外成软骨能力的比较[J].中国骨与关节杂志,2017, 6(3):198-203.
[13]黄艳.人脂肪源干细胞与纤维蛋白胶共混在裸鼠体内外的初步研究[D].南昌:南昌大学,2016.
[14]朱元正,易阳艳,阳水发,等.携带肝细胞生长因子基因慢病毒转染人脂肪来源干细胞复合纤维蛋白胶支架构建可注射型组织工程脂肪的实验研究[J].中国修复重建外科杂志,2017,31(9):1111-1118.
[15]张建华.异种骨/重组人骨形态发生蛋白7/纤维蛋白胶复合材料的缓释性能及成骨活性[J].中国组织工程研究,2017,21(10):1527-1531.
(收稿日期:2018-11-30 本文编辑:孟庆卿)
