氨氮对异育银鲫‘中科3号’幼鱼急性毒性及肝脏抗氧化酶系统的影响
2019-09-10薛凌展吴素琼张坤樊海平陈斌田田林旋
薛凌展 吴素琼 张坤 樊海平 陈斌 田田 林旋





摘要:旨在研究氨氮對异育银鲫‘中科3号’的毒理作用,为生产提供可参考的理论依据。采用水生生物毒性方法,在室内静水条件下,开展氨氮对异育银鯽‘中科3号’幼鱼的急性毒性试验,并检测各组幼鱼肝脏组织中过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)和丙二醛(MDA)的变化情况。结果显示:异育银鲫‘中科3号’幼鱼经氨氮胁迫后,其24、48、96h的总氨氮半致死浓度分别为276.51mg/L、190.62mg/L和148.62mg/L,非离子氨半致死浓度分别为2.52mg/L、1.74mg/L、和1.36mg/L;总氨氮安全浓度为14.87mg/L,非离子氨安全浓度为0.14mg/L。在氨氮胁迫下肝脏组织中MDA含量上升,比对照组提高了26.20%、18.68%和17.08%;而CAT和T-SOD活性则均显现先激活后抑制的趋势,高浓度、长时间氨氮胁迫对幼鱼肝脏抗氧化酶活性影响较大,导致机体抗氧化能力的减弱。研究结果表明,异育银鲫‘中科3号’对氨氮的耐受性高于青鱼、草鱼、鲢鱼和鲤鱼等其他常见大宗鱼类,但是氨氮急性胁迫破坏了幼鱼肝脏抗氧化系统,长期处于氨氮胁迫下将不利于幼鱼健康生长。
关键词:异育银鲫鱼‘中科3号’;氨氮;急性毒性;肝脏;抗氧化酶
中图分类号:S917.4 文献标志码:A 论文编号:cjasl8070019
Ammonia Nitrogen: Effects on Acute Toxicity and Antioxidant Enzymes System in
Liver of Juvenile of Allogynogenetic gibel carp ‘CAS Ⅲ’
Xue Lingzhan1, Wu Suqiong2, Zhang Kun3, Fan Haiping1, Chen Bin1, Tian Tian1, Lin Xuan2
(1Freshwater Fisheries Research Institute of Fujian Province, Fuzhou 350002, Fujian, China; 2College of Animal Science, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China; 3Fujian Tianma Science and Technology Group Co., Ltd, Fuzhou 350308, Fujian, China)
Abstract: The study aims at the toxicological effect of ammonia nitrogen on Allogeneic crucian carp ‘CAS Ⅲ’. The aquatic organism toxicity method was used under hydrostatic condition indoor. The acute toxicity test of ammonia nitrogen on juvenile of Allogynogenetic gibel carp ‘CAS Ⅲ’ was conducted, and the changes of catalase (CAT), total superoxide dismutase (T-SOD) and malondialdehyde (MDA) in liver tissues were tested. The results showed that after ammonia nitrogen stress, the median lethal concentration (LC50) of total ammonia nitrogen was 276.51mg/L at 24h, 190.62mg/L at 48h and 148.62mg/L at 96h, and the LC50 of un-ionized ammonia was 2.52mg/L at 24h, 1.74 mg/L at 48 h, and 1.36 mg/L at 96 h. The safe concentration of total ammonia nitrogen and un-ionized ammonia was 14.87 mg/L and 0.14 mg/L, respectively, for juvenile. Under ammonia nitrogen stress, the content of MDA in the liver increased by 26.20%, 18.68% and 17.08% compare with the control (P<0.05), but CAT and T- SOD appeared to be activated at first and then inhibited, and antioxidase was induced more significantly at relatively higher concentration of ammonia nitrogen and long time exposure, and it weakened the antioxidant capacity of the body. The results reveal that ammonia tolerance of Allogynogenetic gibel carp ‘CAS Ⅲ’ is higher than that of Mylopharyngodon piceus, Ctenopharyngodon idellus, Hypophthalmichthys molitrix (Valenciennes, 1844), Cyprinus carpio Linnaeus, and other conventional freshwater fish. However, acute ammonia nitrogen stress damaged the liver antioxidant system and it is harmful to the health and growth of juvenile fish.
Keywords: Juvenile of Allogynogenetic gibel carp ‘CAS Ⅲ’; Ammonia Nitrogen; Acute Toxicity; Liver; Antioxidase
0 引言
中国的鲫鱼分为普通鲫鱼(Carassius auratus)和黒鲫(Carassius carassius)两个种以及银鲫(Carassius gibelio)一个亚种[1-2],属杂食性底层鱼類,全国各地水域常年均可养殖,2016年全国产量达到300万t[3],是中国养殖的重要淡水鱼之一。20世纪80年代中国发现银鲫异精雌核发育生殖方式,用兴国红鲤作为异源精子刺激银鲫卵子雌核发育产生全雌性后代,诞生了第一代异育银鲫,其突出的生长性能使得该品种被广泛养殖。进入90年代,科研人员采用血清蛋白的电泳表型在方正银鲫群体中区分出4个不同雌核发育克隆系,经多年生长对比养殖试验发现克隆系间存在明显的生长差异,进而选育出高体型异育银鲫,即为第二代异育银鲫,进一步奠定了鲫鱼品种中的主导地位,养殖效益突出,市场接受度较高。进入21世纪,新的核质杂交克隆技术被用于异育银鲫育种,科研人员利用A系银鲫的精子在D系银鲫的卵质中雄核发育产生全新的异育银鲫品种[4-5],定名为异育银鲫‘中科3号’(Allogynogenetic gibel carp ‘CAS Ⅲ’),并于2008年获得全国水产原种和良种审定委员会颁发的水产新品种证书(品种登记号:GS01-002-2007)[6]。该品种是由中国科,学院水生生物研究所淡水生态与生物技术国家重点实验室桂建芳院士团队精心选育的异育银鲫新品种,也是国家大宗淡水鱼产业技术体系近年重点推广的品种之一。该品种具有生长速度快、出肉率高、不易脱鳞、遗传性状稳定、肝脏碘泡虫发病率低和养殖经济效益高等特点深受渔民的喜爱。2011年福建省淡水水产研究所将异育银鲫‘中科3号’引入福建省进行养殖示范,经过6年的养殖推广,因其生长速度、抗病力及体型等生物性状优势明显,与同类品种相比养殖效益有了明显的提高,获得养殖户的一致认可,在福建地区的养殖规模逐年扩大。
养殖水体中氮化合物分为有机氮和无机氮两类,其中有机氮主要由氨基酸、蛋白质、核酸和腐殖酸等有机物中的氮组成,而无机氮主要包括铵态氮、亚硝态氮和硝态氮等。氨氮作为水体中无机氮的主要存在形式也是水产养殖过程中重点控制的水质指标,在水体中主要以非离子氨和离子氨的形式存在。《2014年中国环境状况公报》显示,中国废水中氨氮排放量达到238.5t,被列为废水中的第二大污染物[7],对人和水生动物健康带来威胁[8]。随着集约化养殖的发展,养殖密度逐渐提高、投饵量增加、残饵和排泄物大量积累,养殖水体中产生大量氨氮,进而影响鱼类生长和摄食。国外关于氨氮对水生动物的生理生化研究的报道较多,如IP[9]研究了氨氮对甲鱼(Pelodiscus sinensis)的急性毒性及解毒机理,Wicks等[10]研究了喂食和禁食条件下氨氮对鲑鱼(Oncorhynchus mykiss)的毒性特点,REDDY等[11]研究了南非鲍鱼(Haliotismidae)对氨氮的耐受性,Wee等[12]解剖分析了在氨氮半致死浓度暴露下,鲇鱼(Clarias gariepinus)脑中氨氮和谷氨酸盐的含量变化情况等。氨氮对鱼类毒理研究在国内的报道也不少,例如氨氮诱发鱼类鳃、肝、肾等组织结构变化的研究[13-14],氨氮影响机体免疫系统[15-16]和血液生化指标等研究[17-18]。SOD和CAT是机体内重要的抗氧化酶,机体受逆境胁迫时,SOD将自由基转化为HO2O2,然后再由CAT将H2O2分解成氧和水,从而使机体免于遭受H2O2的毒害[19-20]。SOD和CAT两种酶形成一个抗氧化链条保护机体,二者普遍存在于各个组织中,其中肝脏细胞中含量最高。通过检测鱼类肝脏中的T-SOD和CAT活性,可作为鱼类氨氮急性毒性效应的评价指标。MDA是机体生物膜遭受自由基攻击后,其膜脂过氧化反应的重要产物之一[20]。通过检测MDA含量的变化情况,可以间接反应机体生物膜系统受损程度以及生物体的抗逆性。
目前针对异育银鲫‘中科3号’的研究主要集中在胚胎发育[21]、苗种繁育[22]、养殖模式[23]和病害防治[24]等领域,而水质指标氨氮对异育银鲫‘中科3号’的毒理研究尚未见报道。由于异育银鲫‘中科3号’在集约化养殖过程中有机氮不断积累,在微生物分解下非离子氨浓度逐渐升高,常常造成鱼体急性或亚急性中毒现象,严重制约着该品种单位面积产量和肉质品质的提升,影响产业的健康发展。本研究以异育银鲫‘中科3号’幼鱼为研究对象,开展氨氮对其急性毒性试验,旨在综合分析氨氮对该品种的毒理作用,为深入研究异育银鲫‘中科3号’氨氮中毒问题奠定基础,并为苗种生产提供理论参考依据。
1 材料与方法
1.1 试验用鱼
异育银鲫‘中科3号’幼鱼由福建省顺昌县兆兴鱼种养殖有限公司提供,当年的夏花苗,规格均匀,体质健壮,体表完好,镜检无寄生虫等疾病,平均体重为(0.69±0.18)g,平均全长为(3.76±0.29)cm。试验前,将鱼苗于试验容器中暂养2周,每天投喂人工配合饲料2次,连续充气,早晚换水1次,换水量为50%,停止喂食24h后用于实验。
1.2 试验试剂
所用NH4Cl为分析纯,现配成母液后按比例稀释。过氧化氢酶(CAT)测试盒、总超氧化物歧化酶(T-SOD)测试盒、丙二醛(MDA)测试盒、蛋白定量测试盒均购自南京建成生物工程研究所。
1.3 试验方法
1.3.1 急性毒性试验 依照水生生物毒性方法[25],试验容器为8L圆形塑料容器,各试验组随机放入7尾鱼苗。预试验得到24h的100%死亡浓度(LC100,24h)和96h的0%死亡浓度(LC0.96h)后确定试验浓度,按等对数间距设立浓度组,每个浓度组设3个平行组,不添加NH4Cl为空白对照。试验分组及浓度设置详见表1。试验期间不投饵、不充气,每隔24h更换1次试验溶液。试验用水为曝气24h以上的地下水,水温为(25.5±1)℃,pH7.2±0.1。观察记录24、48、96h的死亡数,并及时捞出死亡的鱼苗。
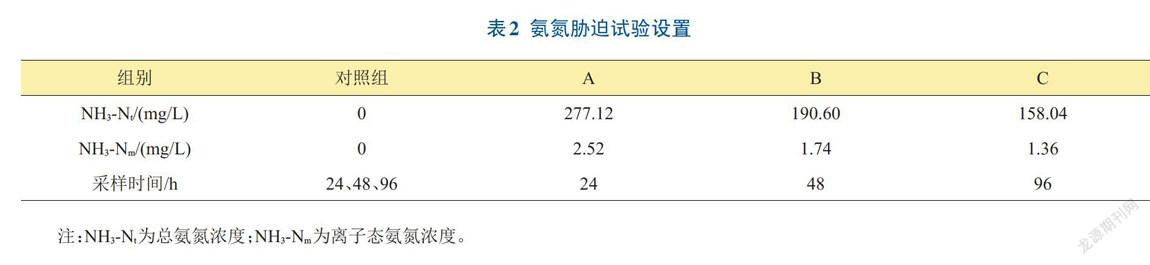
1.3.2 肝脏样品制备 取得氨氮对异育银鲫‘中科3号’幼鱼的24hLC50、48hLC50和96hLC50后,按24hLC50、48hLC50和96hLC50浓度分A、B、C组(见表2),每个浓度设3个平行组,不添加NH4Cl为空白对照。每组随机放入15尾鱼苗,试验条件同1.3.1。依次在24、48、96h取活鱼的肝脏样品,用生理盐水润洗,滤纸吸干水分后称量肝组织质量,按重量体积比制成10%的组织匀浆:冰水浴条件下机械匀浆,2500r/min,离心10min,取上清液待用。
1.3.3 酶活性测定 肝脏过氧化氢酶、总超氧化物歧化酶、丙二醛和蛋白含量测定均按试剂盒说明书进行操作。
1.4 数据处理
急性试验数据采用SPSS软件进行Probit回归分析[26],获得半数致死剂量(LC50)。
安全剂量(SC)=96hLC50×0.1(1)
式中:96hLC50为96h试验动物半数致死剂量。
非离子氨计算采用公式(2)[27]。
[NH3]=[NH4++NH3]/[10(pKa-pH)+1](2)
pKa-0.09018+2729.92/r(3)
其中,T=273+t,t为试验水温;pKa为离解常数,T为热力学温度。
对所有试验数据进行单因素方差分析(one-wayANOVA),并对分析结果进行多重比较。数据分析和图表制作分别采用Microsoft Excel 2003、SPSS 19.0和Graphpad prism 6.0完成,结果以平均数±标准差
(mean±SD)表示。
2 结果与分析
2.1 中毒症状
随胁迫氨氮浓度提高和时间延长,异育银鲫‘中科3号’幼鱼对氨氮的急性毒性症状主要表现为在水面或沿着容器水面急游,对震动等刺激反应剧烈;随着胁迫时间的延长和体力消耗,游动速度逐渐减慢,对外界刺激反应变迟钝;随后丧失游动平衡能力,时而旋转抽搐,时而侧躺桶底和间隙窜游,体色变浅;最后沉底不动,死亡时鳃盖微张,体色发白。
2.2 急性毒性试验
氨氮对异育银鲫‘中科3号’幼鱼的急性毒性结果见表3和表4。经24h氨氮胁迫后,只有392.5mg/L、351.67mg/L和315.08mg/L的死亡率高于50%,其中392.5mg/L幼鱼反应激烈,死亡率达到100%,其余8组的死亡率均低于50%,且162.99mg/L和146.03mg/L均未出现死亡个体,总氨氮24h半数致死浓度为277.12mg/L,非离子氨24h半致死浓度为2.53mg/L。当胁迫时间达到48h,有7组的死亡率高于50%,其中有392.50mg/L、351.67mg/L、315.08mg/L和282.30mg/L试验鱼全部死亡,其余4組的死亡率仍低于50%,总氨氮48h半数致死浓度为190.60mg/L,比24h时降低了31.22%,非离子氨48h半致死浓度为1.74mg/L,比24h时降低了31.23%。当胁迫时间达到96h时试验结束,此时共有9组死亡率高于50%,其中6组死亡率达到100%,146.03mg/L和130.84mg/L的死亡率低于50%。130.84mg/L在试验过程中均未出现死亡个体,试验结果与对照组一致,总氨氮96h半数致死浓度为158.04mg/L,分别比24h和48h时降低了42.97%和17.08%,非离子氨96h半数致死浓度为1.44mg/L,比24h和48h时降低了43.08%和20.83%。总氨氮安全浓度为15.80mg/L,非离子氨安全浓度为0.14mg/L。
2.3 肝脏抗氧化酶活性
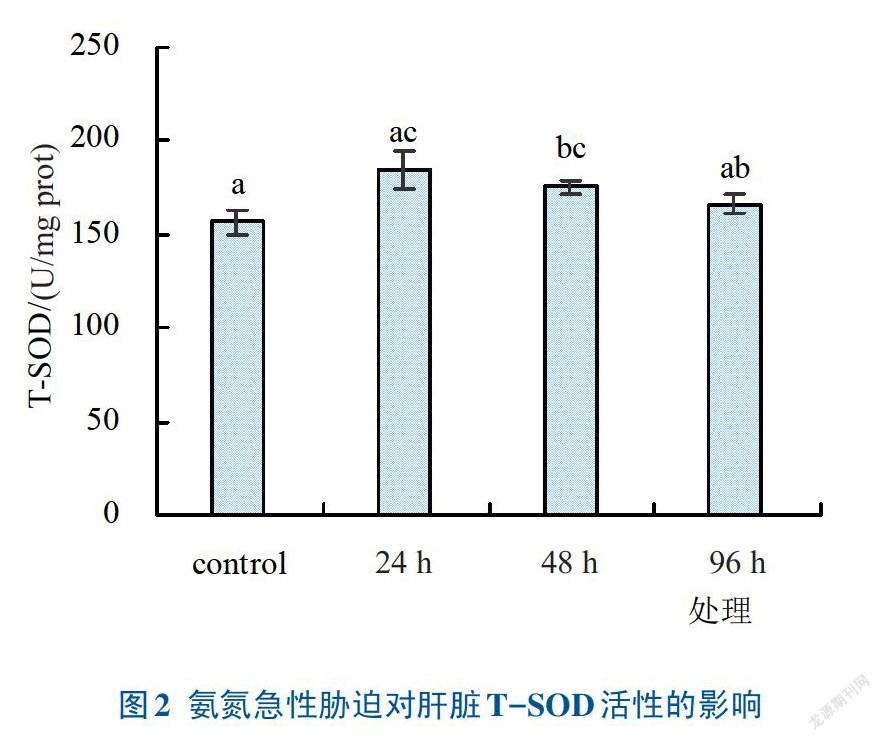
氨氮对异育银鲫‘中科3号’幼鱼急性胁迫对肝脏抗氧化性的影响见图1、图2和图3。经氨氮胁迫后,异育银鲫‘中科3号’幼鱼肝组织中的CAT活性比对照组明显提高,且随着胁迫时间的延长,CAT活性呈现出先升后降的趋势(见图1)。胁迫24h和48h的CAT活性显著高于对照组(P<0.05),48h达到最高,显著高于其他组(P<0.05),比对照组提高了86.12%;胁迫时间延长至96h时CAT活性有所下降,与对照组差异不显著(P>0.05)。氨氮胁迫导致异育银鲫‘中科3号’幼鱼肝组织T-SOD的变化与CAT相似(见图2),胁迫氨氮24h,T-SOD活性明显升高,与对照组相比差异显著(P<0.05),随着胁迫时间的延长,T-SOD活性出现缓慢下降,48h的T-SOD活性比24h下降了5.00%,仍显著高于对照组(P<0.05);当胁迫时间延长至96h时,T-SOD活性进一步下降,比24h时下降了10.14%,仅略高于对照组,差异不显著(P>0.05)。氨氮胁迫异育银鲫‘中科3号’幼鱼肝组织MDA含量出现了显著提高(见图3),24、48、96h比对照组分别提高了26.20%、18.68%和17.08%,差异显著(P<0.05)。随着氨氮胁迫异育银鲫‘中科3号’幼鱼时间的延长,肝脏总MDA含量出现了下降的趋势,但是差异不显著(P>0.05)。
3 讨论
3.1 氨氮对鱼类抗氧化功能的影响
肝脏抗氧化酶活性检测结果显示,氨氮低浓度短时胁迫,肝脏组织中T-SOD和CAT活性被激活;而氨氮高浓度长时间胁迫试验中T-SOD和CAT活性受抑制,即异育银鲫‘中科3号’幼鱼肝脏的T-SOD和CAT活性出现先升后降的变化趋势。该试验结果与韩春艳[16]、强俊[28]和姜会民[29]等氨氮对奥尼罗非鱼、黄河鲤的毒性影响相似。氨氮早期胁迫效应产生大量的自由基,诱导肝脏细胞中的T-SOD和CAT活性增加,出现氧化应激现象,抵御自由基的侵袭;随着氨氮胁迫时间和浓度的延长和提高,超出了机体的耐受性,抗氧化系统崩溃,氧化应激反应减弱,抗氧化酶活性也相继降低。不同氨氮浓度和胁迫时间下,异育银鲫‘中科3号’幼鱼肝脏组织中的MDA含量均显著高于对照组(P<0.05),这是因为异育银鲫‘中科3号’幼鱼在氨氮胁迫下,肝脏细胞生物膜系统发生一系列氧化应激,脂质过氧化反应形成大量的丙二醛(MDA)在细胞内聚集。MDA可损伤机体细胞,进一步影响抗氧化反应。氨氮胁迫对异育银鲫‘中科3号’幼鱼肝脏的T-SOD和CAT活性及MDA含量影响显著,反映了氨氮胁迫对幼鱼肝脏抗氧化系统损伤严重,这是氨氮胁迫对异育银鲫‘中科3号’幼鱼的主要毒理效应。
3.2 氨氮对鱼类的毒性
氨氮对异育银鲫‘中科3号’幼鱼的急性毒性与氨氮浓度和胁迫时间呈线性关系,随氨氮浓度提升幼鱼死亡率急剧上升,死亡时间缩短;同样,当胁迫时间延长时,氨氮毒性效应加强,致死浓度下降。
氨氮对鱼类急性毒性的研究较多,鲢鱼[Hypophthalmichthys molitrix (Valenciennes, 1844)][30]、草鱼(Ctenopharyngodon idellus)[31]、青鱼(Mylopharyngodonpiceus)[32]、和鲤鱼(Cyprinus carpio Linnaeus)[33]等大宗淡水鱼对氨氮比较敏感,其非离子氨的安全浓度范围为0.033~0.068mg/L,远低于异育银鲫‘中科3号’0.14mg/L,安全浓度仅为异育银鲫‘中科3号’的23.57%~48.57%,说明异育银鲫‘中科3号’对氨氮的耐受性较其他大宗淡水鱼更高。这可能与异育银鲫‘中科3号’习惯在水质肥沃、有机质丰富的池塘底层栖息和觅食的生物习性相关,因为水体底层的氨氮及其他有害物质浓度含量比中上层水体相对较高,遗传进化过程使其对氨氮的耐受力明显高于中上层鱼类。同样是底层经济鱼类黄颡鱼(Pelteobagrus fulvidraco)[18],非离子氨的安全浓度为0.15mg/L,对氨氮的耐受性与异育银鲫‘中科3号’相近。金鱼(Carassius auratus)[34]非离子氨的安全浓度为0.028mg/L,其虽然是鲫鱼的变异种,亲缘关系与异育银鲫‘中科3号’最近,但由于人们审美导致其长期处于“逆向选育”,逐渐丢了鲫鱼所拥有的一些底层鱼类生物特性所致,只適合在水质良好的环境中生长。此外,异育银鲫‘中科3号’的非离子氨安全浓度比麦穗鱼(Pseudorasbora parva)(0.0346mg/L)[35]、鳜鱼(SiniPecra chuatisi)(0.032mg/L)[36]等一些常见的溪河土著鱼类高,说明异育银鲫‘中科3号’相对于大多数经济鱼类具有更较强的氨氮耐受性。
4 结论
养殖生产中,由于养殖密度较高、投饵量较大,导致鱼体对环境因子抗逆水平下降。因此,从养殖安全和养殖效益角度考虑,维持良好的养殖生长环境,是异育银鲫‘中科3号’养殖过程中提高养殖效率、降低养殖风险、减少经济损失的重要技术要素。本文系统研究了氨氮对异育银鲫‘中科3号’幼鱼急性毒性及肝脏抗氧化酶系统的影响,试验结果显示,总氨氮的安全浓度为15.80 mg/L,非离子氨的安全浓度为0.14 mg/L。虽然异育银鲫‘中科3号’相对于大多数经济鱼类具有更较强的氨氮耐受性,但是从肝脏抗氧化酶活性检测结果分析,氨氮胁迫对幼鱼肝脏的T-SOD和CAT活性及MDA含量均产生了显著影响,说明氨氮胁迫破坏了幼鱼肝脏抗氧化系统,长期处于这种环境中将不利于幼鱼健康生长。因此在异育银鲫‘中科3号’苗种培育过程中因注意水质控制,可通过使用微生态制剂,提高溶解氧等手段,降低氨氮浓度,避免出现氨氮中毒现象,有助于提高养殖效益。
参考文献
[1]孟庆闻,缪学祖,俞泰吉,等.鱼类学(形态分类)[M].上海:上海科技出版社,1989:241.
[2]罗静,张亚平,朱春玲,等.鲫鱼遗传多样性的初步研究[J].遗传学报,1999,26(1):28-36.
[3]农业部渔业渔政管理局.中国渔业统计年鉴[M].北京:中国农业出版社,2017:25.
[4]Zhang J, Sun M, Zhou L, et al. Meiosis completion and various sperm responses lead to unisexual and sexual reproduction modes in one clone of polyploid Carassius gibelio[J].Scientific Reports, 2015,5(10):10898-10912.
[5]Wang Z W, Zhu H P, Wang D, et al. A novel nucleo-cytoplasmic hybrid clone formed via androgenesis in polyploid gibel carp[J]. BMC Research Notes,2011,4:82-95.
[6]桂建芳.异育银鲫养殖新品种-‘中科3号’简介[J].科学养鱼,2009(5):21.
[7]Guan B, Hu W, Zhang T L, et al. Acute and chronic unionized ammonia toxicity to ‘all-fish’ growth hormone transgenic common carp (Cyprinus carpio L.) [J].Chin Sci Bull,2010,55(35):4032-4036.
[8]蔡继晗,沈奇宇,郑向勇,等.氨氮污染对水产养殖的危害及处理技术研究进展[J].浙江海洋学院学报:自然科学版,2010,29(2):167- 172.
[9]IP Y K, Lee S M L, Wong W P, et al. Mechanisms of and defense against acute ammonia toxicity in the aquatic Chinese soft-shelled turtle (Pelodiscus sinensis) [J]. Aquatic Toxicology, 2008,86:185-196.
[10]Wicks B J, Randall D J. The effect of feeding and fasting on ammonia toxicity in juvenile rain bow trout (Oncorhynchus mykiss) [J]. Aquatic Toxicology, 2002,59:71-82.
[11]Reddy-Lopata K, Auerswald L, Cook P. Ammonia toxicity and its effect on the growth of the South African abalone (Haliotis midae Linnaeus)[J].Aquaculture,2006,261:678-687.
[12]Wee N L J, Tang Y Y M, Cheng H T, et al. Ammonia toxicity and tolerance in the brain of the African sharptooth catfish (Clarias gariepinus)[J].Aquatic Toxicology,2007,82:204-213.
[13]王昆.氨氮对鲤(Cyprinus carpio Linnaeus)幼鱼部分组织及血液指标的影响[D].哈尔滨:东北农业大学,2007.
[14]张武肖,孙盛明,戈贤平,等.急性氨氮胁迫及毒后恢复对团头鲂幼鱼鰓、肝和肾组织结构的影响[J].水产学报,2015,39(2):233-244.
[15]赵海洋.氨氮对南方鲶(Silurus meridionalis Chen)幼鱼血液生理、生化及非特异性免疫指标的影响[D].重庆:西南大学,2006.
[16]韩春艳,郑清海,陈桂丹,等.氨氮胁迫对奥尼罗非鱼非特异性免疫的影响[J].南方水产科学,2014,10(3):47-52.
[17]胡毅,黄云,钟蕾,等.氨氮胁迫对青鱼幼鱼鳃丝Na+/K+-ATP酶、组织结构及血清部分生理生化指标的影响[J].水产学报,2012,36(4):538-545.
[18]李波,樊启学,张磊,等.不同溶氧水平下氨氮和亚硝酸对黄颡鱼的急性毒性研究[J].淡水渔业,2009,39(3):31-35.
[19]徐杨.尼罗罗非鱼(Oreochromis niloticus)对氨氮和亚硝酸氮胁迫的生理响应[D].南京:南京农业大学,2015.
[20]叶继丹,韩友文,赵吉伟,等.喹乙醇对鲤肝胰脏抗氧化酶系统的影响[J].水产学报.2004.28(3):231-235.
[21]薛凌展.温度对异育银鲫‘中科3号’胚胎发育的影响[J].福建师范大学学报:自然科学版,2014,30(4):76-83.
[22]张永江,邹勇.异育银鲫‘中科3号’苗种繁育技术[J].科学养鱼,2016,1:5-6.
[23]薛凌展,樊海平,邓志武,等.池塘网箱气体循环水培育异育银鲫‘中科3号’夏花初探[J].科学养鱼,2017,6:81-82.
[24]白海峰,袁永锋,张星朗,等.一例异育银鲫‘中科3号’出血病诊断与防治[J].科学养鱼,2017,5:71.
[25]周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:75-106.
[26]张力.SPSS在生物统计中的应用[M].厦门:厦门大学出版社,2008: 152-155.
[27]Emerson K, Russo R C, Lund R E, et al. Aqueous ammonia equilibrium calculations: effect of pH and temperature[J] Journal of the Fisheries Research Board of Canada, 1975,32:2379-2383.
[28]强俊,徐跑,何杰,等.氨氮与拥挤胁迫对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化指标的联合影响水产学报,2011,35(12):1837-1848.
[29]姜会民.氨氮胁迫对黄河鲤幼鱼肝胰脏、肾脏抗氧化性的影响[J].山东大学学报:理学版,2012,47(1):17-22.
[30]梁健,金柏涛,王红权,等.氨氮对鲢鱼的急性研究[J].湖南饲料,2013(6):33-34.
[31]梁健,王红权,金柏涛,等.氨氮对草鱼幼鱼的急性毒性试验[J].科学养鱼,2013(11):50-51.
[32]李昭林,黄云,田芊芊,等.氨氮对青鱼幼鱼的急性毒性研究[J].科学养鱼,2013(5):52-53.
[33]刘汉友,徐丽丽.鲤鱼氨态氮急性毒性试验[J].河北渔业,2012,1:14-15.
[34]王凡,刘海芳,赵云龙.非离子态氨对金鱼鱼种的急性毒性试验[J].水产科学,2010,29(3):175-177.
[35]潘绅,王卫民,祝东梅.氨态氮、亚硝态氮、硝态氮对麦穗鱼的急性毒性研究[J].中国农学通报,2012,28(35):96-101.
[36]王侃,刘荭.非离子态氨及亚硝酸盐对鳜鱼苗的急性毒性试验[J].淡水渔业,1996,26(3):7-10.
