高、低糖甘蔗品种伸长期糖分积累特征及代谢相关酶活性分析
2019-09-10牛俊奇苗小荣王道波黄维杨丽涛李杨瑞
牛俊奇 苗小荣 王道波 黄维 杨丽涛 李杨瑞




摘要:为了探究高、低糖甘蔗品种伸长期蔗糖代谢相关酶与糖分积累的相关性,采用桶栽试验,对甘蔗高糖(CT35)和低糖(B8)品种伸长期不同成熟度的叶和茎中的蔗糖合成方向和分解方向酶的酶活性、蔗糖、葡萄糖和果糖含量进行分析。结果表明,2个品种叶中蔗糖和己糖含量与NI酶活性呈显著正相关,茎中蔗糖含量与SPS和CIN酶活性呈显著正相关,与SS-e、SAI和NI酶活性呈显著负相关。GT35在成熟茎和老茎中蔗糖含量显著高于B8,己糖含量则显著低于B8。GT35中酶活性显著高于低糖B8的酶有成熟叶中的SPS、SS-e和SAI,老叶中的SPS、SS-e、NI和CIN,幼叶中的SS-s和NI,成熟茎中的SPS和CIN,老茎中的SPS、SS-s和CIN以及幼茎中的SS-e和CIN。B8中酶活性显著高于GT35的酶有幼叶中的SS-e、SA/和CIN,成熟叶中的SA/和CIN,老叶中的SAI和SS-s,幼茎中的SA/、SS-s和NI,成熟茎中的SS-s、SS-e和SAI,老茎中的NI。基于以上结果,认为叶中高SPS和NI酶活性,茎中SPS和CIN酶活性高,SAI、SS-e和NI酶活性低,可能是调节伸长期高糖甘蔗品种茎中蔗糖积累的重要因素。
关键词:甘蔗;伸长期;蔗糖代谢相关酶;糖分积累
中图分类号:S566.1
文献标识码:A
文章编号: 1000-4440( 2019) 03-0537-07
甘蔗是世界上最重要的糖料作物,提高甘蔗的产量和蔗糖分,是现阶段甘蔗育种和栽培中面临的重大挑战[1-3]。糖分积累是个复杂的过程,由多种酶调控,涉及到蔗糖的合成、运输和代谢等生理过程,其中蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)和转化酶(INV)是调控蔗糖代谢途径的3大关键酶[4-5]。蔗糖代谢相关酶是研究蔗糖代谢机理的一个重要方面,探讨甘蔗体内与蔗糖代谢相关酶的水平、消长规律和基因的遗传多样性,可为选育高糖甘蔗品种奠定理论基础‘卅。
在植物中,SPS是光合产物向蔗糖和淀粉分配的关键调控点,也是蔗糖合成的关键限速酶之一,其酶活力与蔗糖合成呈正相关[7-11]。SS能催化蔗糖合成,也能催化蔗糖分解,促使蔗糖进入各种代谢途径[12],通过调控库器官输入蔗糖多少和代谢蔗糖的能力,来影响果实品质和作物产量[13]。INV在蔗糖的转运、贮藏和分配中发挥重要作用[14],其中细胞壁结合转化酶( CIⅣ)是质外体韧皮部蔗糖卸载通道的关键酶[15]。可溶性酸性转化酶(SAI)与果实发育、成熟以及糖分的积累密切相关[16];中性或碱性转化酶( N/)在线粒体中,与线粒体膜上蔗糖转运蛋白酶活性相互作用,在调节细胞渗透压和中间产物代谢方面起着重要作用[17-18]。蔗糖代谢相关酶活力水平高低,不仅影响含糖量,而且还决定“库”器官中积累糖的成分,因此蔗糖代谢相关酶对蔗糖积累的调控机制一直是研究的热点问题[5]。
甘蔗不同生育期蔗糖代谢相关酶与蔗糖积累的相关性研究,是解开甘蔗茎糖分积累复杂调控网络的必要依据。甘蔗产量和蔗糖含量的增加归结为“源一库”关系的协调,“源”和“库”器官中蔗糖积累过程,不仅受发育阶段的调节,而且还受蔗糖运输相关酶活性的调节,是蔗糖合成和分解酶类共同协作调节的[19]。伸長期以甘蔗发大根、长大茎的个体生长为主,是甘蔗一生中生长最快和生理代谢最为活跃的时期,也是决定甘蔗茎产量的关键时期[20]。因此,在课题组对甘蔗工艺成熟期2个甘蔗品种(GT28和ROC22)节间蔗糖代谢相关酶活性与蔗糖积累相关性研究的基础上,本研究旨在探究伸长期高、低糖甘蔗品种叶和茎中蔗糖代谢相关酶活性与蔗糖积累的关系,探讨高、低糖甘蔗品种伸长期糖分积累差异的内在机理,为进一步揭示甘蔗在生长发育过程中甘蔗茎糖分积累的分子调节机制提供理论基础。
1 材料与方法
1.1 试验与材料
甘蔗高糖品种GT35和低糖品种B8由广西农业科学院甘蔗研究所提供。于2014年1月25日在广西大学农学院甘蔗温室大棚中进行沙土育苗,3月20日选取大小、长势一致的幼苗移栽入塑料桶(300 mmX350 mm)中。每桶装营养土25 kg,其营养土成分为土:牛粪:砂子比例为7:2:1(质量比)。于2014年7月20日,取伸长期(自甘蔗开始拔节至伸长基本停止的时期)的幼茎、成熟茎、老茎、幼叶、成熟叶和老叶,用于测定蔗糖合成方向(SPS和蔗糖合成酶合成方向SS-s)和分解方向(SAI、CIN、NI和蔗糖合成酶分解方向SS-c)酶活性和糖分含量。采样时以顶端第一片完全展开叶为+1叶,即成熟叶,处于顶端中心位置还没有展开的叶为幼叶,甘蔗靠近茎基部的叶片为老叶。幼茎为幼叶包裹的未成熟茎,成熟茎为甘蔗茎中部已经完全成
熟的茎,老茎为靠近甘蔗茎基部的茎。每个甘蔗品种随机选取30株,把相同成熟度的叶片切碎混匀后,分成3份。同样,把相同成熟度的茎节去皮,切碎混匀后,也分成3份。对每份样品分别进行蔗糖分和酶活性的测定。
1.2 仪器和试剂
蔗糖、葡萄糖和果糖含量的测定采用美国Water公司Alliance2695高效液相色谱仪,酶活性测定采用美国伯腾Synergy H1全功能酶标仪。乙腈、蔗糖、葡萄糖和果糖均为色谱纯,试验用水为超纯水。
1.3 糖分含量的测定
利用HPLC技术测定甘蔗叶和茎中蔗糖、葡萄糖和果糖含量[17]。将甘蔗节间去皮并切成小块,将叶片切碎,用液氮研磨成均匀的粉末状。称取2.5 9粉末置于50 ml离心管,加入10 ml 80%乙醇,80℃水浴提取30 min,每隔5min摇匀1次,12 000 r/min离心15 min,取上清液,用80%乙醇重复抽提2次,将上清液合并于50 ml离心管中,90 cC水浴约3h,挥发至大约2 ml,将上清液定容到10 ml。用0.22μm微孔滤膜过滤除去杂质,得到糖分提取液。色谱条件为:YMC-Pack NH2 carbohydrate column (250.0 mmx4.6mm,5μm),柱温40℃,流速1ml/min,进样量为20μl,时间20 min。依据标准品的峰面积和糖分含量,利用公式(标样峰面积/标样糖分含量=样品峰面积/样品糖分含量)可计算样品中的糖分含量。己糖含量为葡萄糖和果糖含量之和。
1.4 蔗糖代谢相关酶活性测定
甘蔗蔗糖合成方向酶(SPS和SS-s)和分解方向酶(SA/,CIN,NI和SS-c)的提取、纯化和酶活性的测定,参照牛俊奇等[21-22]的方法。
1.5 数据分析
采用Excel 2007进行数据初步处理,运用SPSS21.0对数据进行显著性和相关性分析。采用Duncan法进行多重比较分析。将不同成熟度茎中蔗糖含量变化与相应部位的某个酶活性变化进行相关性分析。同理,分析茎中己糖含量、叶中蔗糖和己糖含量与蔗糖代谢相关酶酶活性的相关性。
2 结果与分析
2.1 伸长期高、低糖甘蔗品种叶和茎中糖分含量变化
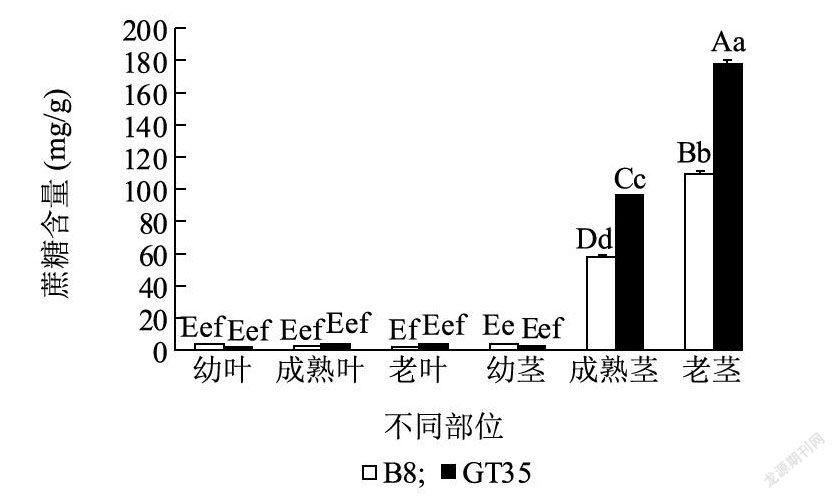
2.1.1 蔗糖含量变化在伸长期,GT35和B8茎中蔗糖含量的变化趋势相同,呈现为老茎>成熟茎>幼茎(图1),GT35在老茎和成熟茎中蔗糖含量极显著高于B8,说明所选品种GT35和B8茎中蔗糖含量存在显著差异,可以作为本试验的材料。
2个甘蔗品种的幼茎中蔗糖含量差异不显著,主要是因为幼茎是分生组织,细胞处于旺盛的分裂和生长阶段,不进行蔗糖的积累。幼叶合成的蔗糖先是供给自身的生长,多余的部分才供给甘蔗茎的生长,因此成熟叶才是合成蔗糖的主要功能叶。GT35在成熟叶和老叶中蔗糖含量高于B8,说明GT35叶中合成蔗糖的能力高于B8,但品种间差异不显著。
2.1.2 己糖含量变化在伸长期,GT35和B8在成熟茎中己糖含量显著高于幼茎和老茎(图2)。B8在老茎和成熟茎中己糖含量显著高于GT35,说明GT35在老茎和成熟茎中催化蔗糖合成的酶类酶活性比较强,能催化葡萄糖和果糖合成蔗糖,从而降低己糖含量。叶中己糖含量变化趋势相同,呈现为幼叶>成熟叶>老叶,但品种间差异不显著。
2.2 伸长期高、低糖甘蔗品种叶和茎中蔗糖合成方向酶活性变化
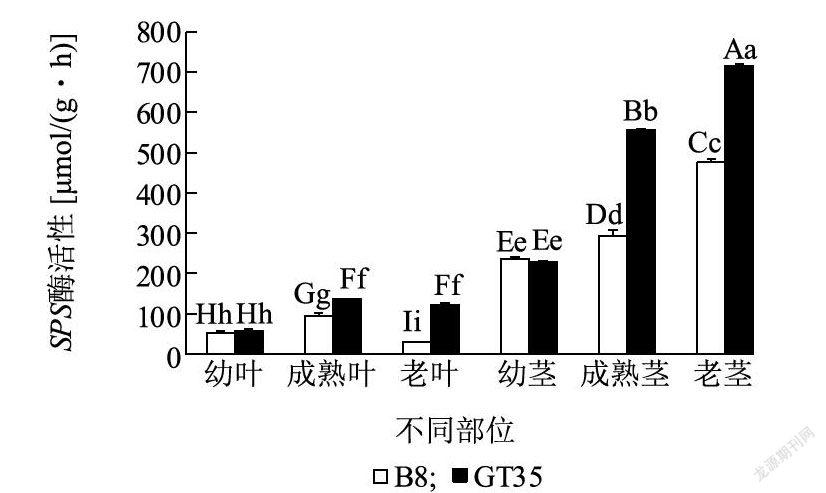
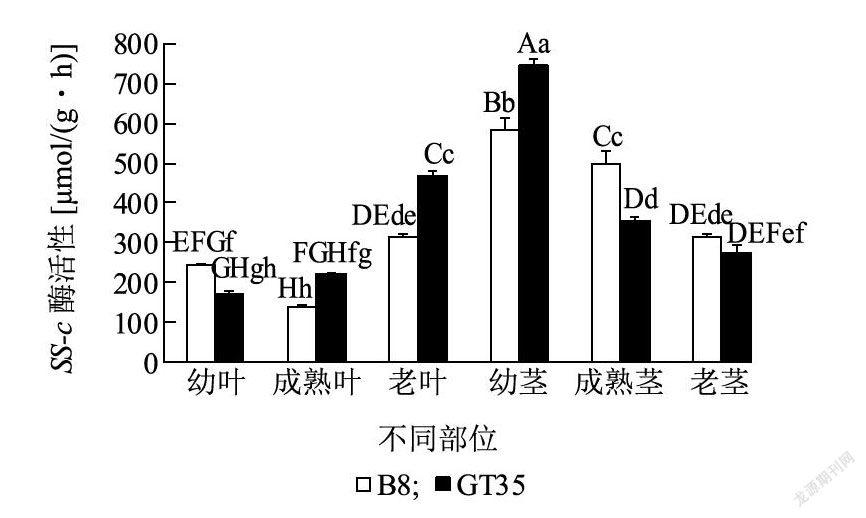
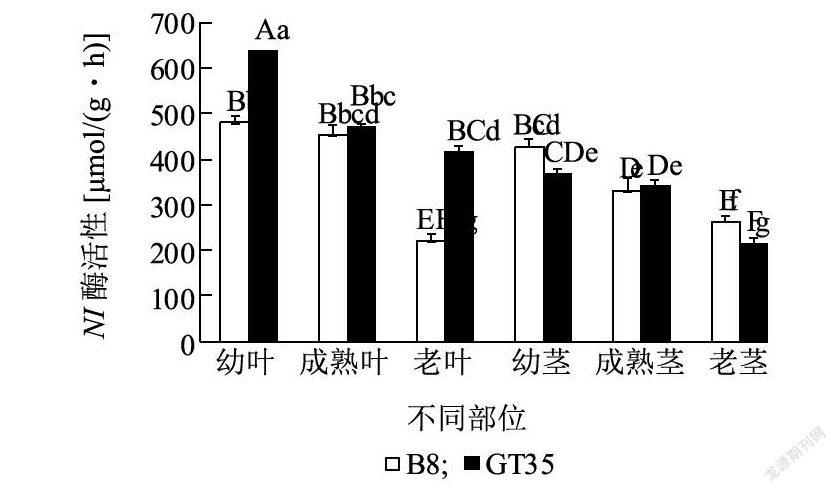
2.2.1 SPS酶活性变化在伸长期,GT35和B8茎中SPS酶活性变化趋势相同,呈现为老茎>成熟茎>幼茎(图3)。GT35在成熟茎和老茎中SPS酶活性分别是B8的1.59倍和1.51倍,品种间差异都达到极显著水平,而在幼茎中未达到显著差异水平。GT35叶中SPS酶活性呈现为成熟叶>老叶>幼叶,老叶和成熟叶中SPS酶活性分别是幼叶的2.12倍和2.40倍,品种内达到显著差异水平。B8叶中SPS酶活性呈现为成熟叶>幼叶>老叶,成熟叶和幼叶中SPS酶活性分别是老叶的3. 35倍和1.89倍,品种内达到显著差异水平。说明高糖甘蔗品种成熟叶、老叶、成熟茎和老茎中SPS酶活性显著高于低糖品种。 2.2.2 SS-s酶活性变化在伸长期,GT35茎中SS-s酶活性变化趋势呈现为老茎>成熟茎>幼茎,在老茎和成熟茎中SS-s酶活性分别是幼茎中2.44倍和1.75倍,达到极显著差异水平(图4)。B8茎中SS-s酶活性变化趋势呈现为成熟茎>幼茎>老茎,成熟茎和幼茎SS-s酶活性分别是老茎中的2.08倍和1.28倍,达到极显著差异水平。叶中SS-s酶活性在GT35变化趋势呈现为幼叶>成熟叶>老叶,差异达到极显著水平。B8叶中SS-s酶活性变化趋势呈现为成熟叶>幼叶>老叶,差异达到极显著水平。高糖品种老茎中SS-s酶活性显著高于低糖品种,而低糖品种成熟叶和老叶中SS-s酶活性显著高于高糖品种,说明SS-s酶活性在高、低糖甘蔗品种叶和茎中表达模式不同。 2.3 伸长期高、低糖甘蔗品种茎和叶中蔗糖分解方向酶活性变化 2.3.1 SS-c酶活性变化在伸长期,GT35和B8茎中SS-c酶活性变化趋势相同,呈现为幼茎>成熟茎>老茎(图5)。GT35幼茎SS-c酶活性是B8中的1.28倍,品种间达到极显著差异水平。B8成熟茎中SS-c酶活性是GT35的1.39倍,品种间达到极显著差异水平。叶中SS-c酶活性在GT35中变化趋势呈现为老叶>成熟叶>幼叶,而在B8叶中呈现为老叶>幼叶>成熟叶,品种间同一部位差异达到显著水平。GT35在老叶和成熟叶中SS-c酶活性高于B8,分别是其的1. 50倍和1.55倍,而在幼叶中酶活性低于B8。高糖甘蔗品种成熟茎和老茎中SS-c酶活性低于低糖甘蔗品种,而在成熟叶和老叶中SS-c酶活性显著高于低糖甘蔗品种,说明SS-c在高、低糖甘蔗品种叶和茎中表达模式不同。 2.3.2 NI酶活性变化在伸长期,GT35和B8茎中NI酶活性变化趋势相同,呈现为幼茎>成熟茎>老茎(图6)。B8幼茎和老茎中NI酶活性显著高于GT35,分别是其的1.16倍和1.21倍。GT35成熟茎中NI酶活性高于B8,但未达到显著差异水平。GT35和B8叶中NI酶活变化趋势也相同,呈现为幼叶>成熟叶>老叶。GT35在幼叶、成熟叶和老叶中NI酶活性分别是B8的1.33倍、1.04倍和1.88倍,其中品种间差异在幼叶和老叶中达到极显著水平,而在成熟叶中差异未达到显著水平。说明高、低糖甘蔗品种叶和茎中NI酶活性表达模式相同,其次,高糖品种在老叶中NI酶活性显著高于低糖品种,而在老茎中显著低于低糖品种。
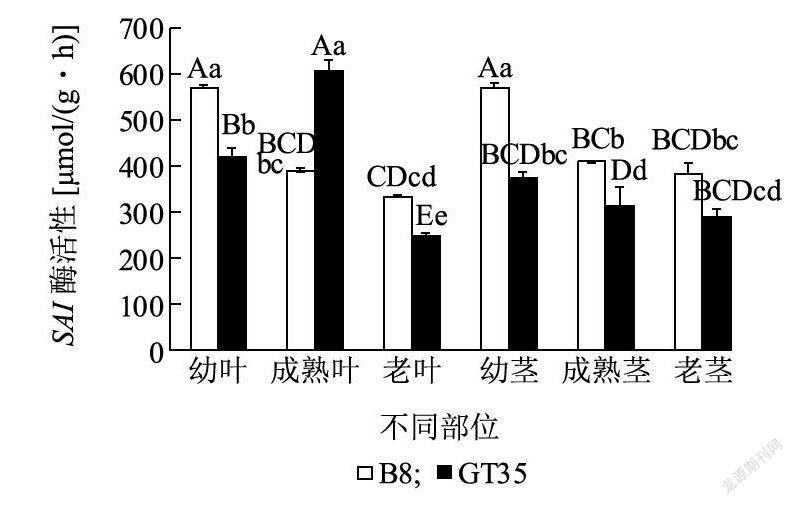
2.3.3 SAI酶活性变化在伸长期,GT35和B8茎中SAI酶活性变化趋势相同,呈现为幼茎>成熟茎>老茎(图7)。在幼莖、成熟茎和老茎中B8的SAI酶活性分别是GT35的1.53倍、1.30倍和1.32倍,其中品种间在幼茎和成熟茎中达到极显著差异水平,而在老茎中未达到显著差异水平。GT35叶中SAI酶活性变化趋势呈现为成熟叶>幼叶>老叶,品种内达到极显著差异水平。而在B8中呈现为幼叶>成熟叶>老叶,幼叶和成熟叶中SAI酶活性分别是老叶的1. 72倍和1.19倍,酶活性在幼叶和老叶之间达到显著差异水平,而在成熟叶和老叶之间未达到显著差异水平。说明高、低糖甘蔗品种在茎中SAI表达模式相同,其次,高糖品种SAI酶活性低于低糖品种,而成熟叶中高糖品种SAI酶活性显著高于低糖品种,老叶中SA/酶活性显著低于低糖品种。
2.3.4 CIN酶活性变化在伸长期,GT35和B8茎中CIN酶活变化趋势相同,呈现出老茎>成熟茎>幼茎(图8)。GT35在幼茎、成熟茎和老茎中CIN酶活性分别是B8中的4.40倍、2.27倍和2.76倍,品种间相同部位都达到极显著差异水平,GT35品种内不同部位间差异也达到极显著差异水平。GT35叶中CIN酶活性呈现为老叶>成熟叶>幼叶。B8幼叶中CIN酶活性是GT35中的2.10倍,达到极显著差异水平。CIN在高、低糖甘蔗品种茎中酶表达模式相同,高糖品种茎中CIN酶活性显著高于低糖品种,说明CIN可能在调节甘蔗茎糖分积累中发挥作用。
2.4 伸长期高、低糖甘蔗品种叶和茎中蔗糖代谢相关酶活性与糖分含量的相关性
GT35叶中蔗糖含量与SPS酶活性和NI酶活性呈极显著正相关,与SS-s呈极显著负相关(表1)。B8叶中蔗糖含量与SPS、SS-s、CIN、SAI和NI酶活性呈正相关,其中与NI和SAI达到极显著相关水平。GT35叶中己糖含量与SS-s和NI呈极显著正相关,而与SPS呈极显著负相关,与SS-c和CIN呈显著负相关。2个品种茎中蔗糖含量都与SPS和CIⅣ酶活性呈极显著正相关,与SS-c、NI和SAI酶活性呈极显著负相关,而GT35茎中蔗糖含量与SS-s酶活性呈极显著正相关。B8茎中己糖含量与SS-s酶活性呈极显著正相关,而GT35茎中己糖含量与NI酶活性呈极显著正相关。2个品种茎中己糖含量与SPS酶活性呈负相关,但都未达到显著相关水平。说明高、低糖甘蔗品种在叶和茎中糖分积累与蔗糖代谢相关酶活性的相关性,有共同规律,但也存在差异。
3 讨论
甘蔗是茎内积累蔗糖含量最高的作物,蔗糖的积累是甘蔗品质形成的关键,而蔗糖代谢又是蔗糖积累的重要环节。SPS与甘蔗生长、发育和糖分积累密切相关,其活性大小直接影响甘蔗的蔗糖合成和积累能力[23-24]本研究结果表明,2个甘蔗品种茎中蔗糖含量与SPS和CIⅣ酶活性显著正相关,高糖品种GT35在老茎和成熟茎中SPS酶活性显著高于低糖品种B8,这与前人的研究结果相一致[23.25]。甘蔗茎中SAI酶活性降低有利于蔗糖积累,而节间CIN酶活性提高,有利于蔗糖从低含量节间向高含量节间的运输[21]。本研究结果也表明甘蔗茎CIN自上而下茎段中酶活性逐渐增加,与茎中蔗糖含量呈极显著正相关,且GT35茎中CIN酶活性极显著高于低糖B8,说明CIN在甘蔗茎糖分积累中起重要作用。因此,茎中高SPS和CIN酶活性可以作为伸长期甘蔗高糖品种的一个重要特性。
果实中蔗糖的积累与SA/活性呈显著负相关[26]。引起甜瓜果实蔗糖积累的主要内在因子是SPS和SS-s酶活性的增加,INV和SS-c酶活性降低[27]。在灵武长枣果实发育前期SS-c酶活性高于SS-s酶活性,发育中后期以SS-s酶活性为主,SS-c酶活性随果实发育而下降,而SS-s酶活性随果实发育而逐步增强[28-29]。有研究结果表明,随着甘蔗节间成熟,甘蔗茎糖分增加,从而抑制SS-s酶活性,甘蔗节间锤度、蔗糖含量与SS-s酶活性呈显著负相关[22];本研究中,甘蔗伸长期高糖品种老茎蔗糖含量显著高于低糖品种,其SS-s酶活性仍维持在较高水平,且显著高于低糖品种;同时,相关性分析结果表明,高糖品种茎中蔗糖含量与SS-s活性呈显著正相关,低糖品种呈负相关,这可能与高糖品种甘蔗茎尚未完全成熟,蔗糖含量还有较大提升空间有关,可作为甘蔗伸长期高、低糖品种的一个重要特性。同时,本研究结果也表明甘蔗茎蔗糖积累与SS-c、SAI和NI酶活性呈极显著负相关,这与前人研究结果相一致[26-29]。在骏枣和辣椒果实的糖代谢中,NI酶活性起主要的调控作用[30-31],这与本研究2个甘蔗品种叶中蔗糖和己糖含量与NI酶活性呈显著正相关的结果相一致。前人研究也发现在甘蔗成熟期,叶中SAI酶活性随甘蔗的成熟而降低,而NI酶活性随甘蔗的成熟而升高[32]。
由于甘蔗基因型遗传特性差异,不同甘蔗品种中的蔗糖含量存在着显著的差异,但目前对这种现象的生化原理所知者甚少[5]。本研究结果表明,高、低糖甘蔗品种在伸长期叶和茎中蔗糖积累存在着共性特征,叶中蔗糖和己糖含量与NI酶活性呈极显著正相关,茎中蔗糖含量與SPS和CIN酶活性呈极显著正相关,与SS-c、SAI和NI酶活性呈极显著负相关。但低糖品种叶和茎中蔗糖代谢相关酶活性也有显著高于高糖品种的酶。由于甘蔗蔗糖分的表现型是由基因型和环境共同作用的结果。同时,甘蔗又是异源多倍体的杂合体,染色体遗传行为复杂,导致甘蔗糖分代谢机制的遗传学研究陷入困境。但利用功能基因组学,从转录组和蛋白质组水平研究甘蔗糖分代谢相关基因,不仅可以避开这个问题,而且能使研究深入到基因水平。下一步将采用RNA-Seq和iTRAQ技术分析这2个品种在伸长期幼茎、成熟茎和老茎中的转录组和蛋白质组,进行蛋白质组和转录组关联分析,筛选差异表达基因,挖掘调控甘蔗糖分积累的关键基因,构建甘蔗糖分积累关键差异基因的分子调控网络,解析甘蔗茎糖分积累的分子调控机制。
参考文献:
[1] 刘亚男,马海洋,冼皑敏,等.施氮方式和灌水量对甘蔗农艺性状、养分累积及产量的影响[J].南方农业学报,2017,48(2):252-258.
[2] 李杨瑞,杨丽涛.20世纪90年代以来我国甘蔗产业和科技的新发展[J].西南农业学报,2009.22(5):1469-1475.
[3]杨翠凤,张春雅,滕峥,等,不同基因型甘蔗种质遗传特性分析[J].江苏农业科学,2018,46( 17):79-82.
[4]王俊刚,赵婷婷,张树珍,等.甘蔗体内的蔗糖转运与运输途径[J].植物生理学通讯,2008(3):605-611.
[5] 周文灵,江永,李奇伟,等.甘蔗蔗糖积累的规律、影响因素及其调控机制的研究进展[J].甘蔗糖业,2011(6):11-17.
[6]赵丽宏,王俊刚,杨本鹏,等.甘蔗体内的蔗糖积累[J].基因组学与应用生物学,2009,28(2):385-390.
[7]黄诚梅,杨翠芳,魏源文,等,甘蔗蔗糖磷酸合成酶SPSⅢ基因表达分析[J].江苏农业科学,2018,46(2):17-20.
[8]LUNN J E,MACRAE E.New complexities in the synthesis of su-crose[J].Curt Opin Plant Biol, 2003,6(3):208-214.
[9]GROF C P L,ALBERTSON P L,BURSLE J,et al-Sucrose-phosphate synthase,a biochemical marker of high sucrose accumu-lation in sugarcane[J].Crop Science, 2007, 47(4): 1530-1539.
[10]刘洪博,陆鑫,毛钧,等,甘蔗蔗糖磷酸合成酶研究进展[J].湖南农业大学学报(自然科学版),2013,39( Sl):31-36.
[11]王俊刚,赵婷婷,杨本鹏,等.甘蔗脱毒健康种苗蔗糖磷酸合成酶基因差异表达分析[J].南方农业学报,2017,48(8):1335-1342.
[12]房经贵,朱旭东,贾海锋,等,植物蔗糖合酶生理功能研究进展[J].南京农业大学学报,2017,40(5):759-768.
[13]HARDIN S C,HUBER S C.Proteasome activity and the post-trans-lational control of sucrose svnthase stabilitv in maize leaves[J].Plant Physiology Biochemistry. 2004, 42(3):197-208.
[14]蓝基贤,唐朝荣.高等物植中转化酶生理生化特性的研究进展[J].热带物学报,2012, 33(9):1702-1707.
[15] NIU J Q, WANG A Q, HUANG J L,et al-Isolation. Character-ization and promoter analvsis of cell wajl invertase gene SoCIN1from sugarcane( Saccharum spp.)[ J]. Sugar Tech, 2015, 17(1):65-76.
[16]赵杰堂.蔗糖转化酶在高等植物生长发育及胁迫响应中的功能研究进展[J].热带亚热带植物学报,2016, 24( 3):352-358.
[17]SZARKA A, HOREMANS N, PASSARELLA S, et al. Demonstra-tion of an intramitochondrial invertase activity and thecorresponding sugar transporters of the inner mitochondrial mem-brane in Jerusalem artichoke(Helianthus tuberosus L)tubers[J].Planta, 2008, 228(5):765-775.
[18] MURAYAMA S J, HANDA H.Cenes for alkaline/neutralinvertase in rice: alkaline/neutral invertases are located in plantmitochondria and also in plastids[J].Planta, 2007, 225(5):1193-1203.
[19]闫梅玲,代红军,单守明,等.蔗糖代谢相关酶对果实糖积累影响的研究进展[J].安徽农业科学,2009, 37( 29): 14021-14023.
[20]田代发,宋焕忠,甘蔗生长发育特性与高产栽培技术[J].种子科技,2015,33(3):49-50, 52.
[21]牛俊奇,PHAN T T,邵敏,等.甘蔗T艺成熟期转化酶及其抑制子与蔗糖积累的相关性研究[J].西南农业学报,2015,28(4):1606-1611.
[22]牛俊奇,黄静丽,赵文慧,等.甘蔗T艺成熟期SS和SPS酶活性与糖分积累的相关性研究[J].生物技术通报,2015,31(9):105-110.
[23] PAN Y Q, LOU H L,LI Y R.Soluble acid invertase and sucrosephosphate synthase: key enzymes in regulating sucrose accumulationin sugarcane stalk[J].SuWr Tech, 2009, 11(1):28-33.
[24] SACHDEVA M, BHATIA S,BATTA S K.Sucrose accumulationin sugarcane:a potential target for crop improvement[J].ActaPhysiology Plant, 2011, 33(5):1571-1583.
[25]武紅霞,姚全胜,王松标,等.‘KRS’芒果发育过程中糖积累与代谢相关酶活性的关系[J].安徽农业科学,2016, 44( 17): 24-26, 55.
[26]胡丽松,吴刚,郝朝运,等,菠萝蜜果实中糖分积累特征及相关代谢酶活性分析[J].果树学报,2017. 34(2):224-230.
[27]张明方,李志凌,高等植物中与蔗糖代谢相关的酶[J].植物生理学通讯,2002, 38(3):289-295.
[28]景红霞,章英才,陈亚萍,等,糖代谢相关酶在灵武长枣叶片和果柄糖积累中的作用[J].西北植物学报,2014, 34(9): 1821-1827.
[29]章英才,陈亚萍,景红霞,等.‘灵武长枣’果实糖积累与蔗糖代谢相关酶的关系[J].果树学报,2014, 31(2):250-257.
[30]费光雪.骏枣果实糖分积累及相关代谢酶活性变化的研究[J].新疆农垦科技,2018,41(4):28-31.
[31] SHEN L B,YAO Y, HE H. et al-Cenome-wide identification.expression, and functional analysis of the alkaline/neutralinvertase gene family in pepper[J].International Journal of Molec-ular Sciences, 2018, 19(1):224.
[32]郭家文,刘少春,张跃彬,等.成熟期不同基因型甘蔗糖分和叶片酶活性的变化[J].中国糖料,2006(3):16-18, 21.
(责任编辑:陈海霞)
