HPLC法测定猕猴桃果皮转化液中乙酰丙酸含量
2019-09-10陈小敏谭书明王瑞唐明权
陈小敏 谭书明 王瑞 唐明权



摘 要:本文建立HPLC法检测猕猴桃果皮转化液中乙酰丙酸的含量。色谱柱为Agilent HC-C18柱(150 mm×4.6 mm×5 μm),甲醇-水体系(12:88)为流动相,柱温30℃,进样体积 5 μL ,检测波长266 nm,流速 0.5 mL/min,等浓度洗脱,外标法定量。结果表明:在0.2 mg/mL~1.0 mg/mL浓度范围内,线性关系良好,得到仪器的最低检出限为0.001 mg/kg,加标回收率(n=9)在 88.96%~97.97%范围内,仪器精密度RSD为1.077%,方法精密度RSD为4.275%。在此色谱条件下测得猕猴桃果皮转化液中乙酰丙酸的含量为1.387 mg/mL。
关键词:乙酰丙酸;猕猴桃;高效液相色谱法
中图分类号:TS201
文献标识码:A
文章编号:1008-0457(2019)04-0076-05 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.04.014
Determinetion of Levulinic Acid in Kiwi Fruit Peel Transforming Liquid by HPLC
CHEN Xiao-min1,TAN Shu-ming2*,WANG Rui3,TANG Ming-quan3
(1. College of Brewing and Food Engineering,Guizhou University,Guiyang,Guizhou 550025,China;2.College of Life Science,Guizhou University,Guiyang,Guizhou 550025,China;3. School of Food and Pharmaceutical Engineering,Guiyang College,Guiyang,Guizhou 550003,China)
Abstract:HPLC method was established to detect the content of transformation solution of levulinic acid in kiwi fruit peel. Methods: Chromatographic column was Agilent HC-C18 column (150 mm x 4.6 mm x 5 microns),methanol-water system (12:88) as mobile phase at a flow rate of 0.5 mL/min,the column temperature was 30 ℃,the injecting volume was 5 uL and the detection wavelength was at 266 nm,Elution of the same concentration,quantitative by external standard method. Results: The method was good linear correlation within the range of 0.2 mg/mL ~ 1.0 mg/mL for levulinic acid,and the minimum detection limit of the instrument was 0.001 mg/kg. The levulinic acid standard recovery (n=9) were within the range of 88.96% ~ 97.97%,the precision RSD of the instrument was 1.077% and the method was 4.275%. For all conditions to measurement what the content of levulinic acid was 1.387 mg/mL.
Key words:Levulinic acid; Kiwi fruit; HPLC
隨着社会的快速发展,化石能源的枯竭,不可再生资源的供应紧张及使用石油资源等引起的温室效应、臭氧层破环、酸雨等问题,已成为全球人民热议的话题。所以,人们寻找新的替代能源已成为当今社会刻不容缓的问题。生物质因其储存量丰富、可持续发展、对环境破坏小等特点被视为未来最重要的可替代能源之一[1-2]。生物质是指通过光合作用而产生可再生的或可循环的有机物质,化学组分可分为木质纤维素、淀粉和油脂[3]。随着研究的不断深入,通过生物质反应得到的价格低廉、用途广泛的绿色平台化合物逐渐成为人们关注的热点。
美国报告和2010年新修订的平台化合物中指出了乙酰丙酸是一种具有代表性的绿色平台化合物[4-6]。乙酰丙酸 ( Levulinic acid,LA ) ,又名左旋糖酸或果糖酸[7]。可通过木质纤维素水解得到,而且因其官能团特性使其能够通过多种化学反应来制备各种高附加值化学品[8]。衍生出来的化学品在电子产品、香料、食品、化妆品、医药、燃料等领域应用广泛[9-10]。所以对乙酰丙酸的研究与测定必不可少,目前乙酰丙酸的检测方法有薄层扫描法[11]、香草醛-硫酸法[12-13]、离子色谱法[14-15]、气相色谱法等[16-17]。但每种方法都有不足之处,薄层扫描法对乙酰丙酸的测定只能半定量、香草醛-硫酸法只能定性不能准确定量、气相色谱法前处理复杂,成本高、离子色谱法设备要求高,装置复杂,色谱柱非常昂贵,整个过程耗时长。高效液相色谱(high performance liquid chromatogram,HPLC) 法因处理样品简单、快速,且能同时测定几种成分而被广泛应用于各类化合物的检测[18]。通过对以上检测方法的比较与参考,本文以猕猴桃果皮为生物质原料来制备乙酰丙酸,建立高效液相色谱法对猕猴桃转化液中乙酰丙酸的含量进行检测,寻找一种更快速、便捷、有效的检测方法,为乙酰丙酸的检测寻找更多、更有效的方法。
1 材料与方法
1.1 材料
猕猴桃:购于贵州省贵阳市修文县。
1.2 试剂
乙酰丙酸、分析纯:北京百灵威科技有限公司;甲醇,AR:Aladdin Chemistry Co;纯净水:实验室自制。
1.3 仪器
LC-15C高效液相色谱仪:日本岛津公司;KQ5200DB数控超声波清洗器:昆山市超声仪器有限公司;MA110电子天平:上海良平仪器仪表有限公司;UV-2700紫外分光光度计:岛津企业管理(中国)有限公司。
1.4 方法
1.4.1 标准品溶液的制备
精密称取 0.50026 g(精确至0.0001 g)乙酰丙酸标准品,用纯净水配成浓度为 100 mg/mL 的标准储备液,避光保存于4℃冰箱备用。
1.4.2 样品溶液的制备
量取猕猴桃果皮压榨制备的汁液25 mL,称取经氨水滴定法并高温煅烧过所制得的催化剂P2O5 0.5 g,两者同时加入高温反应釜中在 190℃ 高温下反应 20 min提取猕猴桃汁液中的乙酰丙酸,过滤并定容到50 mL 的容量瓶中得样品液1瓶。用100~1000 uL 的移液枪取 2 mL的样品溶液于 10 mL 的容量瓶中加纯净水至刻度线,摇匀放入 4℃的冰箱备用。
1.4.3 确定最大吸收波长
利用紫外分光光度计在200~450 nm处,对乙酰丙酸标准品进行3次波长扫描取平均值,确定最大紫外吸收波长。
1.4.4 确定最佳流速
确定甲醇-水体系(12∶88)为流动相;色谱柱为Agilent HC-C18柱(150 mm×4.6 mm×5 μm);柱温30℃;进样体积 5 μL ;检测波长266 nm,更换0.3、0.5、0.8 mL/min三种流速;每种流速条件下分别对乙酰丙酸标样及乙酰丙酸样品进样,比较标样出峰对应的时间下样品的分离情况,筛选出最佳的流速。
1.4.5 确定最佳流动相
色谱柱为Agilent HC-C18柱(150 mm×4.6 mm×5 μm);柱温30℃;进样体积 5 μL ;检测波长266 nm;流速 0.5 mL/min,等浓度洗脱。控制流动相甲醇与水的体积比分别为:10∶90、12∶88、20∶80、30∶70四种比例;在每种流动相比例条件下分别对乙酰丙酸标样及乙酰丙酸样品进样,比较在标样对应的出峰时间下样品的出峰情况,观察乙酰丙酸的分离情况,筛选出最佳流动相比例。
2 结果与分析
2.1 高效液相色谱条件
2.1.1 最大吸收波长的测定
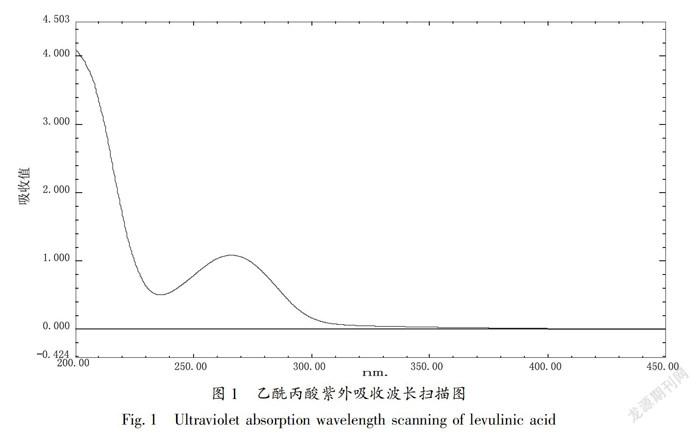
利用紫外检测器,在200~450 nm处对乙酰丙酸标准样品进行最大紫外吸收波长的扫描,扫描3次取平均值(图1)。当波长在266 nm时,乙酰丙酸吸光度为1.086达到最大紫外吸收,确定266 nm为乙酰丙酸的最佳检测波长。
2.1.2 流动相比例
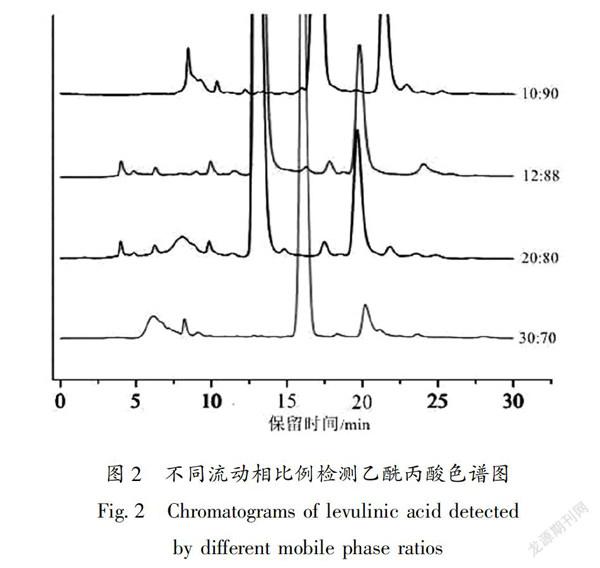
色谱柱为Agilent HC-C18柱(150 mm×4.6 mm×5 μm);柱温30℃;进样体积 5 μL ;检测波长266 nm;流速 0.5 mL/min,等浓度洗脱。控制流动相甲醇与水的体积比分别为:10∶90、12∶88、20∶80、30∶70四种比例;在每种流动相比例条件下分别对乙酰丙酸标样及样品进样,比较在标样对应的出峰时间下样品的出峰情况,观察乙酰丙酸的分离情况。图2从上到下流动相水与甲醇比依次为90∶10、88∶12、80∶20、70∶30,可以看出当流动相比例为88∶12时,乙酰丙酸能被很好的分离。
2.1.3 流速的选择
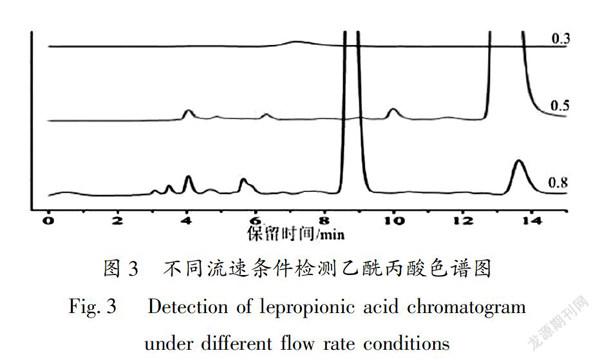
确定甲醇-水体系(12:88)为流动相;色谱柱为Agilent HC-C18柱(150 mm×4.6 mm×5 μm);柱温30℃;进样体积 5 μL ;检测波长266 nm,流速分别为:0.3、0.5、0.8 mL/min时,如图3(从上到下依次为0.3、0.5、0.8 mL/min)可以看出当流速为0.5 mL/min时乙酰丙酸能被很好的分离,没有杂质峰的干扰;当流速为0.3 mL/min时,由于流速较低乙酰丙酸没有被分离,流速到0.8 mL/min时乙酰丙酸也没有被分离出来,确定最佳流速为0.5 mL/min。
2.1.4 标准曲线的绘制
精密称取乙酰丙酸标准品0.50026 g,用纯净水配成浓度为100 mg/mL的标准储备液,在5支10 mL容量瓶中分别精密量取标准储备液配制成浓度为:0.2、0.4、0.6、0.8、1.0 mg/mL的标准溶液。每个浓度的溶液在优化的色谱条件下用HPLC重复三次进样,峰面积取平均值作标准曲线。得到乙酰丙酸标准曲线的线性方程为y=98449x-526.4(y为峰面积,x为乙酰丙酸的浓度):相关系数R为0.9999,标准曲线以及线性方程(图4)。
2.1.5 检出限
通过实验得到,当乙酰丙酸达到一定浓度时,色谱柱由于过载,保留时间前移,不能准确定性,根据信噪比S/N=3计算,该方法检出限为0.001 mg/kg。
2.1.6 精密度试验
取浓度为0.60 mg/mL的乙酰丙酸标准品溶液在优化的色谱条件下连续进样7次,测定峰面积如表1,结果得到标准品的峰面积RSD为1.077%(n=7),表明仪器的精密度良好。
2.1.7 重復性试验
取样品溶液按相同的处理方法平行制备7份样品进样液,在优化的色谱条件下对7份样品溶液进行检测,结果按表2测定的峰面积来计算,RSD为4.275%(n=7)。
2.1.8 回收率试验
取已知浓度的猕猴桃转化液9份,加入等体积已知浓度的乙酰丙酸标准溶液,利用高效液相色谱重复检测3次,计算回收率(如表3),结果得到平均回收率为88.96%~97.97%。
2.1.9 样品溶液的测定
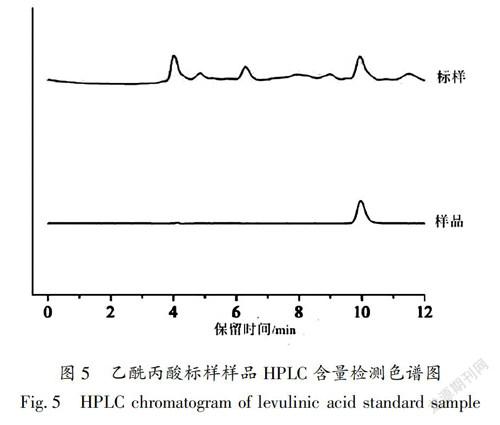
将1.4.1和1.4.2中制备的乙酰丙酸标准品溶液和样品溶液在优化的色谱条件下进样分析检测。结果如图5所示,乙酰丙酸标准品和样品溶液出峰时间吻合,峰面积为13131,代入公式y=98449x-526.4,经过计算得生物质转化液中乙酰丙酸的含量为1.387mg/mL。
3 结论与讨论
乙酰丙酸是一种具有代表性的绿色平台化合物,可通过生物质反应得到,被广泛的应用于医药、农药、有机合成中间体、香料原料、聚合物、塑料改性剂、树脂、润滑油、橡胶助剂、印刷油墨及涂料的添加剂等,涉及到化工、医药、化妆品、食品、纺织、电子产品等众多领域。因此,建立一种高效、快速、专属性强、操作简单的检测方法意义重大。
本文建立了猕猴桃果皮转化液中乙酰丙酸的 HPLC 检测方法,最佳的色谱条件为:流动相 A 为 88%的水溶液,流动相 B 为 12%的水溶液,色谱柱AgilentHC-C18柱(150 mm×4.6 mm×5 μm),柱温30℃,检测波长 266 nm,流速0.5 mL/min,进样体积 5 μL,等浓度洗脱。在此色谱条件下,得到乙酰丙酸标准曲线的线性方程为y=98449x-526.4(y为峰面积,x为乙酰丙酸的浓度):相关系数R为0.9999,在 0.2 mg/mL~1 mg/mL 范围内线性关系良好;平均回收率为88.96%~97.97%,表明方法准确可信。精密度RSD为1.077%(n=7),变异系数低于 2%,表明仪器的精密度良好。
利用建立的色谱条件检测出猕猴桃果皮转化液中乙酰丙酸的含量为1.387 mg/mL。但本文不足之处是只用一种生物质转化液来进行检测,如果利用不同的生物质转化液来检测其中的乙酰丙酸含量,其结果更具有说服力。
参 考 文 献:
[1] 张建安,刘德华.生物质能源利用技术[M].北京:化学工业出版社,2009.
[2] 李海滨,袁振宏,马晓茵.现代生物质能利用技术[M].北京:化学工业出版社,2012.
[3] Alonso David Martin,Bond Jesse Q,Dumesic James A,Catalytic conversion of biomass to biofuels[J]. Green Chemistry ,2010,12:1493-1513.
[4] Werpy T,Petersen G.Top value added chemicals from biomass volume I,results of screening for potential candidates from sugars and synthesis gas[M]. Energy efficiency and renewable energy ,2004.
[5] Bozell J J,Petersen G R.Technology development for the production of biobased products from biorefinery carbohydrates—the US Department of Energy’s “Top 10” revisited[J]. Green Chemistry ,2010,12(4):539-554.
[6] Serrano-Ruiz J C,West R M,Dumesic J A.Catalytic conversion of renewable biomass resources to fuels and chemicals[J]. Annual review of chemical and biomolecular engineering ,2010,1:79-100.
[7] 郑文静,崔媛媛,许琳琳,等.乙酰丙酸制备工艺的研究现状[J].甘蔗糖业,2018(2):59-64.
[8] 吴树翔.乙酰丙酸催化转化及固体酸催化傅克酰基化研究[D].聊城:聊城大学,2018.
[9] 蔡 磊,吕秀阳,何 龙,等.新平台化合物乙酰丙酸制备方法研究进展[J].现代化工,2003,23 (4):14-16.
[10] 常 春,马晓建,岑沛霖.新型绿色平台化合物乙酰丙酸的生产及应用研究进展[J].化工进展,2005,24 (4):350-356.
[11] 粟 晖,葛 军.斜投影-不展开薄层色谱法对废木料液化产物乙酰丙酸的过程分析[J].色谱,2014,32(1):100-104.
[12] 贺才珍,潘秋华.酱油中乙酰丙酸含量的半定量分析方法[J].上海师范大学学报(自然科学版),2003,32(4):100-102.
[13] 苏 萍,黄谷亮,等.甘蔗渣水解液中乙酰丙酸的定性检测[J].广西蔗糖,2008(3):44-45.
[14] 隋小玉,林 鹿.离子色谱法测定葡萄糖水解液中乙酰丙酸的含量[J].食品科技,2010,35(3):281-284.
[15] 任 飞,杨娟芬,许迪明,等.离子色谱法测定酱油中乙酰丙酸[J].分析试验室,2008,27(S2):126-128.
[16] 林泽鹏,许少美,林 晨,等.氣相色谱法测定6大类食品中乙酰丙酸的含量[J].食品工业,2018,39(11):295-297.
[17] 蔡 磊,吕秀阳,何 龙,等.气相色谱法直接分析生物质水解产物中的乙酰丙酸[J].分析测试学报,2004(6):104-105.
[18] 宋俊蓉,娄华勇,方友来,等.HPLC法同时测定粉防己中汉防己甲素和汉防己乙素的含量[J].山地农业生物学报,2018,37(3):79-83,89.
