三叶青毛状根的诱导及其液体培养体系的研究
2019-09-10向倩倩杨佳瑶侯梓淇
向倩倩 杨佳瑶 侯梓淇
摘要: 为建立三叶青毛状根的诱导和液体培养体系,采用发根农杆菌株系C58C1和ATCC15834进行毛状根的诱导,通过无菌三叶青叶片预培养、浸染、共培养、筛选、形态和PCR鉴定等过程获得三叶青毛状根根系,并对三叶青毛状根和两年生块根总黄酮进行比较分析。试验结果表明,发根农杆菌C58C1能从三叶青叶片诱导出毛状根,三叶青毛状根在不添加生长素的1/2MS液体培养基中生长状态良好,其总黄酮含量约是2年生三叶青块根的1/5。
关键词: 三叶青; 毛状根; C58C1; 黄酮; 液体培养
三叶青(Tetrastigma hemsleyanum) 是葡萄科崖爬藤属植物,俗名金线吊葫芦、蛇附子、石老鼠等,为我国特有珍稀药用植物,全草可入药,以地下块根最佳[ 1, 2 ]。近些年来,三叶青块根被发现具有低毒和抗癌特性[ 3 - 10 ],自然资源遭到规模化人为破坏[ 11 - 12 ]。三叶青自然生长条件苛刻,生长缓慢,人工栽培技术还不成熟,难以满足快速增长的市场需求。尽管人们对三叶青进行了微繁和细胞培养研究,但规模化应用明显不足[ 13 - 14 ]。另一方面,人们在三叶青块根中发现了大量的黄酮类物质[ 15 - 19 ],但一直没有确定其主效成分。毛状根具有生长速度快、遗传稳定、培养周期短、条件可控等优点,可为植物次生代谢产物的规模生产、作物品种改良、环境修复以及相关理论的研究提供快捷的培养体系[ 20 ]。当前,对于三叶青毛状根的研究还较少[ 21 ],为了解决这些问题,本研究建立了三叶青毛状根的诱导程序,初步建立了其液体培养体系,为三叶青毛状根培养、次生代谢物合成和代谢机理研究奠定了基础,同时希望起到保护三叶青野生资源的作用。
1 试验材料
三叶青苗(浙江理工大学植物学副教授杨宗岐博士鉴定)由杭州市三叶青农业科技有限公司提供,根据王静等人[ 22 ]的方法获得无菌试管苗。发根农杆菌(Agrobacterium rhizogenes)菌株C58C1和ATCC15834由本实验室保存。
2 试验方法
2. 1 培养基和培养条件
采用MS(Murashige and Skoog)培養基[ 23 ],并进行微调。毛状根诱导体系用培养基:(1)发根农杆菌培养基YEB:牛肉浸膏5 g·L-1、 酵母浸膏1 g·L-1、蛋白胨5 g·L-1、蔗糖30 g·L-1、MgSO4·H2O 0.5 g·L-1,pH:7.0~7.2。(2)叶片浸染液体培养基(ILD)(工作液浓度单位:mg·L-1,下同):MS+6-BA(6-卞基胺基嘌呤,6-Benzylaminopurine)2+NAA(萘乙酸,1-naph- thylacetic acid)0.5,蔗糖30 g·L-1,pH:5.2~5.4,灭菌后冷至室温,加AS 25。(3)叶片预培养培养基(PCM):MS+6-BA 2+NAA 0.5,蔗糖30 g·L-1,pH=5.8,植物凝胶2.7 g·L-1。(4)共感染培养基(CID):MS+6-BA 2+
NAA 0.5,蔗糖30 g·L-1,pH:5.2~5.4,植物凝胶2.7 g·L-1,灭菌后加AS 25。(5)除菌培养基(DM):MS+6-BA 2+NAA 0.5,蔗糖30 g·L-1,pH:5.8~6.0,植物凝胶2.7 g·L-1,特美汀(Timentin,Ti)200,头孢(Cefixime,cef)200。(6)毛状根筛选培养基(SM1):MS+NAA 0.3,蔗糖30 g·L-1,pH:5.8~6.0,植物凝胶2.7 g·L-1,Ti 200,cef 200。(7)毛状根继代培养基(SCD1):MS,蔗糖30 g·L-1,pH:5.8~6.0,植物凝胶2.7 g·L-1,Ti 200,cef 200;(8)毛状根继代培养基(SCD2):MS,蔗糖30 g·L-1,pH:5.8~6.0,植物凝胶2.7 g·L-1。(9)毛状根液体悬浮培养基(LSD):1/2MS,蔗糖30 g·L-1,pH:5.8~6.0。所有培养基经115 ℃,15 min灭菌,培养基降温至60 ℃以下时添加抗生素和AS。三叶青毛状根诱导培养和固体培养条件为25±2 ℃,暗培养;三叶青毛状根液体培养条件为25 ℃,转速110 r/min,暗培养。
2. 2 毛状根诱导
用无菌手术刀在三叶青无菌苗叶片表面划出伤口,接种到预培养培养基(PCM)预培养3天。期间,将-80 ℃保存的发根农杆菌ATCC15834和C58C1解冻后,取50 μL加入50 mL YEB液体培养基,摇床培养(28 ℃,220 r·min-1)16~18 h,OD600=0.4~
0.6。离心(4 ℃,5500 r·min-1,5 min),弃上清;用50 mL ILD悬浮菌体,摇床培养(25.5 ℃,150 r·min-1)1~1.5 h后,浸染预培养的三叶青叶片。室温下,将预培养的三叶青叶片放入含有ATCC15834和C58C1菌的ILD浸染液中,浸染5 min。用无菌滤纸吸干叶片表面菌液,转入CID培养基(培养基表面加一层无菌滤纸,用ILD润湿滤纸表面),共培养3天。然后,用无菌滤纸吸干叶片表面菌液,接入除菌培养基DM中培养7天,再将叶片转入SM培养基中除菌7~10天。不定根长度达0.5~2 cm时,将其切下,接种到SCD1培养基,每15天更换1次继代培养基。继代2次后,将毛状根接种到SCD2培养基,15天更换1次培养基。
2. 3 毛状根rol C基因的PCR检测
按照植物DNA提取试剂盒(天根,北京)的方法提取三叶青毛状根、无菌苗叶片的DNA。吸取菌液500 μL置于1.5 mL离心管,12 000 r·min-1离心2 min,去清液,加TE液100 μL(TE:10 mmo·L-1 Tris-HCl,1 mmo·L-1 EDTA,pH 8.0),重悬菌体,沸水煮5 min,12 000 r·min-1离心5 min,取上清于新离心管中,作为PCR检测中的阳性对照。
扩增rolC基因的引物为 RolC-f:5'-CTCCTGACATCAAACTCGTC-3',Rol C-r:5'-TGCTTCGAGTTATGGGTACA- 3',擴增长度为626 bp。PCR反应总体积为25 μL,含有dNTP 2 μL,10 × PCR buffer 2.5 μL,RolC-f 1 μL,RolC-r 1 μL,rTaq酶(Takara,大连)0.13 μL,DNA template 1.0 μL,ddH2O 17.37 μL。PCR反应程序为95 ℃预变性4 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸40 s的程序进行25个循环,循环结束后在72 ℃下延伸5 min。用2%琼脂糖凝胶电泳检测PCR扩增产物。
2. 4 毛状根液体培养
鉴定为阳性毛状根的根系,选取生长旺盛、分支多的毛状根根系,吸水纸吸净毛状根表面的液体,称取0.3 g,转入100 ml LSD中进行液体培养。
2. 5 总黄酮提取和含量测定
LSD1中培养60天的毛状根和2年生三叶青块根,用吸水纸吸干材料上的水分,冷冻真空干燥仪(SCIENTZ-12N,宁波)中进行低温冷冻干燥处理。干燥的毛状根采用研磨仪研成细粉,过100目筛。称取0.10 g样品置于25 mL试管中,加入50%乙醇5 mL,室温下超声(KQ-500DE,昆山,频率:40 kHz)1.5 h,取出后4 000 r·min-1离心10 min,上清移入10 mL容量瓶中,毛状根残渣用2 mL 50%乙醇润洗2次之后4 000 r·min-1离心10 min,上清移入上述容量瓶中,用50%乙醇定容至10 mL。平行重复3次。
吸取0.2 mg·mL-1的芦丁标准液(0.0,1.0,2.0,3.0,4.0,5.0,6.0 mL),置于25 mL容量瓶中,加50%乙醇至6 mL,加入5%亚硝酸钠溶液1 mL,快速摇匀,室温放置6 min;再加入10%硝酸铝溶液1 mL,摇匀,放置6 min;加入氢氧化钠试液10 mL,用50%乙醇定容至25 mL,摇匀,放置15 min。以“0.0”为空白对照,利用紫外可见分光光度计(UV5200,上海)于500 nm处测定光吸收值。以光吸收值为纵坐标,芦丁的浓度(mg·mL-1)为横坐标,绘制标准曲线,得线性回归方程。同理,吸取样品溶液2 mL置于25 mL容量瓶中,按标准曲线的绘制中所用的方法对样品溶液进行测定,依据标准曲线,计算样品中总黄酮的含量。
3 结果和分析
3. 1 三叶青毛状根诱导体系
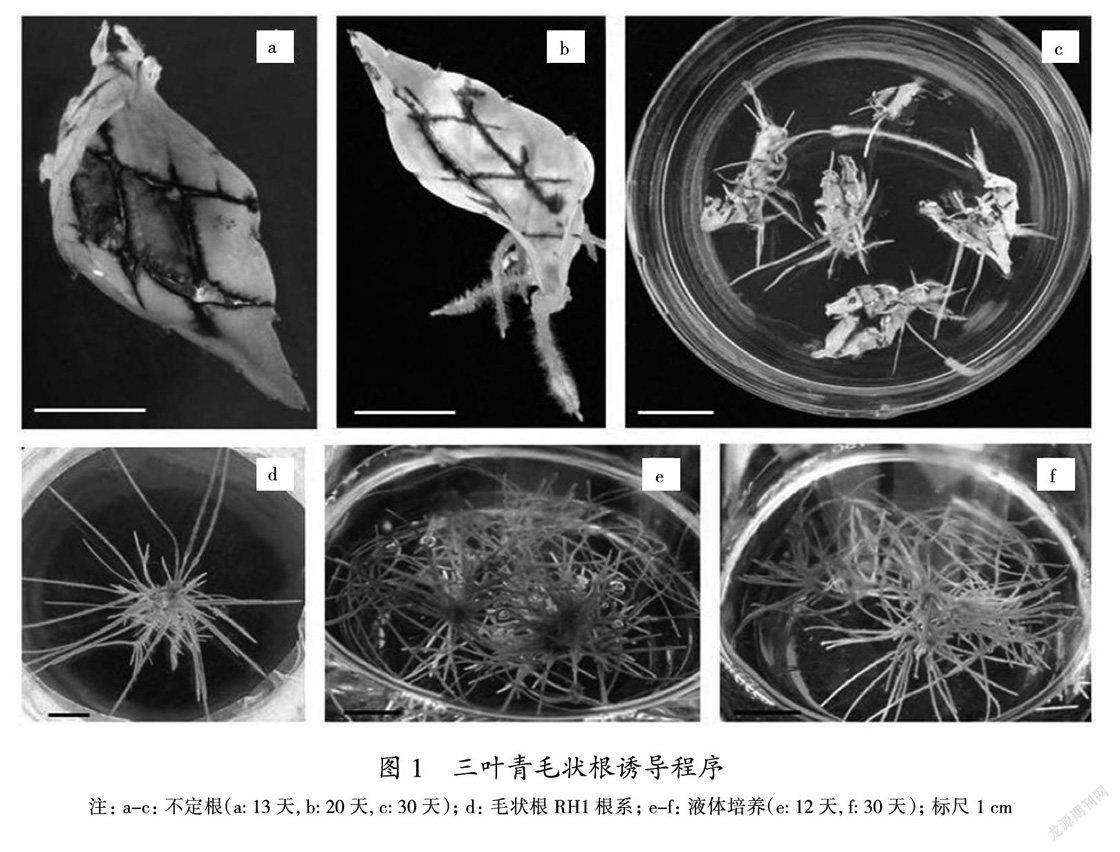
研究发现,发根农杆菌ATCC15834株系不能诱导三叶青毛状根。发根农杆菌C58C1浸染三叶青无菌苗离体叶片,13天时,叶片切口周围出现白色半透明的小突起(图1a)。20天时,切口突起处周围形成不定根(图1b),待不定根长至0.5~5 cm时(图1c),将长出的不定根从叶片切下,转至SCD1培养基,经过2~3次继代培养后除净农杆菌。在继代培养基SCD2上,大部分不定根由于没有生长素的作用而停止生长,少量不定根在30~40天时可见大量增殖(图1d),这些不定根为毛状根候选根系。
3. 2 三叶青毛状根PCR鉴定
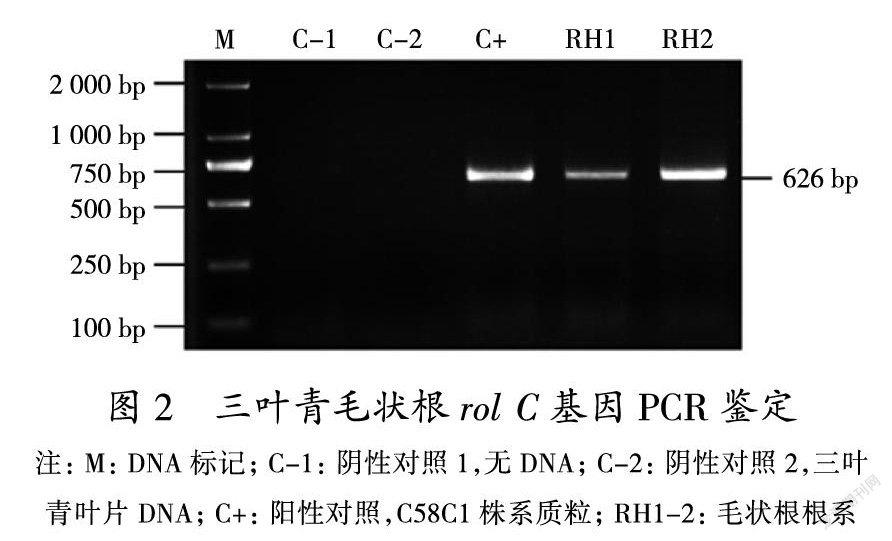
Rol C基因是Ri质粒上诱导毛状根生长的重要基因,也通常用于毛状根的鉴定。利用引物Rol C-f和Rol C-r对毛状根候选根系中的2个根系(RH1和RH2)、三叶青叶片以及C58C1质粒进行扩增。由三叶青毛状根rol C基因PCR鉴定结果(图2)可以看出,通过与Marker比较,阳性对照和2个毛状根候选根系在同一位置检测到了特异性扩增条带,2组阴性对照中没有检测到相关条带。这说明,RH1(图1d)和RH2两个候选根系为阳性毛状根系。从形态学来看,在没有添加植物生长素的情况下,RH1(图1d)根系发育良好,生长旺盛,分支较多,呈匍匐状分布在培养基表面,根尖的向地性减弱,而不定根(图1c)在生长到一定长度时,根能深入到固体培养基中生长,根的分支很少发生。
3. 3 三叶青毛状根液体培养
将在固体培养基上生长旺盛的毛状根RH1(图1d)转移到LSD中,12天新根长出(图1e),30天毛状根生长加快(图1f),一般可以培养到70天。扩大培养后,得到良好的三叶青毛状根培养体系,液体培养基中的三叶青毛状根呈圆形团块状,这应该与培养时所用圆底三角瓶形状和摇床的规律性圆周转动有关。毛状根中间部位颜色较深,越向外颜色越浅,中间的深色部位由老根形成,而周围颜色较浅的毛状根是新生长出来的。
3. 4 总黄酮测定
经测定,三叶青毛状根(RH1)中总黄酮的含量7.211 mg·g-1,显著(p<0.01),低于2年生三叶青块根中总黄酮含量(33.566 mg·g-1),前者约是后者的1/5。
4 结论和讨论
4. 1 发根农杆菌诱导产生毛状根的体系已在多种植物中得到研究,不同植物的诱导条件不尽相同,没有固定模式可循。菌株类型、菌液浓度、外植体类型选择、化学因子(例如外源激素和培养基成分)等条件均会影响毛状根诱导的效率,因此,针对不同植物的毛状根诱导需要筛选适宜的培养和转化条件。在本试验中,初步选择了发根农杆菌ATCC15834和C58C1两个菌株来探索不同菌株类型对于三叶青毛状根诱导的影响。我们发现ATCC15834菌株在试验条件下没能诱导出毛状根,而C58C1菌株则可以,而Du等人采用K599菌株获得了三叶青的毛状根[ 21 ]。这些可能与不同菌株对植物的感染能力差异导致的,包括植物的不同组织外植体,外植体的状态等[ 23 - 24 ]。因此,还需要进一步研究不同发根农杆菌菌株对三叶青不同组织的感染特性,最终获得稳定的遗传转化体系。
4. 2 三叶青毛状根(RH1)中总黄酮的含量7.211 mg·g-1,2年生三葉青块根中总黄酮含量33.566 mg·g-1,前者约是后者的1/5。Du等人利用重组型发根农杆菌K599诱导三叶青叶片产生毛状根,得到6个株系,其总黄酮含量最低为17.917 mg·g-1,最高为64.167 mg·g-1,均高于我们得到的毛状根[ 21 ]。这可能与实验室取材时间、发根农杆菌菌株以及采用的三叶青株系有关,其原因还需要进一步的研究。田思迪等人研究发现,NAA、IAA、IBA 在适宜的浓度下均能促进金铁锁毛状根的生长和皂苷积累[ 25 ];孙彬贤等人通过对MS , B5 , 6 .7-V 及White 4组液体培养基进行比较,人参毛状根的生物量和人参皂苷的含量在MS液体培养基中达到最大,且利用激素预处理有利于人参毛状根的培养[ 26 ]。三叶青毛状根在1/2MS液体培养基上增殖速率较慢且总黄酮含量较低,还需要通过改良培养基成分等对培养体系进行优化,获得更佳的培养体系。
4. 3 本研究采用发根农杆菌C58C1菌株、无菌叶片建立了三叶青毛状根诱导和初步培养体系,为加快其次生代谢物的积累、生物合成等研究提供了基础。然而,利用发根农杆菌诱导植物产生毛状根的过程较为复杂,影响因素较多,该体系还需要进一步优化,促进其生物量的快速增加,提高其次生代谢物的积累。
参考文献
[1] 国家中医药管理局《中华本草》编委会. 中华本草: 藏药卷[M]. 上海: 上海科学技术出版社, 2002.
[2] 南京中医药大学. 中药大辞典, 下册[M]. 上海: 上海科学技术出版社, 1977.
[3] 张胜强, 张洪艳, 黄建伟, 等. Notch1下调对三叶青黄酮抑制食管癌ec9706细胞迁移和侵袭的影响[J]. 中国实验方剂学杂志, 2017, 23(5): 162 - 167.
[4] Lin Z, Chen L, Qiu Q, et al. Isolation and identification of antiproliferative compounds from the roots of Tetrastigma hemsleyanum against MDA - MB - 435S cell lines[J]. Pakistan Journal of Pharmaceutical Sciences, 2016, 29(4): 1 171.
[5] 丁小鸽, 张春椿, 秦海燕, 等. 三叶青乙酸乙酯提取物对人胰腺癌PANC-1细胞凋亡的影响及机制研究[J]. 毒理学杂志, 2017, 31(3): 182 - 186.
[6] 袁雨, 朱炳喜, 刘军权, 等. 三叶青水提取物对nk细胞杀伤胃癌bgc-823细胞的影响[J]. 胃肠病学和肝病学杂志, 2016, 25(6): 633 - 637.
[7] 张祺箐, 冯正权. 三叶青黄酮干预荷癌小鼠treg细胞生成及其cd152表达的研究[J]. 新中医, 2017, 49(11): 5 - 8.
[8] Zhong L R, Chen X, Wei K M. Radix Tetrastigma hemsleyanum flavone induces apoptosis in human lung carcinoma a549 cells by modulating the mapk pathway[J]. Asian Pacific Journal of Cancer Prevention, 2013, 14(10): 5 983 - 5 987.
[9] 魏克民, 丁刚强, 浦锦宝, 等. 中草药三叶青抗肿瘤作用机制实验研究和临床应用[J]. 医学研究杂志, 2007, 11: 41 - 43.
[10] 陈红, 廖淑彬, 陈丹, 等. 闽产三叶青地上部分抗炎提取物的急性毒性研究[J]. 福建医科大学学报, 2017, 51(5): 287 - 290.
[11] 朱美晓, 鄢连和. 浙江省珍稀濒危畲药金线吊葫芦资源调查[J]. 中药材, 2014, 37(5): 766 - 770.
[12] Dai Y J, Shen Z G, Liu Y, et al. Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence, and chlorophyll content of Tetrastigma hemsleyanum Diels et. Gilg[J]. Environmental & Experimental Botany, 2009, 65(2): 177 - 182.
[13] 王静, 郭万里, 杨东风, 等. 珍稀药用植物三叶青的研究进展. 植物学研究, 2015, 4: 39 - 46.
[14] 彭昕, 张剑, 何军邀, 等. 三叶青松散型和致密型愈伤组织悬浮培养及黄酮积累的比较研究[J]. 中草药, 2012, 43(3): 577 - 580.
[15] 刘东, 杨峻山. 中国特有植物三叶青化学成分的研究[J]. 中国中药杂志, 1999(10): 35 - 36 + 62.
[16] 李瑛琦, 陆文超, 于治国. 三叶青的化学成分研究[J]. 中草药, 2003, 34(11): 982 - 983.
[17] 曾美玲, 沈耐濤, 吴赛伟, 等. 基于UPLC-Triple-TOF/MS方法的三叶青化学成分分析[J]. 中草药, 2017, 48(5): 874 - 883.
[18] Liu H X, He L, Huang R M, et al. Chemical constituents of the rhizomes of Tetrastigma hemsleyanum[J]. Chemistry of Natural Compounds, 2015, 51(6): 1 077 - 1 079.
[19] Ye C L, Liu X G. Extraction of flavonoids from Tetrastigma hemsleyanum Diels et. Gilg and their antioxidant activity[J]. Journal of Food Processing & Preservation, 2015, 39(6): 2 197 - 2 205.
[20] Abraham J, Thomas T D. Hairy root culture for the production of useful secondary metabolites[M]. Biotechnology and Production of Anti-Cancer Compounds. 2017.
[21] Du S, Xiang T, Song Y, et al. Transgenic hairy roots of Tetrastigma hemsleyanum: Induction, propagation, genetic characteristics and medicinal components[J]. Plant Cell Tissue & Organ Culture, 2015, 122(2): 373 - 382.
[22] 王静, 郭万里, 孔亚泽, 等. 珍稀药用植物三叶青的高效微繁体系研究[J]. 浙江理工大学学报, 2016, 35(7): 636 - 642.
[23] Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiol Plant, 2010, 15(3): 473 - 497.
[24] Sadiye H, Aynur G, Ismail H A, et al. Induction of Gentiana cruciata hairy roots and their secondary metabolites[J]. Biologia, 2011, 6(4): 618-625.
[25] 田思迪, 李云芳, 张宗申, 等. 影响金铁锁毛状根生长及皂苷积累的因素[J]. 时珍国医国药, 2012, 23(4): 824 - 826.
[26] 孙彬贤, 杨光孝, 汪沁琳, 等. 人参毛状根合成人参皂苷培养条件的优化[J]. 中成药, 2003, 25(9): 746 - 748.
