红根草三萜类化学成分的研究霍华珍 陈绍农 GuidoF.PAULI
2019-09-10蒋小华刘章彬李典鹏于洋
蒋小华 刘章彬 李典鹏 于洋

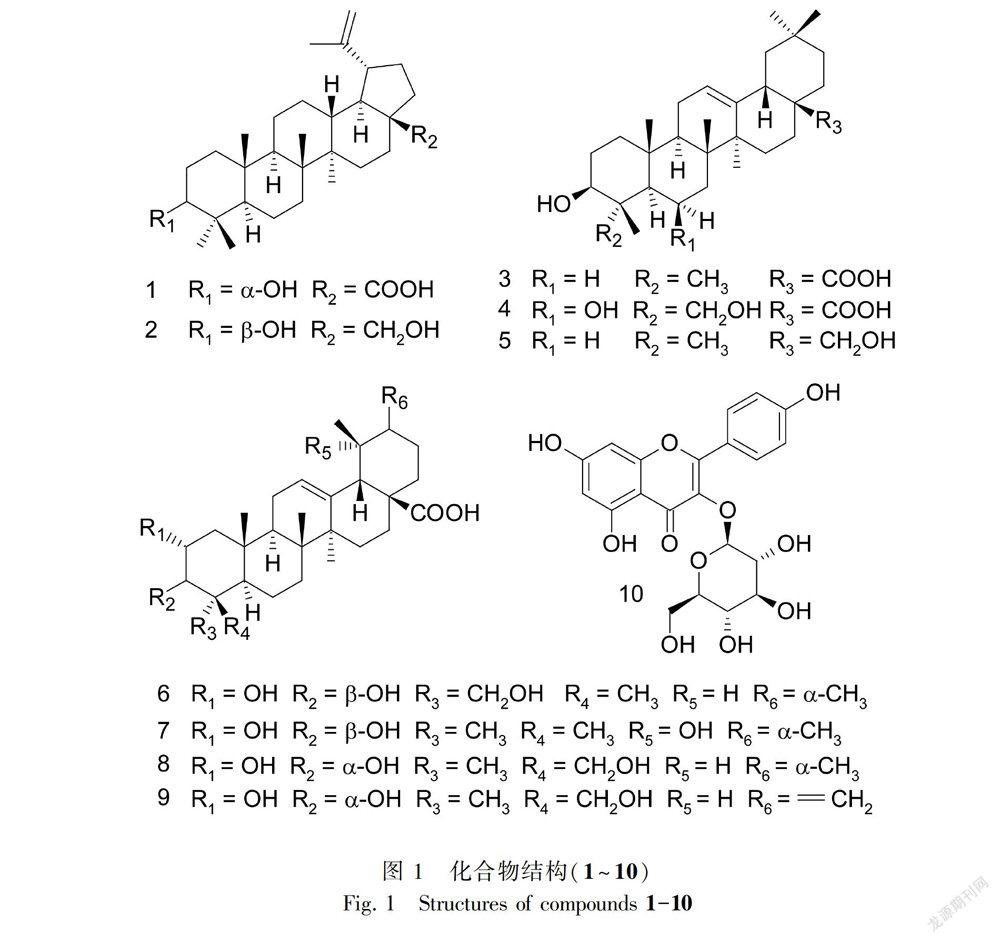


摘 要:该研究利用大孔吸附树脂D101、MCI树脂、正相硅胶、ODS、Sephadex LH-20和反相HPLC等多种色谱分离方法,对红根草95%乙醇提取物的乙酸乙酯萃取部位进行了分离。结果表明:通过分离共得到了10个化合物,经波谱数据分析鉴定为3-表-白桦脂酸(1)、白桦脂醇(2)、齐墩果酸(3)、3β, 6β, 23-三羟基-12-烯-28-齐墩果酸(4)、高根二醇(5)、2α, 3β, 23-三羟基-12-烯-28-乌苏酸(6)、2α, 3β, 19α-三羟基-12-烯-28-乌苏酸(7)、2α, 3α, 24-三羟基-12-烯-28-乌苏酸(8)、2α, 3α, 24-三羟基-12, 20(30)-二烯-28-乌苏酸(9)、山奈酚-3-O-葡萄糖苷(10)。其中,化合物1为首次从鼠尾草属植物中分离得到,化合物2、4、5、6、7、8、9、10为首次从该植物中分离得到。
关键词:红根草, 化学成分, 提取分离, 结构鉴定, 三萜
中图分类号:Q946.8
文献标识码:A
文章编號:1000-3142(2019)04-0516-07
Abstract:From a 95% ethanol extract of Salvia prionitis, ten compounds were isolated by means of various chromatographic techniques including column chromatography over macroporous resind101, MCI gel, silica gel, ODS, Sephadex LH-20, and reversed-phase HPLC. Their structures were elucidated using spectroscopicdata as 3-epi-betulinic acid(1), betulin(2), oleanic acid(3), 3β, 6β, 23-trihydroxyolean-12-en-28-oic acid(4), erythrodiol(5), 2α, 3β, 23-trihydroxyurs-12-en-28-oic acid(6), 2α, 3β, 19α-trihydroxyurs-12-en-28-oic acid(7), 2α, 3α, 24-trihydroxyurs-12-en-28-oic acid(8), 2α, 3α, 24-trihydroxyurs-12, 20(30)-dien-28-oic acid(9), and kaempferol-3-O-glucoside(10). Compound 1 was obtained from the genus of Salvia for the first time, and compounds 2, 4, 5, 6, 7, 8, 9, 10 were obtained from this plant for the first time.
Key words:Salvia prionitis, chemical constituents, extraction and isolation, structure identification, triterpenoids
红根草(Salvia prionitis)系唇形科鼠尾草属植物,主要分布在广西、广东、江西、浙江、安徽、湖南等地区,为民间常用草药。《中国植物志》亦有记载:“广西用全草入药,主治菌痢、腹泻、腹痛、感冒”(中国科学院中国植物志编委会,1977)。目前,国内外学者已从红根草中分离得到二萜、生物碱、植物甾醇类化合物等多种成分,其中二萜类化合物为其主要成分(Chang et al., 2005; Li et al., 2013),且一些二萜如红根草邻醌具有抗肿瘤的生物活性(Li et al., 2013)。为了更全面地了解红根草的化学成分以及寻找更多具有生物活性的化合物,本课题组从红根草的95%乙醇提取物的乙酸乙酯萃取部分分离得到10个化合物(图1)。其中,化合物1为首次从鼠尾草属植物中分离得到,化合物2、4、5、6、7、8、9、10为首次从红根草中分离得到。
1 材料与仪器
仪器:Avance 500 MHz超导核磁共振波谱仪,TMS为内标(瑞士Bruker公司);LCMS-IT-TOF液相色谱质谱联用仪(日本岛津公司);半制备液相色谱仪(北京赛谱锐思公司);YMC-Pack ODS-A制备HPLC色谱柱(250 mm × 10 mm, S-5 μm, 日本YMC公司);薄层色谱硅胶GF254及柱层析硅胶(青岛海洋化工厂);D101大孔吸附树脂(天津市海光化工有限公司);反相十八烷基硅烷键合硅胶ODS(日本YMC公司);MCI gel CHP20P(日本三菱化学控股株式会社);Sephadex LH-20(瑞士GE healthcare Bio-sciences AB公司);高效液相所用试剂为色谱纯,其他所用试剂均为分析纯,水为纯净水。
材料:红根草药材购自广西桂林六合路山边药材市场25号桂林百合堂生物科技公司(2016年11月),经广西壮族自治区中国科学院广西植物研究所唐辉研究员鉴定为唇形科鼠尾草属红根草(Salvia prionitis)。标本(编号20161114-1)存放于广西植物功能物质研究与利用重点实验室。
2 提取与分离
将干燥的红根草(全草)11.6 kg进行粉碎,用95%乙醇室温浸泡提取3次,每次5d。提取液减压浓缩得到浸膏325.4 g。提取浸膏加水悬浮用乙酸乙酯反复萃取3次,萃取液浓缩得到浸膏215.5 g。将萃取浸膏进一步经大孔吸附树脂柱色谱分离,用30%乙醇,50%乙醇,80%乙醇和95%乙醇梯度洗脱,各洗脱液分别减压浓缩后得到四个相应部分A(4.7 g)、B(3.9 g)、C(134.2 g)、D(41.3 g)。
C部分经MCI柱色谱分离,以甲醇-水(0~100%)梯度洗脱,10%为一个梯度,各梯度洗脱液分别减压浓缩后得到11个部分C1~C11。C10(83.4 g)经正相硅胶柱色谱分离,依次用石油醚-丙酮(100∶1、50∶1、20∶1、10∶1、8∶1、5∶1、3∶1、2∶1、1∶1、0∶1)梯度洗脱,TLC检测合并组分,浓缩后得到15个部分C10-1~C10-15。C10-8(4.5 g)经ODS柱色谱分离,依次用甲醇-水(0~100%)梯度洗脱,TLC检测合并组分,浓缩后得到12个部分C10-8-1~C10-8-12。C10-8-8经反相半制备HPLC(75% CH3OH, 含0.1% HCOOH)分离纯化得到化合物1(24 mg),2(70 mg)。C10-8-10经反相半制备HPLC(80% CH3OH, 含0.1% HCOOH)分离纯化得到化合物5(14 mg)。C10-13(3.6 g)经ODS柱色谱分离, 依次用甲醇-水(0~100%)梯度洗脱,TLC检测合并组分,减压浓缩后得到11个部分C10-13-1~C10-13-11。C10-13-9经Sephadex LH-20柱色譜分离得一混合物,进一步经反相半制备HPLC(82% CH3OH, 含0.1% HCOOH)分离纯化得到化合物3(106 mg)。C9(19.7 g)经硅胶柱色谱分离,依次用氯仿-甲醇(100∶1、50∶1、20∶1、10∶1、8∶1、5∶1、3∶1、2∶1、1∶1、0∶1)梯度洗脱,各洗脱液浓缩后得到10个部分C9-1~C9-10。C9-6(2.0 g)经ODS柱色谱分离,依次用甲醇-水(0~100%)梯度洗脱,TLC检测合并组分,浓缩后得到10个部分C9-6-1~C9-6-10。C9-6-6经反相半制备HPLC(60% CH3CN, 含0.1% HCOOH)分离纯化得到化合物7(5 mg)。C9-8(3.2 g)经ODS柱色谱分离,依次用甲醇-水(0~100%)梯度洗脱,TLC检测合并组分,浓缩后得到10个部分C9-8-1~C9-8-10。C9-8-5经Sephadex LH-20柱色谱分离得一混合物,进一步经反相半制备HPLC(65% CH3CN, 含0.1% HCOOH)分离纯化得到化合物9(9 mg);C9-8-6经反相半制备HPLC(65% CH3CN, 含0.1% HCOOH)分离纯化得到化合物4(15 mg)、6(8 mg)、8(12 mg)。C7(3.0 g)经ODS柱色谱分离,依次用甲醇-水(0~100%)梯度洗脱,TLC检测合并组分,浓缩后得到12个部分C7-1~C7-12。C7-8(0.2 g)经反相半制备HPLC(40% CH3CN)分离纯化得化合物10(40 mg)。
3 结构鉴定
化合物1 白色无定型粉末,HR-ESI-MS m/z:455.3471 [M-H]-(计算相对分子质量C30H47O3, 455.3531)。1H-NMR(500 MHz, CDCl3)δ:4.72(1H, brs, H-29b), 4.58(1H, brs, H-29a), 3.37(1H, m, H-3), 1.67(3H, s), 0.97(3H, s), 0.91(3H, s), 0.91(3H, s), 0.81(3H, s), 0.80(3H, s); 13C-NMR(125 MHz, CDCl3)δ:33.5(C-1), 25.6(C-2), 76.5(C-3), 37.7(C-4), 49.3(C-5), 18.5(C-6), 34.4(C-7), 41.1(C-8), 50.5(C-9), 37.5(C-10), 20.9(C-11), 25.7(C-12), 38.5(C-13), 42.7(C-14), 29.9(C-15), 32.4(C-16), 56.6(C-17), 49.5(C-18), 47.2(C-19), 150.6(C-20), 30.8(C-21), 37.3(C-22), 28.5(C-23), 22.3(C-24), 16.1(C-25), 16.3(C-26), 15.0(C-27), 180.4(C-28), 109.9(C-29), 19.6(C-30)。以上数据与文献(卢旭然等,2014)报道的3-表-白桦脂酸(3-epi-betulinic acid)数据一致。
化合物2 白色针状结晶,HR-ESI-MS m/z:425.3748 [M-H2O + H]+(计算相对分子质量C30H48O, 425.3778)。1H-NMR(500 MHz, CDCl3)δ:4.66(1H,d, J = 2.2 Hz, H-29b), 4.56(1H,dd, J = 2.2, 1.4 Hz, H-29a), 3.77(1H,d, J = 10.8 Hz, H-28b), 3.31(1H,d, J = 10.8 Hz, H-28a), 3.16(1H,dd, J = 11.4, 4.8 Hz, H-3), 1.66(3H, s), 1.00(3H, s), 0.95(3H, s), 0.94(3H, s), 0.80(3H, s), 0.73(3H, s); 13C-NMR(125 MHz, CDCl3)δ:38.9(C-1), 27.6(C-2), 79.2(C-3), 39.1(C-4), 55.5(C-5), 18.5(C-6), 34.5(C-7), 41.1(C-8), 50.6(C-9), 37.4(C-10), 21.1(C-11), 25.4(C-12), 37.5(C-13), 42.9(C-14), 27.3(C-15), 29.4(C-16), 48.0(C-17), 49.0(C-18), 48.0(C-19), 150.7(C-20), 30.0(C-21), 34.2(C-22), 28.2(C-23), 15.6(C-24), 16.3(C-25), 16.2(C-26), 15.0(C-27), 60.8(C-28), 109.9(C-29), 19.3(C-30)。以上数据与文献(Wei et al.,2013)报道的白桦脂醇(betulin)数据一致。
化合物3 白色无定型粉末,HR-ESI-MS m/z:455.3388 [M-H]-(计算相对分子质量C30H47O3, 455.3378)。1H-NMR(500 MHz, CDCl3)δ:5.28(1H, t, J = 3.4 Hz, H-12), 3.22(1H,dd, J = 11.3, 4.3 Hz, H-3), 2.82(1H,dd, J = 13.8, 4.0 Hz, H-18), 1.13(3H, s), 0.98(3H, s), 0.93(3H, s), 0.91(3H, s), 0.90(3H, s), 0.77(3H, s), 0.75(3H, s); 13C-NMR(125 MHz,CDCl3)δ:38.6(C-1), 27.4(C-2), 79.2(C-3), 38.9(C-4), 55.4(C-5), 18.5(C-6), 32.8(C-7), 39.5(C-8), 47.8(C-9), 37.3(C-10), 23.6(C-11), 122.8(C-12), 143.8(C-13), 41.8(C-14), 27.9(C-15), 23.1(C-16), 46.6(C-17), 41.2(C-18), 46.0(C-19), 30.8(C-20), 34.0(C-21), 32.6(C-22), 28.3(C-23), 15.7(C-24), 15.5(C-25), 17.3(C-26), 26.1(C-27), 183.1(C-28), 33.2(C-29), 23.7(C-30)。以上數据与文献(Carvalho & Seita,1992)报道的齐墩果酸(oleanic acid)数据一致。
化合物4 白色无定型粉末,HR-ESI-MS m/z:487.3357 [M-H]-(计算相对分子质量C30H47O5, 487.3429)。1H-NMR(500 MHz, CD3OD)δ:5.28(1H, t, J = 3.2 Hz, H-12), 4.39(1H,m,H-6), 3.60(1H,d, J = 11.0 Hz, H-23b), 3.55(1H,dd, J = 3.9, 11.8 Hz, H-3), 3.46(1H,d, J = 11.0 Hz, H-23a), 2.87(1H,dd, J= 3.7, 13.5 Hz, H-18), 1.32(3H, s), 1.14(3H, s), 1.09(3H, s), 1.06(3H, s), 0.95(3H, s), 0.91(3H, s); 13C-NMR(125 MHz, CD3OD)δ:41.7(C-1), 27.6(C-2), 73.8(C-3), 44.2(C-4), 49.4(C-5), 68.6(C-6), 41.2(C-7), 39.7(C-8), 49.3(C-9), 37.4(C-10), 24.5(C-11), 123.9(C-12), 144.5(C-13), 43.4(C-14), 28.8(C-15), 24.1(C-16), 47.7(C-17), 42.8(C-18), 47.2(C-19), 31.6(C-20), 34.9(C-21), 33.9(C-22), 66.7(C-23), 14.1(C-24), 17.7(C-25), 18.8(C-26), 26.5(C-27), 182.0(C-28), 33.6(C-29), 24.0(C-30)。以上数据与文献(于泉林等,2007)报道的3β, 6β, 23-三羟基-12-烯-28-齐墩果酸(3β, 6β, 23-trihydroxyolean-12-en-28-oic acid)数据一致。
化合物5 白色无定型粉末。1H-NMR(500 MHz, CDCl3)δ:5.19(1H, t, J = 3.5 Hz, H-12), 3.54(1H,d, J = 11.0 Hz, H-28a), 3.21(1H,d, J = 11.0 Hz, H-28b), 3.22(1H, m, H-3), 1.16(3H, s), 0.99(3H, s), 0.94(3H, s), 0.93(3H, s), 0.88(3H, s), 0.87(3H, s), 0.78(3H, s); 13C-NMR(125 MHz, CDCl3)δ:38.8(C-1), 27.4(C-2), 79.1(C-3), 38.9(C-4), 55.4(C-5), 18.5(C-6), 32.8(C-7), 40.0(C-8), 47.8(C-9), 37.1(C-10), 23.7(C-11), 122.7(C-12), 144.3(C-13), 41.9(C-14), 25.7(C-15), 22.2(C-16), 37.1(C-17), 42.5(C-18), 46.6(C-19), 31.1(C-20), 34.3(C-21), 31.1(C-22), 28.2(C-23), 15.7(C-24), 15.7(C-25), 16.9(C-26), 26.1(C-27), 69.8(C-28), 33.3(C-29), 23.7(C-30)。以上数据与文献(陶耀武等,2016)报道的高根二醇(erythrodiol)数据一致。
化合物6 白色无定型粉末,HR-ESI-MS m/z:487.3341 [M-H]-(计算相对分子质量C30H47O5, 487.3429)。1H-NMR(500 MHz, CD3OD)δ:5.24(1H, m, H-12), 3.70(1H, td, J = 10.5, 4.5 Hz, H-2), 3.51(1H,d, J = 11.0 Hz, H-23b), 3.36(1H,d, J = 9.8 Hz, H-3), 3.27(1H,d, J = 11.0 Hz, H-23a), 1.14(3H, s), 1.05(3H, s), 0.97(3H, m), 0.89(3H,d, J = 6.5 Hz), 0.85(3H, s), 0.70(3H, s); 13C-NMR(125 MHz, CD3OD)δ:48.0(C-1), 69.7(C-2), 78.2(C-3), 44.1(C-4), 48.2(C-5), 19.1(C-6), 33.6(C-7), 40.8(C-8), 48.8(C-9), 39.0(C-10), 24.5(C-11), 126.6(C-12), 139.8(C-13), 43.4(C-14), 29.2(C-15), 25.3(C-16), 48.5(C-17), 54.4(C-18), 40.4(C-19), 40.4(C-20), 31.8(C-21), 38.1(C-22), 66.3(C-23), 13.9(C-24), 17.7(C-25), 17.9(C-26), 24.1(C-27), 181.7(C-28), 17.7(C-29), 21.6(C-30)。以上数据与文献(杨勇勋等,2013)报道的2α, 3β, 23-三羟基-12-烯-28-乌苏酸(2α, 3β, 23-trihydroxyurs-12-en-28-oic acid)数据一致。
化合物7 白色无定型粉末。1H-NMR(500 MHz, C5D5N)δ:5.60(1H, m, H-12), 4.12(1H, td, J = 9.3, 3.0 Hz, H-2), 3.41(1H,d, J = 9.3 Hz, H-3), 3.07(1H, s, H-18), 1.73(3H, s), 1.45(3H, s), 1.29(3H, s), 1.14(3H,d, J = 7.0 Hz), 1.13(3H, s), 1.10(3H, s), 1.03(3H, s); 13C-NMR(125 MHz, C5D5N)δ:48.0(C-1), 68.7(C-2), 83.9(C-3), 40.0(C-4), 56.1(C-5), 19.1(C-6), 33.6(C-7), 40.6(C-8), 47.9(C-9), 38.6(C-10), 24.2(C-11), 128.3(C-12), 140.3(C-13), 42.3(C-14), 29.4(C-15), 26.5(C-16), 48.4(C-17), 54.7(C-18), 72.8(C-19), 42.5(C-20), 27.0(C-21), 38.6(C-22), 29.4(C-23), 17.7(C-24), 17.0(C-25), 17.4(C-26), 24.8(C-27), 180.8(C-28), 27.2(C-29), 16.9(C-30)。以上數据与文献(刘普等,2006)报道的2α, 3β, 19α-三羟基-12-烯-28-乌苏酸(2α, 3β, 19α-trihydroxyurs-12-en-28-oic acid)数据一致。
化合物8 白色无定型粉末,HR-ESI-MS m/z:487.3366 [M-H]-(计算相对分子质量C30H47O5, 487.3429)。1H-NMR(500 MHz, CD3OD)δ:5.23(1H, m, H-12), 3.91(1H,dt, J = 11.9, 2.4 Hz, H-2), 3.75(1H,d, J = 2.4 Hz, H-3), 3.65(1H,d, J = 11.4 Hz, H-24b), 3.38(1H,d, J = 11.4 Hz, H-24a), 1.14(3H, s), 1.09(3H, s), 0.97(3H, s), 0.96(3H, m), 0.89(3H,d, J = 6.4 Hz), 0.82(3H, s); 13C-NMR(125 MHz, CD3OD)δ:42.7(C-1), 67.0(C-2), 74.6(C-3), 45.4(C-4), 49.9(C-5), 19.3(C-6), 34.5(C-7), 40.9(C-8), 48.7(C-9), 39.1(C-10), 24.5(C-11), 126.7(C-12), 139.7(C-13), 43.3(C-14), 29.2(C-15), 25.3(C-16), 48.5(C-17), 54.4(C-18), 40.4(C-19), 40.4(C-20), 31.8(C-21), 38.1(C-22), 23.1(C-23), 65.8(C-24), 17.4(C-25), 17.6(C-26), 24.1(C-27), 181.9(C-28), 17.7(C-29), 21.6(C-30)。以上数据与文献(Liu et al.,2014)报道的2α, 3α, 24-三羟基-12-烯-28-乌苏酸(2α,3α,24-trihydroxyurs-12-en-28-oic acid)数据一致。
化合物9 白色无定型粉末。1H-NMR(500 MHz, CD3OD)δ:5.26(1H, m, H-12), 4.68(1H, s, H-30b), 4.63(1H, s, H-30a), 3.91(1H,dt, J = 11.6, 3.0 Hz, H-2), 3.75(1H,d, J = 2.0 Hz, H-3), 3.65(1H,d, J = 11.5 Hz, H-24b), 3.39(1H,d, J = 11.5 Hz, H-24a), 1.19(3H, s), 1.09(3H, s), 1.01(3H,d, J = 6.4 Hz), 0.97(3H, s), 0.82(3H, s); 13C-NMR(125 MHz, CD3OD)δ:42.7(C-1), 67.0(C-2), 74.6(C-3), 45.4(C-4), 49.9(C-5), 19.3(C-6), 34.5(C-7), 40.9(C-8), 48.7(C-9), 39.2(C-10), 24.6(C-11), 126.9(C-12), 139.5(C-13), 43.4(C-14), 29.2(C-15), 25.4(C-16), 49.2(C-17), 56.6(C-18), 38.6(C-19), 154.6(C-20), 33.4(C-21), 40.5(C-22), 23.1(C-23), 65.8(C-24), 17.4(C-25), 17.7(C-26), 24.0(C-27), 181.1(C-28), 16.8(C-29), 105.2(C-30)。以上数据与文献(董婧婧等,2011)报道的2α, 3α, 24-三羟基-12, 20(30)-二烯-28-乌苏酸(2α, 3α, 24-trihydroxyurs-12, 20(30)-dien-28-oic acid)数据一致。
化合物10 黄色针状结晶,HR-ESI-MS m/z:449.1133 [M+H]+(计算相对分子质量C21H21O11, 449.1078)。1H-NMR(500 MHz, CD3OD)δ:8.04(1H,d, J = 8.3 Hz, H-2′), 6.87(1H,d, J = 8.3 Hz, H-3′), 6.87(1H,d, J = 8.3 Hz, H-5′), 8.04(1H,d, J = 8.3 Hz, H-6′), 6.36(1H, s, H-8), 6.17(1H, s, H-6), 5.24(1H,d, J = 7.1 Hz, H-1″), 3.70(1H,dd, J = 11.8, 1.9 Hz, H-6″a), 3.54(1H,dd, J = 11.8, 5.4 Hz, H-6″b); 13C-NMR(125 MHz, CD3OD)δ:158.4(C-2), 135.5(C-3), 179.4(C-4), 163.0(C-5), 99.9(C-6), 166.0(C-7), 94.8(C-8), 159.0(C-9), 105.7(C-10), 122.7(C-1′), 132.3(C-2′), 116.0(C-3′), 161.5(C-4′), 116.0(C-5′), 132.3(C-6′), 104.2(C-1″), 75.7(C-2″), 78.0(C-3″), 71.3(C-4″), 78.3(C-5″), 62.6(C-6″)。以上数据与文献(马彦梅等,2009)报道的山奈酚-3-O-葡萄糖苷(kaempferol-3-O-glucoside)数据一致。
4 讨论
目前红根草主要用于中药复方制剂,如复方红根草胶囊、复方红根草片等,具有清热解毒、利咽消痈等功效(曾荣等,2006)。中国科学院上海药物研究所从红根草中提取分离,再经结构修饰优化得到一个全新的化合物沙尔威辛(salvicine),具有显著的体内外抗肿瘤活性(罗志国和冯奉仪,2005)。本研究从红根草中进行分离共得到了10个化合物,其中化合物1为首次从鼠尾草属植物中分离得到,化合物2、4、5、6、7、8、9、10为首次从该植物中分离得到。这些分离得到的化合物多为五环三萜类化合物,结构类型主要包括羽扇豆烷型、齐墩果烷型、乌苏烷型。五环三萜类化合物在植物体中种类较多,资源较为丰富。大量研究表明,五环三萜类化合物药理特性显著,具有抗炎、抗肿瘤等活性(李宏杨等,2009)。如3-表-白桦脂酸(1)具有抗炎作用(Reyes et al.,2006);白桦脂醇(2)具有抗肿瘤(宋添添等,2014)、抗菌、抗病毒(袁秋萍等,2013)作用;齐墩果酸(3)具有抗肿瘤作用(张明发等,2017)。这些五环三萜类化合物的抗炎、抗菌作用与红根草的药用功效相符合,因此这些五环三萜类化合物的发现不仅丰富了红根草的化学成分,而且为药用植物红根草的进一步研究提供了科学依据。
参考文献:
CARVALHO LM, SEITA J, 1993. A new oleanolic acidderivative from Securinega tinctoria [J]. Plant Med, 59(4):369-372.
CHANG J, XU J, LI M, et al., 2005. Novel cytotoxic seco-abietane rearrangedditerpenoids from Salvia prionitis [J]. Planta Med, 71(9):861-866.
DONG JJ,WANGdC, LI YS, et al., 2011. Chemical constituents of Rabdosia japonica var. glaucocalyx [J]. Lishizhen Med Mat Med Res, 22(10):2346-2348. [董婧婧, 王大成, 李玉山, 等, 2011. 藍萼香茶菜化学成分的研究 [J]. 时珍国医国药, 22(10):2346-2348.]
Editorial Committee of the Flora of China of Chinese Academy of Sciences, 1977. Flora Reipublicae Popularis Sinicae [M]. Beijing:Science Press, 66:151-152. [中国科学院中国植物志编委会, 1977. 中国植物志 [M]. 北京:科学出版社, 66:151-152.]
LIU QY, CHEN YS, WANG F, et al., 2014. Chemical of Vitex trifolia [J]. Chin J Chin Mat Med, 39(11):2024-2028.
LIU P,dUAN HQ, PAN Q, et al., 2006. Triterpenes from herb of Potentilla chinesis [J]. Chin J Chin Mat Med, 31(22):1875-1879. [刘普, 段宏泉, 潘勤, 等, 2006. 委陵菜三萜成分研究 [J]. 中国中药杂志, 31(22):1875-1879.]
LI MH, LI QQ, ZHANG CH, et al., 2013. An ethnopharmacological investigation of medicinal Salvia plants(Lamiaceae) in China [J]. Acta Pharm Sin B, 3(4):273-280.
LI HY, LIU GM, LIU F, et al., 2009. Research of ursolic acid and similar pentacyclic triterpenoid [J]. J Hunan Univ Technol, 23(5):18-21. [李宏杨, 刘国民, 刘飞, 等, 2009. 熊果酸及五环三萜同类物的研究进展 [J]. 湖南工业大学学报, 23(5):18-21.]
LU XR, LIU S, WANG MY, et al., 2014. Triterpenoids from Stauntonia obovatifoliola Hayata subsp. intermedia stems [J]. Chin J Chin Mat Med, 39(23):4629-4636. [卢旭然, 刘烁, 王满元, 等, 2014. 五指那藤三萜类化学成分研究 [J]. 中国中药杂志, 39(23):4629-4636.]
LUO ZG, FENG FY, 2005. Preclinical study for anticancerdrug salvicine, a new topoisomerase Ⅱ inhibitor [J]. Chin J Newdrugs, 14(2):140-142. [罗志国, 冯奉仪, 2005. 新型抗肿瘤药物拓扑异构酶Ⅱ抑制剂沙尔威辛的临床前研究 [J]. 中国新药杂志, 14(2):140-142.]
MA YM, ZHOU WM, LI BQ, 2009. Flavonoids in Oxytropis latibracteata Jurtz. [J]. J NW For Univ, 24(1):140-141. [马彦梅, 周文明, 李炳奇, 2009. 宽苞棘豆黄酮类化学成分的研究 [J]. 西北林学院学报, 24(1):140-141.]
REYES CP, NU'NEZ MJ, JIME'NEZ IA, et al., 2006. Activity of lupane triterpenoids from Maytenus species as inhibitors of nitric oxide and prostaglandin E2 [J]. Bioorg Med Chem, 14(5): 1573-1579.
SONG TT, MOU Y, ZHANG GY, 2014. Anti-tumor effects of betulin and its mechanism in vivo [J]. World Chin Med, 9(7):916-918, 922. [宋添添, 牟瑛, 张桂英, 2014. 白桦脂醇的体内抗肿瘤作用及机制 [J]. 世界中医药, 9(7):916-918, 922.]
TAO YW, TIAN Y, XU WD, et al., 2016. Terpenoids from Euphorbia micractina [J]. Acta Pharm Sin, 51(3):411-419. [陶耀武, 田冶, 许文东, 等, 2016. 甘青大戟中的萜类化学成分 [J]. 药学学报, 51(3):411-419.]
WEI XH, YANG SJ, LIANG N, et al., 2013. Chemical constituents of Caesalpiniadecapetala(Roth) Alston [J]. Molecules, 18(1):1325-1336.
YU QL,GAO WY, ZHANG YW, et al., 2007. Studies on chemical constituents in herb of Centella asiatica [J]. Chin J Chin Mat Med, 32(12):1182-1184. [于泉林, 高文远, 张彦文, 等, 2007. 积雪草化学成分研究 [J]. 中国中药杂志, 32(12):1182-1184.]
YANG YX, YAN YM, TAO M, et al., 2013. Chemical constituents from leaves of Rhododendron rubiginosum var. rubiginosum [J]. Chin J Chin Mat Med, 38(6):839-843. [杨勇勋, 晏永明, 陶明, 等, 2013. 红棕杜鹃(原变种)叶的化学成分研究 [J]. 中国中药杂志, 38(6):839-843.]
YUAN QP, CHEN J, NI TT, 2013. Study of the betulin application in meat products [J]. Food Ind, 34(11):78-80. [袁秋萍, 陈劼, 倪婷婷, 2013. 白桦脂醇在肉制品中的應用研究 [J]. 食品工业, 34(11):78-80.]
ZHANG MF, SHEN YQ, 2017. Research progress on vascular pharmacologic effects of oleanolic and ursolic acids [J].drug Eval Res, 40(10):1510-1519. [张明发, 沈雅琴, 2017. 熊果酸和齐墩果酸的血管药理作用研究进展 [J]. 药物评价研究, 40(10):1510-1519.]
ZENG R, YAN M, LIU JC, 2006.determination of andrographolide anddehydrated andrographolide in compound rhizome capsules through HPLC [J]. J Trad Chin Med Univ Hunan, 26(4):25-26, 28. [曾嵘, 阎敏, 刘建存, 2006. HPLC测定复方红根草胶囊中穿心莲内酯和脱水穿心莲内酯含量 [J]. 湖南中医学院学报, 26(4):25-26, 28.]
