啶氧菌酯降解菌的分离鉴定及其降解特性研究
2019-09-10祝腾辉罗香文李聪张德咏刘勇
祝腾辉 罗香文 李聪 张德咏 刘勇
摘要:【目的】篩选可高效降解啶氧菌酯的微生物资源,并研究其降解特性,为啶氧菌酯等甲氧基丙烯酸酯类农药残留的微生物修复提供新资源。【方法】采用富集培养法分离啶氧菌酯降解菌,以生理生化特征结合16S rRNA序列系统发育分析鉴定降解菌;利用气相色谱仪(HPLC)测定啶氧菌酯残留量,分析其降解特性;采用气相色谱质谱联用仪(GCMS)测定降解菌降解啶氧菌酯的中间代谢产物,分析降解菌降解啶氧菌酯的代谢途径。【结果】分离获得一株能以啶氧菌酯为唯一碳源的降解菌株(PY3),其生理生化特征结合16S rRNA序列系统发育分析结果表明,PY3菌株属沼泽红假单胞菌(Rhodopseudomonas palustris)。PY3菌株最佳生长条件测定和降解特性分析结果表明,PY3菌株生长和降解啶氧菌酯的最佳条件为pH 6.0、35 ℃,在最佳降解条件下培养11 d,对50 mg/L啶氧菌酯的降解率可达72.0%。PY3菌株降解啶氧菌酯的途径包括苯环和N杂环间氧桥键断裂后酯化,以及苯环和N杂环开环反应。【结论】沼泽红假单胞菌PY3菌株具有高效降解啶氧菌酯的活性和较广的pH和温度耐受性,且具有应用于农田生态环境中啶氧菌酯等甲氧基丙烯酸酯类农药残留物微生物修复的潜力。
关键词: 啶氧菌酯;分离;鉴定;沼泽红假单胞菌;降解特性
中图分类号: S481.8;X592 文献标志码: A 文章编号:2095-1191(2019)06-1256-07
Abstract:【Objective】The microorganisms which could effectively degrade picoxystrobin were selected and their degrading characteristics were analyzed. It would provide new resources for microbial remediation of methoxy acrylates pesticide residue such as picoxystrobin. 【Method】Picoxystrobin degrading strains were isolated by enrichment culture, and the degrading strains were analyzed and identified through physiological, biochemical characteristics and phylogenetic analysis of 16S rRNA gene sequences. Residue of picoxystrobin was quantified by gas chromatograph(HPLC), and the degrading characteristics were also studied. Metabolics of picoxystrobin in degrading process were identified by gas chromatograph-mass spectrometer(GCMS), and metabolic pathways of degrading process of the strain on picoxystrobin were analyzed. 【Result】A degrading strain PY3 which took picoxystrobin as the only carbon source was isolated. Physiological, biochemical characteristics and phylogenetic analysis of 16S rRNA sequences indicated that strain PY3 was Rhodopseudomonas palustris. The optical growth and degrading picoxystrobin conditions of strain PY3 were pH 6.0 and 35 ℃. Under the optimal degradation conditions, up to 72.0% of 50 mg/L picoxystrobin could be degraded by strain PY3 in 11 d. Metabolic pathways of picoxystrobin degraded by strain PY3 included oxygen bridge bond between benzene ring and N-containing heterocyclic ring braking and ring-opening reaction of benzene ring and N-containing heterocyclic ring. 【Conclusion】R. palustris PY3 has excellent picoxystrobin degradation capacity and broad pH and temperature tolerance. It can be applied to repair of methoxy acrylates pesticide residues such as picoxystrobin in field eco-environment.
Key words: picoxystrobin; isolation; identification; Rhodopseudomonas palustris; degrading characteristics
收稿日期:2018-12-19
作者简介:*为通讯作者,刘勇(1966-),博士,研究员,主要从事植物病害综合防控技术研究工作,E-mail:haoasliu@163.com。祝腾辉(1993-),研究方向为农药残留微生物修复,E-mail:1039711761@qq.com
0 引言
【研究意义】啶氧菌酯是一种高效甲氧基丙烯酸酯类杀菌剂,其作用机理是通过抑制病原菌细胞色素b和C1间的电子转移,从而抑制线粒体的呼吸作用,即线粒体呼吸抑制剂(Guan et al.,2011)。啶氧菌酯的内吸活性很强,对锈病和叶斑病具有优异的防控效果(赵平等,2011)。目前,啶氧菌酯在我国的登记范围正逐步扩大,已登记用于水稻稻曲病等病害的防控(阮宏椿等,2013)。随着啶氧菌酯应用范围的扩展和使用量的上升,其对环境中非靶标的潜在毒性及生态环境安全风险成为业界关注的热点。最新研究表明,啶氧菌酯对非靶标生物蚯蚓具有中等毒性(Wang et al.,2012);高剂量啶氧菌酯对家蚕具有记性毒性和发育毒性(谢道燕等,2014)。除了对非靶标具有急性毒性外,更严重的是,长期暴露下啶氧菌酯对非靶标生物还具有潜在的慢性毒性。啶氧菌酯对蟾蜍蝌蚪具有致畸性,48 h的半致畸性浓度低至61.00~84.13 μg/L(Li et al.,2016)。但啶氧菌酯对非靶标的慢性毒性机制目前尚不明确,因此,啶氧菌酯残留的生态风险,以及如何消除啶氧菌酯在农田生态环境中的残留污染已成为当前急需解决的环境问题。【前人研究进展】在自然环境中,甲氧基丙烯酸酯类农药的降解方式主要有光分解、水解和微生物分解等(孙建光等,2008)。关于甲氧基丙烯酸酯类农药的微生物降解研究中,Hocinatab和Boudemagha(2016)从活性淤泥中筛选到可高效降解多种甲氧基丙烯酸酯类杀菌剂的芽孢杆菌属(Bacillus)菌株。Wołejko等(2016)从土壤中筛选到能够降解啶氧菌酯及其他多种甲氧基丙烯酸酯类杀菌剂的复合微生物菌群,从复合微生物菌群中还筛选获得一株高效降解酵母菌;相比复合微生物菌群,单个微生物菌株的降解效率更高。此外,采用选择性培养基筛选到的降解菌还包括假单胞菌属(Pseudomonas)和苍白杆菌属(Ochrobactrum)等,这些降解菌均能降解包括啶氧菌酯在内的多种甲氧基丙烯酸酯类杀菌剂(Howell et al.,2014)。深入的降解机理研究表明,啶氧菌酯微生物降解的初始步骤为酯键断裂,相应的降解酶基因鉴定为甲氧基丙烯酸酯甲基酯酶基因(Clinton et al.,2011);吳龙飞等(2016)研究也得到相似的结果,红假单胞菌降解啶氧菌酯的初始步骤为断裂其酯键。然而,啶氧菌酯降解初始步骤之后的降解步骤尚需进一步探究。【本研究切入点】已报道许多降解菌资源本身可能具有环境风险,如假单胞菌属降解菌的生物安全性需进一步试验研究,才能应用于啶氧菌酯污染的生物修复。因此,筛选更多优异的降解菌资源,将有助于啶氧菌酯等甲氧基丙烯酸酯类农药微生物修复的产业化应用。此外,对啶氧菌酯降解初始步骤之后的代谢产物目前研究较少,限制了降解微生物应用的环境安全性分析。【拟解决的关键问题】采用富集培养法筛选能以啶氧菌酯为唯一碳源的啶氧菌酯降解菌,以生理生化特征结合16S rRNA序列系统发育分析鉴定降解菌;利用高效液相色谱仪(HPLC)测定啶氧菌酯残留量,分析降解菌的降解特性;采用气相色谱质谱联用仪(GCMS)测定降解菌降解啶氧菌酯的中间代谢产物,分析降解菌降解啶氧菌酯的代谢途径,为农田啶氧菌酯残留的微生物修复提供新资源。
1 材料与方法
1. 1 试验材料
1. 1. 1 主要培养基 筛选和分离培养基(无碳源MSM培养基):NH4NO3 1.0 g/L、NaCl 0.5 g/L、(NH4)2SO4 0.5 g/L、KH2PO4 0.5 g/L、K2HPO4 1.5 g/L、pH 7.0;选择培养基:在MSM培养基(无碳源)中分别加入质量浓度为50、100和150 mg/L的啶氧菌酯;相应的固体培养基为对应的培养基中添加1.5%琼脂糖。
1. 1. 2 主要试剂及仪器设备 啶氧菌酯原药(有效成分含量96%,武汉鸿睿康试剂有限公司);农药残留萃取及检测所用试剂均为色谱纯。HPLC(e2695,Waters,美国),GCMS(Agilent 6890N,美国)。
1. 2 啶氧菌酯降解菌富集培养及分离纯化
从位于湖南长沙县春华基地农田排水渠采集底泥,取2.0 g底泥添加到120 mL的MSM培养基中,并添加啶氧菌酯使其终浓度为50 mg/L,于35 ℃、3000 lx光照培养至浑浊或有明显颜色变化,取0.5%菌液接种至终浓度为100 mg/L啶氧菌酯的MSM培养基中,培养条件同上,重复以上步骤至啶氧菌酯浓度为150 mg/L。使用终浓度为150 mg/L啶氧菌酯的双层MSM固体培养基,划线法分离降解菌。挑取形态不同的菌落至含150 mg/L啶氧菌酯的MSM液体培养基中,培养至菌液浓度为109 CFU/mL,作为后续试验的接种液。
1. 3 分离菌株鉴定
1. 3. 1 生理生化特征鉴定 分离菌株的生理生化特征鉴定参照《常见细菌系统鉴定》(蔡妙英和东秀珠,2001)。
1. 3. 2 分离菌株活细胞吸收光谱测定 低速离心分离菌株培养液,取沉淀用0.9%生理盐水洗涤3次,然后用0.9%生理盐水重悬浮,用分光光度计测定分离菌株细胞在波长300~900 nm的吸收值。
1. 3. 3 分离菌株16S rRNA序列测定及系统发育分析 采用CTAB法提取分离菌株基因组DNA;以细菌总DNA为模板,用细菌16S rRNA序列通用引物(27F:5'-AGAGTTTGATCATGGCTCAg-3';1492R:5'-
GGTACCTTGTTACGACTT-3')进行PCR扩增。PCR反应体系(20.0 µL):10×PCR Buffer 2.5 µL,dNTP(10 µmol/L)0.5 µL,上、下游引物各0.5 µL,DNA聚合酶 0.5 µL,ddH2O 15.0 µL。扩增程序:94 ℃预变性2 min;94 ℃ 50 s,52 ℃ 50 s,72 ℃ 1 min,进行30个循环;72 ℃延伸10 min。PCR产物以1.0%琼脂糖凝胶电泳检测,回收目的条带,参照全式金至pEASY-T1 Cloning Kit使用说明将目的片段连接gcffpEASY-T1克隆载体并转化大肠杆菌,挑取单菌落进行PCR验证,阳性菌落送生工生物工程(上海)股份有限公司测序。所得基因序列在GenBank进行BLAST比对分析。运用ClastW进行序列联配分析,采用MEGA 7.0构建Neighbor-Joining系统发育进化树。
1. 4 分离菌株最佳生长条件测定
在120 mL的MSM培养基(pH 7.0)中,接种0.5%的分离菌菌液,分别置于15、25、35、45和50 ℃下进行光照培养,5 d后测定菌液在波长660 nm处的吸光值。分别在pH 4.0、5.0、6.0、7.0、8.0和9.0的MSM培养基中接种0.5%的分离菌菌液,35 ℃下光照培养,5 d后测定菌液在波长660 nm处的吸光值。每处理3个重复。
1. 5 不同初始条件啶氧菌酯降解试验
于120 mL的MSM培养基(pH 7.0)中添加啶氧菌酯至终浓度为50 mg/L,再接种0.5%的分离菌菌液,分别于15、25、35、45和50 ℃光照条件下培养,5 d后萃取啶氧菌酯,采用HPLC检测啶氧菌酯残留量。分别在pH 4.0、5.0、6.0、7.0、8.0和9.0的MSM培养基中接种0.5%的分离菌菌液,然后添加啶氧菌酯至终浓度为50 mg/L,35 ℃光照条件下培养,5 d后萃取啶氧菌酯,采用HPLC检测啶氧菌酯残留量。每处理3个重复。
1. 6 啶氧菌酯最佳条件下降解动态
于MSM培养基(pH 7.0)中接种0.5%分离菌菌液,添加啶氧菌酯至终浓度为50 mg/L,35 ℃光照条件下培养,分别于培养1、3、5、7、9 和11 d取样,采用HPLC检测啶氧菌酯残留量。
1. 7 啶氧菌酯残留量测定
采用正己烷萃取净化啶氧菌酯,HPLC测定啶氧菌酯残留量(罗香文等,2016)。柱温30 ℃,检测波长225 nm,上样量10 μL,流速1 mL/min,流动相30∶70=水∶乙腈。以啶氧菌酯标准品定性定量,所有试验重复3次。
1. 8 啶氧菌酯降解中间代谢产物测定
定期取样,采用正己烷萃取中间代谢产物,用GCMS进行扫描鉴定(吴龙飞等,2016)。仪器鉴定条件:色谱柱为HP-5MS(30 m×0.25 mm×0.25 µm);采用全扫描方式,质量范围50~550 eV;电子轰击能70 eV;进样口温度220 ℃,氦气流量1.0 mL/min。升温程序:初始温度120 ℃,保持3 min,以10 ℃/min的速度升温至200 ℃,再以5 ℃/min速度升温,终止温度250 ℃,保持5 min;离子源温度230 ℃;四极杆温度150 ℃。
2 结果与分析
2. 1 菌株的分离和鉴定结果
2. 1. 1 菌株分离及形态和生理生化特征 采用啶氧菌酯為唯一碳源的选择性培养基筛选获得一株菌落为红色的菌株,命名为PY3。革兰氏染色结果显示,PY3菌株为革兰氏阴性、短杆状;生理生化鉴定结果显示,PY3菌株的甲基红反应和V-P反应呈阴性,柠檬酸盐反应和过氧化氢酶反应呈阳性,吲哚试验呈阴性,不能水解淀粉。
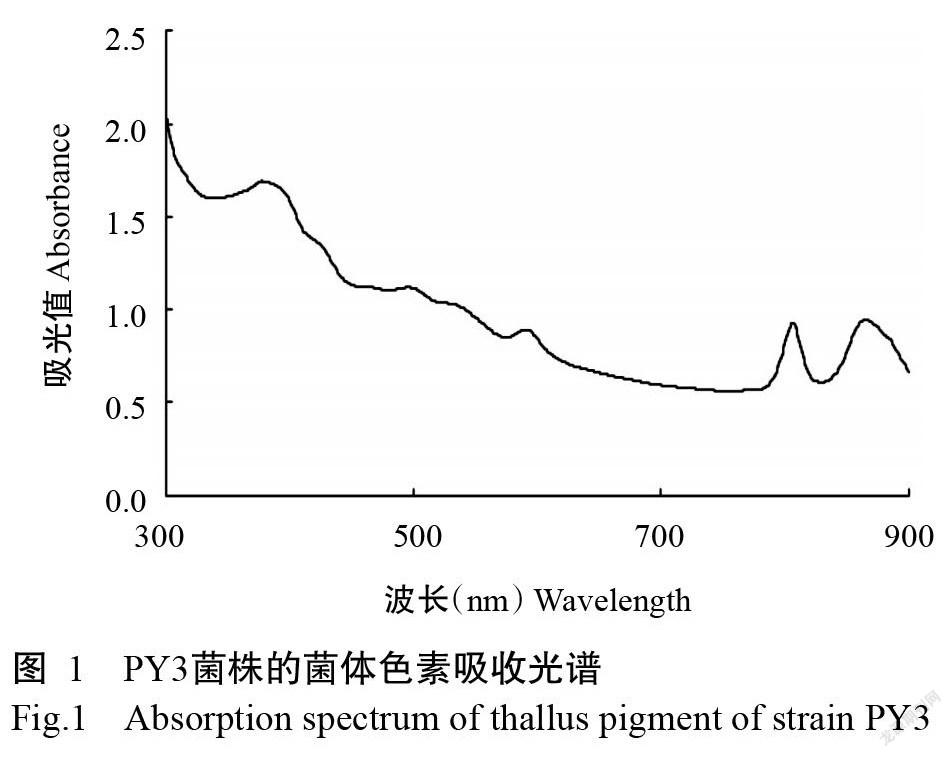
2. 1. 2 菌体色素扫描结果 PY3菌株菌体色素扫描结果如图1所示,菌体色素在波长360、590、820和880 nm处有明显的吸收峰,表明PY3菌株的菌体中存在类胡萝卜素和菌绿素(Yin et al.,2012)。
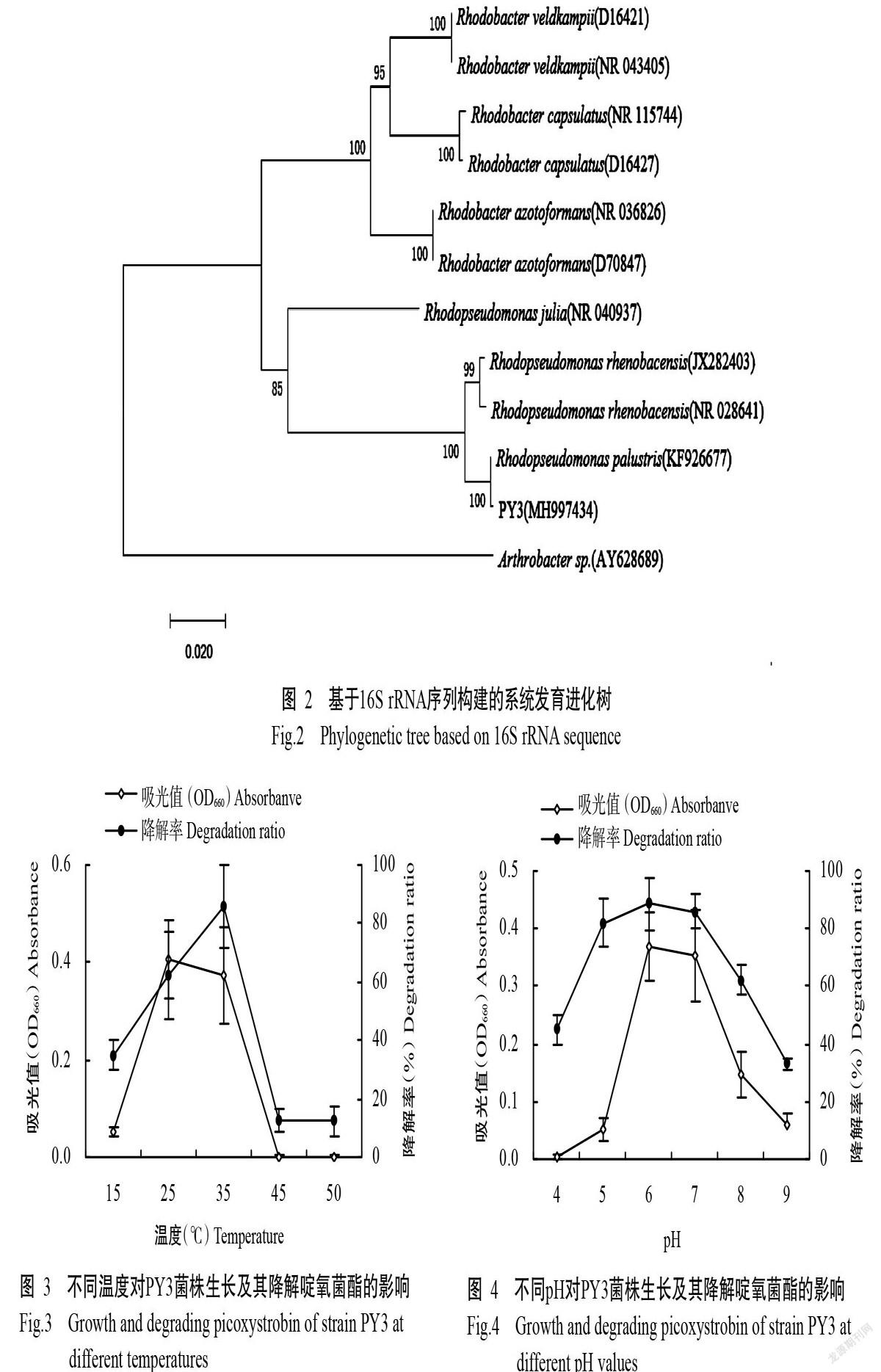
2. 1. 3 PY3菌株16S rRNA序列系统发育分析 PY3菌株测定获得的16S rRNA序列长度为1374 bp(GenBank登录号MH997434),与沼泽红假单胞菌(KF926677)的同源性最高,达100%。进一步的系统发育进化树分析结果(图2)表明,PY3菌株与Rhodopseudomonas palustris(KF926677)的亲缘关系较近,聚为一个亚簇。
2. 2 PY3菌株最佳生长条件测定结果
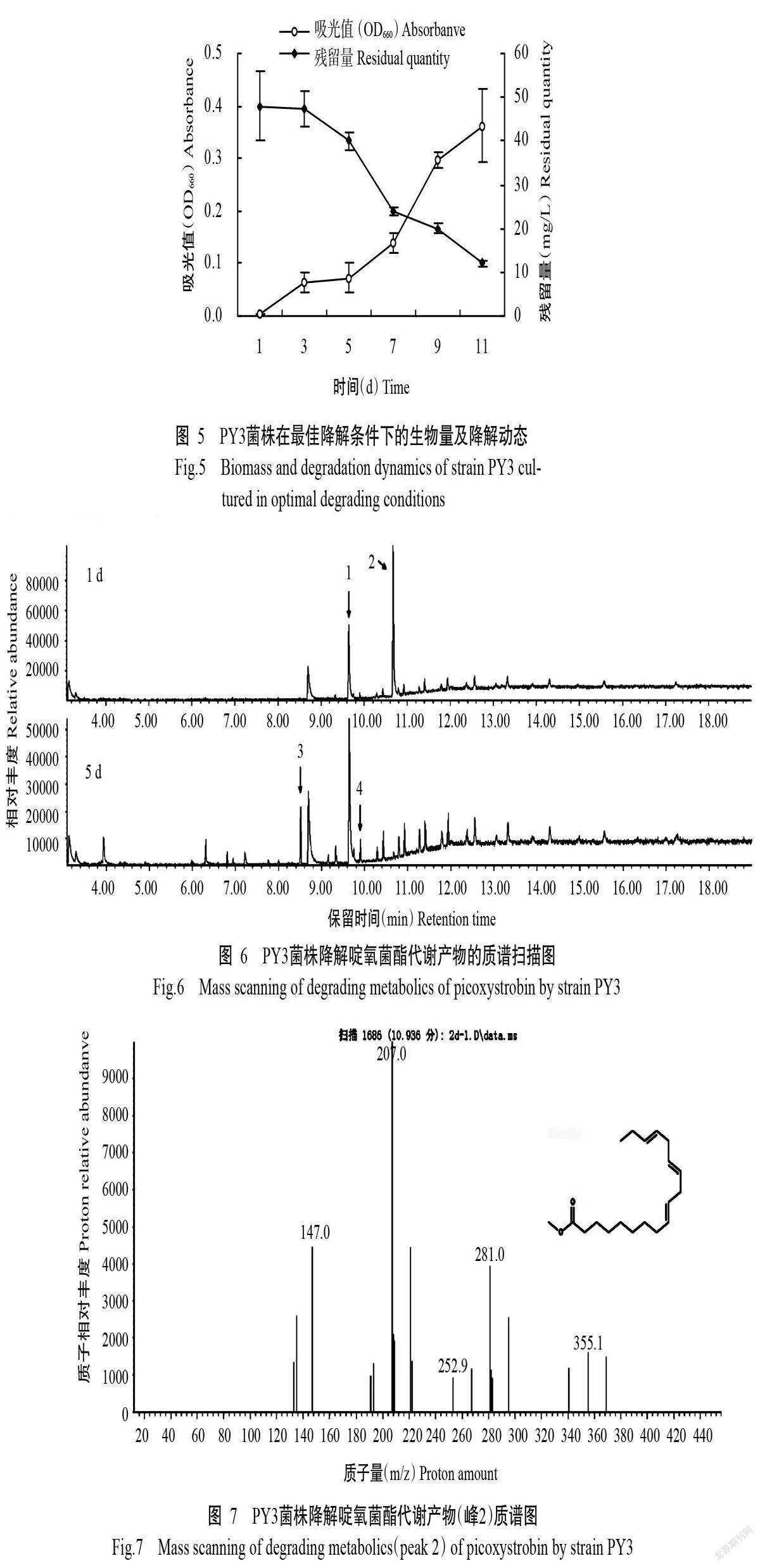
PY3菌株在不同pH和温度条件下的生长结果(图3和图4)表明,PY3菌株在25~35 ℃、pH 6~8内生长良好,其最佳生长条件为pH 6、35 ℃。
2. 3 PY3菌株的降解特性
2. 4 最适条件下啶氧菌酯降解动态
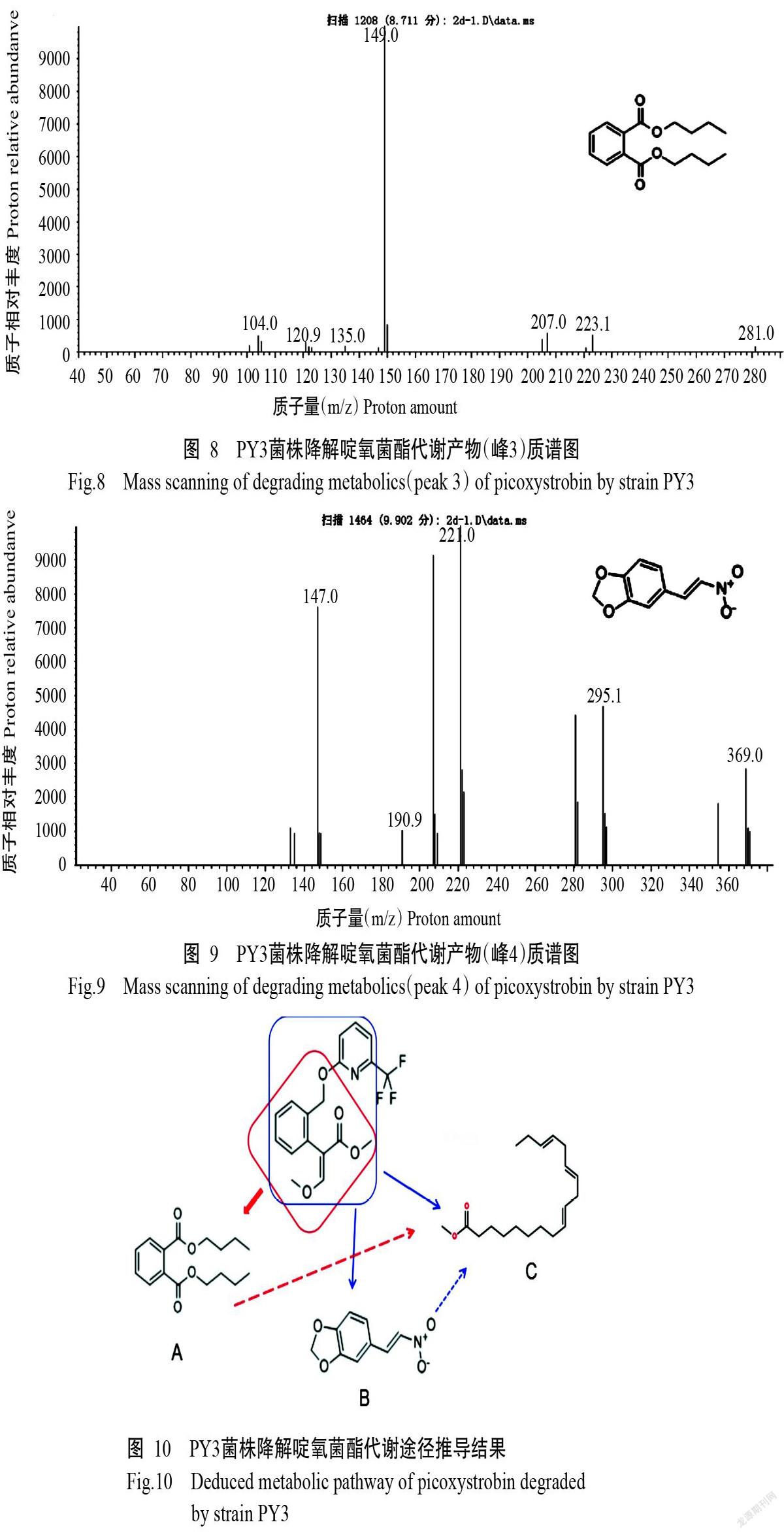
如图5所示,在最佳降解条件下(pH 6、35 ℃)培养1~5 d时,PY3菌株的生物量累积较慢,其降解啶氧菌酯的效率较低;培养7 d后,随PY3菌株的生物量快速增加,其降解啶氧菌酯的效率快速上升;培养11 d时,接种PY3菌株处理的啶氧菌酯残留量为12 mg/L,降解率为72%。
2. 5 PY3菌株降解啶氧菌酯的机制
2. 5. 1 PY3菌株降解啶氧菌酯中间代谢产物分析 采用GCMS扫描鉴定PY3菌株降解啶氧菌酯的中间代谢产物,结果(图6)显示,培养1 d时,啶氧菌酯快速降解为中间产物峰2,随后中间产物峰2快速降解,产生中间产物峰3和峰4;与培养1 d相比,培养5 d时啶氧菌酯的残留量下降约20%(峰1)。培养5 d时,GSMS扫描图上有一些峰的丰度上升,表明这些中间代谢产物的生成量上升。
谱库检索结果(图7~图9)表明,PY3菌株降解啶氧菌酯的中间产物分别为:啶氧菌酯(峰1)、9,12,15-Octadecatrienoic acid(保留时间10.9363 min,峰2)、Dibutyl phthalate(保留时间8.711 min,峰3)和3,4-Methylene dioxy-β-nitrostyrene(保留时间9.902 min,峰4)。
2. 5. 2 推导的降解途径 依据GCMS鉴定的中间代谢产物,PY3菌株降解啶氧菌酯推导的降解途径包括苯环和N杂环间氧桥键断裂后酯化,生成产物A;苯环和N杂环开环反应,产生中间代谢B和C;中间产物A也可能降解为产物C(图10)。
3 讨论
啶氧菌酯是甲氧基丙烯酸酯类杀虫剂,目前在我国的登记范围和使用量正逐步上升(赵平等,2011),而残留于农田生态环境中的啶氧菌酯量也随之增加,其对生态环境的潜在威胁日益成为业界关注的热点。本研究利用富集培养法分离到一株能以啶氧菌酯为唯一碳源生长的PY3菌株,鉴定为沼泽红假单胞菌(R. palustris)。沼泽红假单胞菌是典型的光合细菌,现有研究表明,光合细菌是一类益生菌,在农业部微生物肥料登记的微生物分类中被定义为A.1菌株,无需进行毒理学试验。光合细菌在环境污染物(Haritash and Kaushik,2009)和杀虫剂(Luo et al.,2018)等修复方面具有较好的应用前景。
本研究结果表明,PY3菌株生长和降解啶氧菌酯具有较好的pH和温度耐受性,与已报道的降解菌降解特性类似(Howell et al.,2014; Hocinatab and Boudemagha,2016;Wołejko et al.,2016;李兵和张博,2017),表明该菌株具有较好的环境适应性,具有应用于我国大部分地区农田生态环境中啶氧菌酯残留微生物修复的潜力。
对甲氧基丙烯酸酯类杀菌剂的降解机理研究表明,微生物降解甲氧基丙烯酸酯类杀菌剂的基因为甲氧基丙烯酸酯甲基酯酶基因(Strobilurin me-thyl esterase),酯化啶氧菌酯的-O-键(Clinton et al.,2011)。吴龙飞等(2016)研究表明,红假单胞菌PID-1降解啶氧菌酯的降解途径包含啶氧菌酯的-O-键断裂和苯环测链氧化,以及苯环开环反应等降解步骤。本研究中,PY3菌株降解啶氧菌酯的降解途径除酯化啶氧菌酯的-O-键外,还能将啶氧菌酯的N杂环打开,表明PY3菌株可能编码降解啶氧菌酯的新基因,这些新降解基因的克隆与定性研究将是下一步的研究重点,其研究结果有助于解析PY3菌株降解啶氧菌酯的机制,也为构建高效降解甲氧基丙烯酸酯类杀菌剂残留物的工程菌提供科学依据。
4 结论
运用富集培养法分离到一株能以啶氧菌酯为唯一碳源生长的光合细菌PY3菌株,鉴定为沼泽红假单胞菌。PY3菌株具有高效降解啶氧菌酯的活性和较广的pH和温度耐受性,且具有应用于农田生态环境中啶氧菌酯等甲氧基丙烯酸酯类农药残留物微生物修复的潜力。
参考文献:
蔡妙英,东秀珠. 2001. 常见细菌系统鉴定手册[M]. 北京:科学出版社. [Cai M Y,Dong X Z. 2001. Manual for systematic identification of common bacteria[M]. Beijing:Science Press.]
李兵,张博. 2017. 高效长链烷烃降解菌ZKNU01的选育及其降解特性[J]. 河南农业大学学报,51(2):226-229. [Li B,Zhang B. 2017. Screening of a high-efficiency long-chain alkane-degrading bacteria ZKNU01 and its degradation characteristics[J]. Journal of Henan Agricultural University,51(2):226-229.]
羅香文,严清平,陈武瑛,陈昂,李宗云,杨芳,刘勇. 2016. 土壤和水中啶氧菌酯的环境行为研究[J]. 农业环境科学学报,35(5): 926-930. [Luo X W,Yan Q P,Chen W Y,Chen A,Li Z Y,Yang F,Liu Y. 2016. Environmental behaviors of picoxystrobin in soils and water[J]. Journal of Agro-Environment Science,35(5): 926-930.]
阮宏椿,杨秀娟,石妞妞,杜宜新,甘林,陈福如. 2013. 不同杀菌剂对水稻稻曲病菌的室内毒力及田间药效[J]. 福建农业学报,28(6): 580-583. [Ruan H C,Yang X J,Shi N N,Du Y X,Gan L,Chen F R. 2013. Toxicity and field efficiency of several fungicides against Ustilaginoidea virens[J]. Fujian Journal of Agricultural Sciences,28(6):580-583.]
孙建光,姜瑞波,任天志,王立刚,徐晶. 2008. 我国农田和水体污染及微生物修复前景[J]. 中国农业资源与区划,29(1): 41-47. [Sun J G,Jiang R B,Ren T Z,Wang L G,Xu J. 2008. Prospect for farmland and water pollution and microorganisme repair in China[J]. Chinese Journal of Agricultural Resource and Regional Planning,29(1): 41-47.]
吴龙飞,罗香文,刘勇,李梦晴,杜娇,张德咏. 2016. 啶氧菌酯降解菌的分离鉴定及其降解特性[J]. 浙江农业学报,28(9):1550-1557. [Wu L F,Luo X W,Liu Y,Li M Q,Du J,Zhang D Y. 2016. Isolation and degrading characteristics of picoxystrobin degrading strain[J]. Acta Agriculturae Zhejiangensis,28(9):1550-1557.]
谢道燕,杨振国,田梅金,柴建萍,刘永光,黄平,罗雁婕. 2014. 7种杀菌剂对桑树及家蚕的安全性评价[J]. 中国农学通报,30(22): 310-315. [Xie D Y,Yang Z G,Tian M J,Chai J P,Liu Y G,Huang P,Luo Y J. 2014. Safety evaluation of seven fungicides to Morus alba and Bombyx mori[J]. Chinese Agricultural Science Bulletin,30(22): 310-315.]
赵平,严秋旭,李新,张敏恒. 2011. 甲氧基丙烯酸酯类杀菌剂的开发及抗性发展现状[J]. 农药,50(8):547-549. [Zhao P,Yan Q X,Li X,Zhang M H. 2011. Current status of resistance and development of strobilurin fungicide[J]. Agrochemicals,50(8): 547-549.]
Clinton B,Warden A C,Haboury S,Easton C J. 2011. Bacterial degradation of strobilurin fungicides: A role for a promiscuous methyl esterase activity of the subtilisin protea-ses?[J]. Biocatalysis and Biotransformation,29(4): 119-129.
Guan A Y, Liu C L, Li M,Zhang H,Li Z N,Li Z M. 2011. Design,synthesis and structure-activity relationship of novel coumarin derivatives[J]. Pest Management Science,67(6): 647-655.
Haritash A K,Kaushik C P. 2009. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs): A review[J]. Journal of Hazardous Materials,169(1-3): 1-15.
Hocinatab A,Boudemagha A. 2016. Biodegradation of commercial Ortiva fungicide by isolated actinomycetes from the activated sludge[J]. Desalination and Water Treatment,57(13): 6091-6097.
Howell C C,Semple K T,Bending G D. 2014. Isolation and characterisation of azoxystrobin degrading bacteria from soil[J]. Chemosphere,95: 370-378.
Li D,Liu M Y,Yang Y H,Shi H H,Zhou J L,He D F. 2016. Strong lethality and teratogenicity of strobilurins on Xeno-pus tropicalis embryos: Basing on ten agricultural fungicides[J]. Environmental Pollution,208(Part B): 868-874.
Luo X W,Zhang D Y,Zhou X G,Du J,Zhang S B,Liu Y. 2018. Cloning and characterization of a pyrethroid pesticide decomposing esterase gene,Est3385,from Rhodopseudomonas palustris PSB-S[J]. Scentific Reports,8:7384.
Wang Y H,Wu S G,Chen L P,Wu C G,Yu R X,Wang Q,Zhao X P. 2012. Toxicity assessment of 45 pesticides to the epigeic earthworm Eisenia fetida[J]. Chemosphere,88(4): 484-491.
Wołejko E,Łozowicka B,Kaczyński P,Jankowska M,Piekut J. 2016. The influence of effective microorganisms(EM) and yeast on the degradation of strobilurins and carboxa-mides in leafy vegetables monitored by LC-MS/MS and health risk assessment[J]. Environmental Monitoring and Assessment,188(1): 64.
Yin L B,Li X H,Liu Y,Zhang D Y,Zhang S B,Luo X W. 2012. Biodegradation of cypermethrin by Rhodopseudomonas palustris GJ-22 isolated from activated sludge[J]. Fresenius Environment Bulletin,21(2a): 397-405.
(責任编辑 麻小燕)
