一株李氏禾内生细菌去除Cr(VI)的特性
2019-09-10韩文陈海珊袁治豪秦舒琴陈慧英
韩文 陈海珊 袁治豪 秦舒琴 陈慧英

摘 要:李氏禾(Leersia hexandra)是中國境内发现的第一种铬超积累植物,该文对李氏禾内生菌及其除铬性能进行了研究。采用添加Cr(VI) 的牛肉膏蛋白胨固体平板培养方法,从李氏禾根部分离筛选获得一株具有较强Cr(VI)抗性的内生细菌G04,分子生物学鉴定结果表明该菌株属于阴沟肠杆菌(Enterobacter cloacae)。采用摇瓶培养方法,以Cr(VI)去除率、总Cr(铬)的去除率以及菌体生物量为指标,考察了pH、温度、底物浓度、装液量、接种量、摇床转速以及反应时间等因素对Cr(VI)去除率、总铬去除率和菌株生长的影响。结果表明:在牛肉膏蛋白胨液体培养基中,菌株E. cloacae G04去除Cr(VI)的较优反应条件为初始pH5.0、温度37 ℃、Cr(VI)浓度为100 mg·L-1、装液量80 mL(250 mL三角瓶)、接种量15%、摇床转速为120 r·min-1、反应时间48 h。在此条件下,菌株E. cloacae G04对Cr(VI)和总铬的去除率分别为84%和8%。根据Cr(VI)去除率和总铬去除率的结果推测该菌株去除Cr(VI)的机制可能是以还原为主、吸附为辅。这表明李氏禾内生细菌E. cloacae G04菌株具有较好的应用潜力,既有可能直接用于土壤、水环境铬污染的修复,也有可能作为促植物修复铬污染的后备菌株,另外可为深入研究李氏禾的铬积累作用机制提供参考。
关键词:李氏禾, 内生细菌, 阴沟肠杆菌, Cr(VI), 还原
中图分类号:Q946, X172
文献标识码:A
文章编号:1000-3142(2019)06-0729-08
Abstract:Leersia hexandra is a chromium hyper-accumulative plant which was firstly found in China. The endophytic bacteria of L. hexandra and their removal capacity for Cr(VI) were studied. A Cr(VI)-resistant endophytic bacterium G04 was isolated from the roots of L. hexandra by solid plate culture method using the media of beef extract peptone containing Cr(VI). Biological identification results showed the strain belonged to Enterobacter cloacae. Effects of culture conditions, such as initial pH, temperature, Cr(VI) concentration, liquid volume, inoculation amount, shaking speed and culture time, on the removal rate of Cr(VI), removal rate of total Cr and the growth of the strain were studied in detail by shaking flask culture. The results showed that the optimal conditions for the removal of Cr(VI) by E. cloacae G04 were initial pH of 5.0, culture temperature of 37 ℃, substrate concentration of 100 mg·L-1, liquid volume of 80 mL in 250 mL conical flask, inoculum size of 15%, shaking speed of 100 r·min-1 and culture time of 48 h. Under these conditions, the removal rate of Cr(VI) and total chromium were about 84% and 8%, respectively. The results of this study indicate that the endophytic bacteria Enterobacter cloacae G04 has better application potential for removing chromium. It may be used directly for remediation of soil and water environment contaminated of chromium, and also may be used as alternative strain for promoting plant remediation of chromium pollution. Furthermore, the result has an important refe-rence value for illuminating the mechanism of chromium hyper-accumulation of L. hexandra.
Key words:Leersia hexandra, endophytic bacteria, Enterobacter cloacae, hexavalent chromium [(Cr(VI)], reduction
随着现代化技术的发展,重金属铬在制药、电镀等多领域中得到了广泛的应用。但与此同时,环境中的铬及其化合物的污染问题也越来越严重。长期接触铬及铬化合物容易对胃肠道系统、免疫系统、肝脏和肾脏产生影响甚至诱发呼吸系统癌症(Costa,1997)。各种铬形态中,主要以铬酸根和重鉻酸根形式存在的Cr(VI)被认为是毒性最强的(Shanker et al.,2005;王新建和刘健,2010)。国际上对铬污染的水体、土壤都提倡采用生物修复法,即借助微生物或植物的絮凝、吸收累积、富集等作用去除重金属离子(Chibuike & Obiora,2014;Malik et al.,2010)。从铬重金属污染的环境中分离的白色杆菌属(Leucobacter sp.)(Ge et al.,2013)、假单胞菌属(Pseudomonad)(Zhang et al.,2016)、链霉菌属(Streptomyces griseus)(Chen et al.,2014;Poopal & Laxman,2008)、芽孢杆菌属(Bacillus sp.)(Alsalamah,2011;Dhal et al.,2010)和栖热菌属(Thermusscotoductus)(Opperman & Van,2007)都具有较好的Cr(VI)去除能力。
超富集植物具有生物量大、对重金属吸附量是常规植物的10~500倍、可在重金属污染土壤中生长良好等优势(石润等,2015),在环境污染修复中的应用日益广泛(Brooks et al.,1998)。与此同时,超富集植物内生菌的研究也开始受到研究者的重视,如As(砷)超富集植物蜈蚣草(董睿智,2012)、Zn(锌)超富集植物东南景天(龙新宪等,2013)、Cd(镉)超累积植物龙葵(曹喆等,2009)、Mn(锰)超积累植物商陆(卢文显,2015)等均有研究报道。李氏禾(Leersia hexandra)是张学洪等(2007)在广西桂林发现的铬超积累植物,也是第一种在中国境内被发现的铬超积累植物,研究表明其对Cr(Ⅲ)和Cr(VI)都有较强的富集能力(胡澄,2008;陈俊等,2008;卢媛媛等,2013)。但目前利用李氏禾内生细菌对重金属Cr(VI)进行还原的研究尚未见报道。本研究对铬超富集植物李氏禾中的内生细菌进行分离、筛选、鉴定及除Cr(VI)特性进行研究,为李氏禾内生菌在铬污染修复中的应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 原料 Cr(铬)超富集植物李氏禾,采自桂林理工大学环境科学与工程学院实验室。
1.1.2 培养基 固体培养基:牛肉膏3 g·L-1,蛋白胨10 g·L-1,氯化钠5 g·L-1,琼脂20 g·L-1,其余为蒸馏水,pH为7.0。
液体培养基:牛肉膏3 g·L-1,蛋白胨10 g·L-1,氯化钠5 g·L-1,其余为蒸馏水,pH为7.0。
含Cr(VI)培养基:在牛肉膏蛋白胨固/液体培养基的基础上,加入相应质量的重铬酸钾配制而成。
1.2 Cr(VI)抗性内生细菌的分离、筛选取健康的李氏禾根根部组织,用水冲洗干净后,无菌条件下用70%的酒精浸泡40 s,然后用2.5%次氯酸钠浸泡2 min,最后用无菌水冲洗6次,去除附着在材料表面的消毒剂。无菌条件下用最后一遍冲洗的无菌水涂布于固体平板培养基,培养后无微生物长出,表明表面消毒彻底。无菌条件下取适量经表面消毒的根部组织,加1 mL 0.9%的氯化钠溶液充分研磨,取1 mL研磨液接种于100 mL牛肉膏蛋白胨液体培养基中(500 mL三角瓶),37 ℃,120 r·min-1条件下振荡培养2 d,将培养液按10-2、10-3、10-4、10-5、10-6进行稀释,分别取20 μL用平板涂布器涂布在含Cr(VI)浓度分别为100~1 000 mg·L-1的牛肉膏蛋白胨平板培养基上,37 ℃恒温培养24~48 h后,根据菌落的生长情况,挑选长势较好、耐铬性能强的菌落,接入含铬平板中,采用划线法进行多次的分离纯化,获得了Cr(VI)抗性内生菌纯培养物,并将菌株接种于试管斜面培养基上,37 ℃恒温培养24 h后,4 ℃冰箱保存。
1.3 Cr(VI)抗性细菌的鉴定
采用细菌基因组DNA提取试剂盒(生工生物工程(上海)有限公司)对Cr(VI)抗性内生细菌G04基因组进行提取。PCR扩增反应体系:2×Taq DNA聚合2 μL,酶25 μL,模板2 μL,引物1492R和27F各2 μL,ddH2O 19 μL,混匀后置于PCR扩增仪。其程序:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,72 ℃后延伸5 min,30个循环。用1%的琼脂糖凝胶、0.5×TBE为电泳缓冲液、80 V电压进行PCR产物的琼脂糖凝胶电泳。将G04菌株DNA的PCR产物经琼脂糖凝胶电泳检测后,送往生工生物工程(上海)有限公司进行检测。检测的结果登录美国的NCBI网(http://blast.ncbi.nlm.nih.gov/)进行DNA的Blast比对,确定菌株归属。
1.4 内生细菌G04去除Cr(VI)实验
试管斜面保存的菌株G04经牛肉膏蛋白胨固体培养基平板活化,于37 ℃恒温培养箱中培养24 h后,挑取2环接种于含100 mL牛肉膏蛋白胨液体培养基的250 mL三角瓶中,37 ℃、120 r·min-1振荡培养24 h后作为种子液。以不接种的牛肉膏蛋白胨液体培养基同法处理,作为后续除Cr(VI)试验中接种培养的空白对照。
将种子液按10%接种量接种于含Cr(VI)浓度为100 mg·L-1、pH为7(用2 mol·L-1的氢氧化钠和盐酸溶液调节)的牛肉膏蛋白胨液体培养基(装液量100 mL/250 mL三角瓶)中,八层纱布封口,置于37 ℃的恒温水平摇床上120 r·min-1振荡培养。培养适当时间后,无菌条件下取样适量培养液,10 000 r·min-1离心10 min,去除菌体和其他悬浮杂质。沉淀用蒸馏水溶液混匀,测定OD600下吸光度值,上清液用于测定Cr(Ⅵ)的浓度和总Cr(铬)的浓度。上述步骤中,以不接种微生物的牛肉膏蛋白胨液体培养基代替种子液同法操作,作为空白对照。
1.5 Cr(VI)和总Cr(铬)的测定
Cr(VI)标准曲线的绘制:分别取5 mg·L-1的Cr(VI)标准溶液0、0.2、0.4、0.8、1.2、1.6、2.0 mL于10 mL刻度比色管中,用蒸馏水至刻度后,分别加入(1+1)的硫酸和磷酸各0.1 mL后,加入0.4 mL二苯碳酰二肼溶液,摇匀。待充分反应5~10 min后,测定样品在540 nm波长处的吸光度值。以Cr(VI)浓度为横坐标,对应540 nm处的吸光度值为纵坐标,绘制Cr(VI)标准曲线。
Cr(VI)的测定:取1.0 mL待测含Cr(VI)试样,加水稀释至10 mL。取1 mL含铬稀释液,加入到10 mL比色管中,用蒸馏水稀释至刻度,加入(1+1)硫酸0.1 mL 和(1+1)磷酸0.1 mL,摇匀。加入0.4 mL二苯碳酰二肼溶液,摇匀。5~10 min后,于540 nm波长处比色测定。在标准曲线上查得Cr(VI)浓度,求得质量后按式(1)计算Cr(VI)去除率。
Cr(VI)去除率=Cr(VI)初始质量-Cr(VI)残余质量Cr(VI)初始质量×100%(1)
总Cr(铬)的测定:取1.0 mL待测含Cr(VI)试样,加水稀释至10 mL。取1 mL含铬稀释液,和(1+1)磷酸0.1 mL,摇匀。加入4%高锰酸钾溶液滴,如紫红色消退,则继续滴加高锰酸钾溶液至保持紫红色。加热煮沸至溶液约剩4 mL。冷却后,加入0.2 mL 20%的尿素溶液,摇匀。用滴管加2%亚硝酸钠溶液,每加一滴充分摇匀,至紫红色刚好消失。稍停片刻,待溶液内气泡逸尽,转移10 mL比色管中,稀释至标线,按Cr(VI)的测定方法比色测定。按式(2)计算总铬去除率。
总铬去除率=理论总铬质量-残余总铬质量理论总铬质量×100%(2)
Cr(VI)和总铬去除率最终结果均扣除空白对照,以排除培养基成分对反应的影响。
1.6 统计分析
采用Micrsoft Office Excel 2007软件对结果进行差异显著性分析(t检验,置信水平0.05)。
2 结果与分析
2.1 菌株鉴定结果
按1.2方法对李氏禾Cr(VI)抗性内生细菌进行分离纯化,结果从李氏禾根部获得一株具有较强Cr(VI)抗性的菌株G04,按1.3方法对该菌株进行DNA序列分析,其系统发育树如图1所示。结果表明李氏禾Cr(VI)抗性内生细菌G04与阴沟肠杆菌(Enterobacter cloacae strain R2-5A)(HQ154552.1)、(E. cloacae strain R6-354)(JQ659813.1)等菌株的序列同源性達99%,归属于E. cloacae,将其命名为E. cloacae G04。阴沟肠杆菌(E. cloacae)是一类应用较广泛的微生物,具有植物促生作用(徐幼平等,2001)、固氮作用(杨海莲等,2001)、降解柴油(Ramasamy et al.,2017)和农药(林抗美等,2008)、吸附/固定Cd2+(Xu et al.,2017)等作用。阴沟肠杆菌(E. cloacae)除Cr(VI)
2.2 Enterobacter cloacae G04去除Cr(VI)的特性
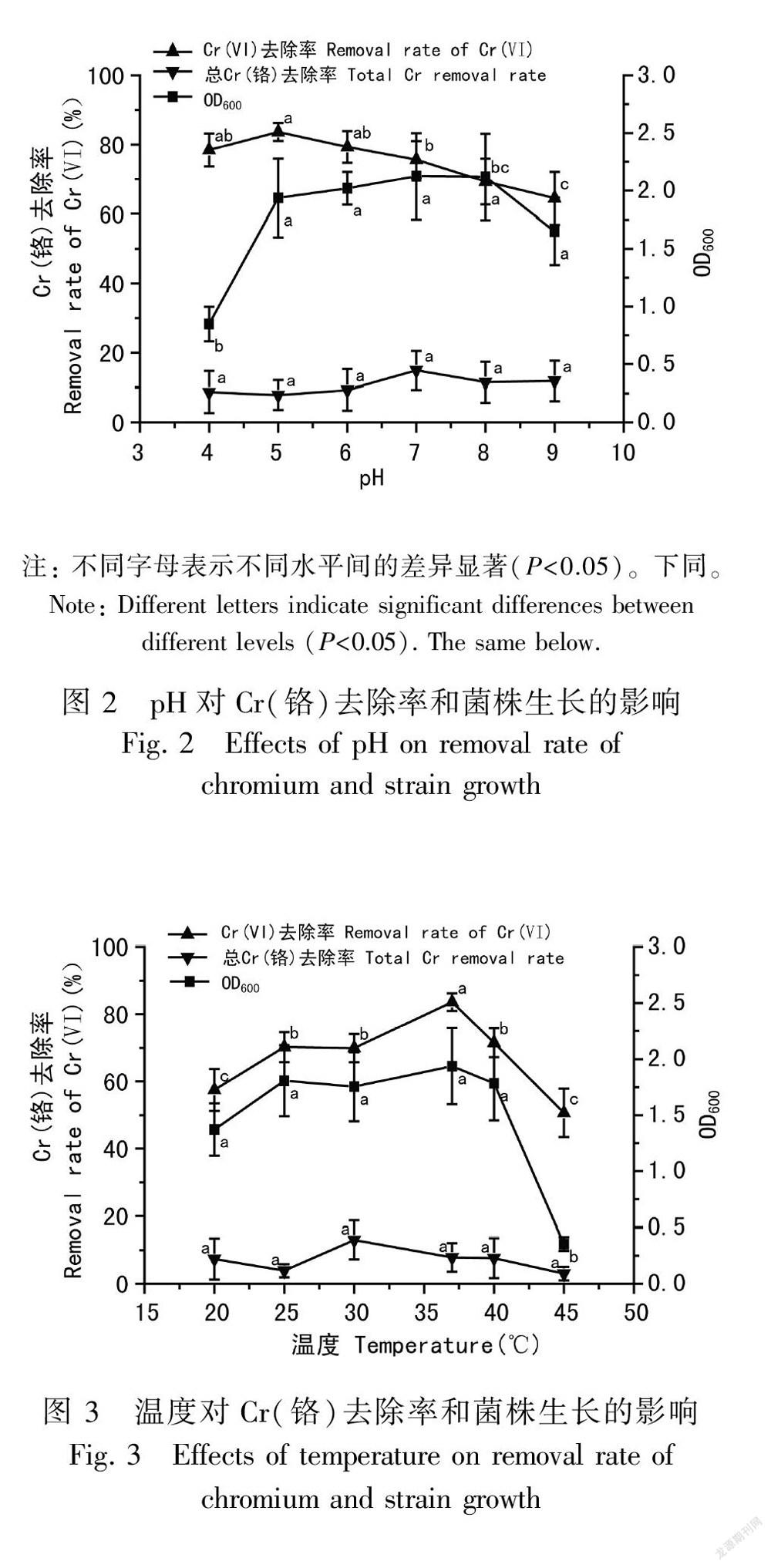
2.2.1 初始pH的影响 按1.4方法,固定其他条件不变,改变液体培养基的pH,考察pH对G04菌株除Cr(VI)的影响,结果如图2所示。
2.2.2 温度的影响 按1.4方法,固定其他条件不变,考察温度对G04菌株除Cr(VI)的影响,结果如图3所示。
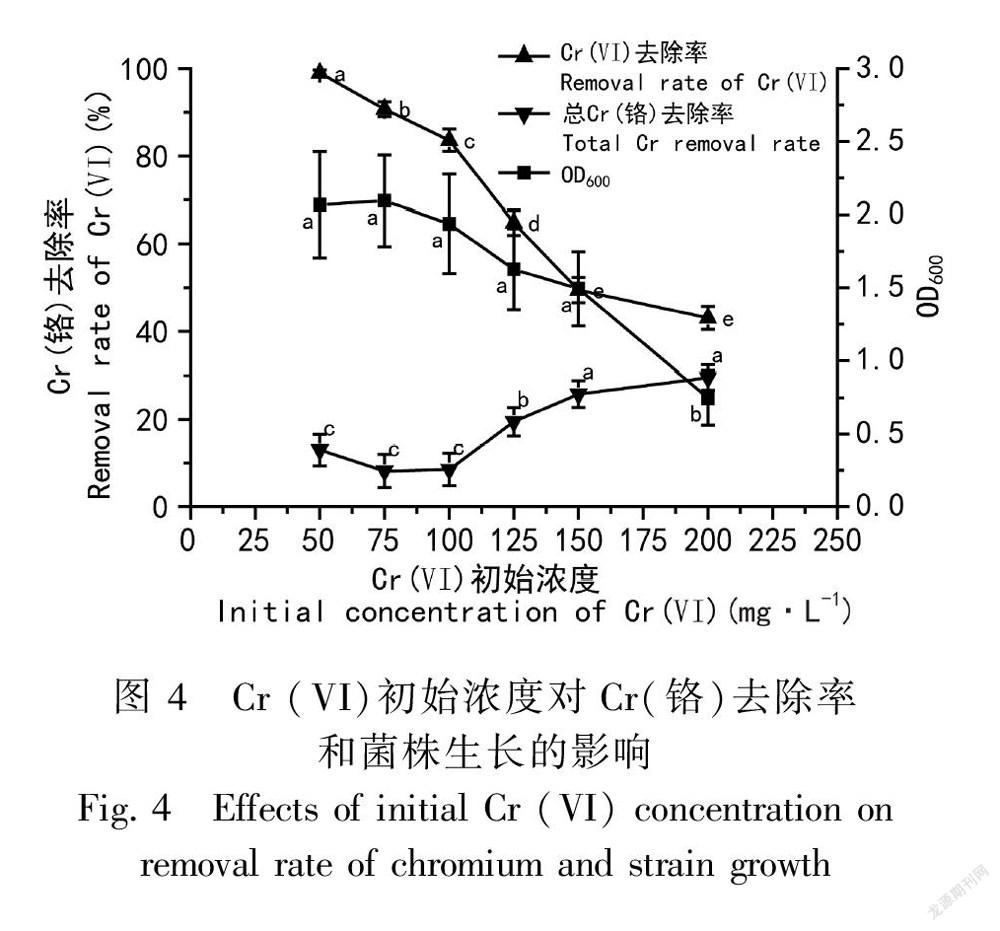
2.2.3 Cr(VI)初始浓度的影响 按1.4方法,固定其他条件不变,改变Cr(VI)底物浓度,考察底物浓度对G04菌株除Cr(VI)的影响,结果如图4所示。
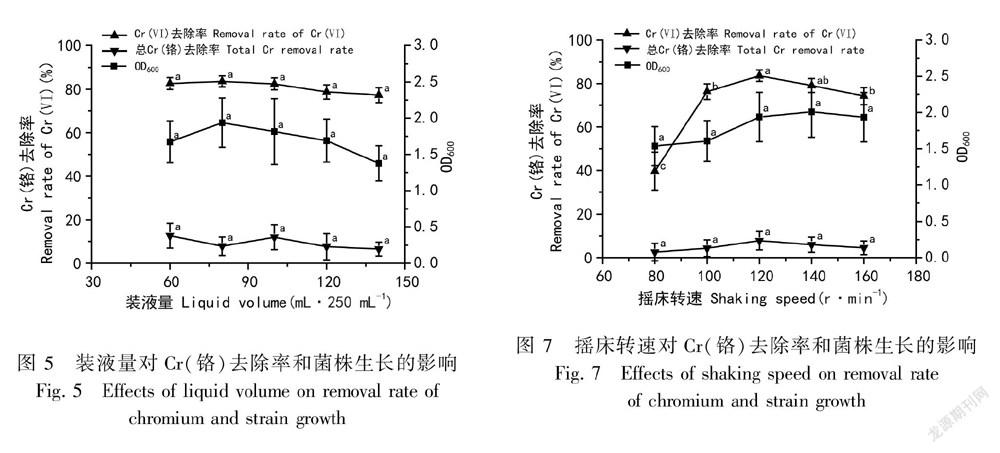
2.2.4 装液量的影响 按1.4方法,固定其他条件不变,考察装液量对G04菌株除Cr(VI)的影响,结果如图5所示。
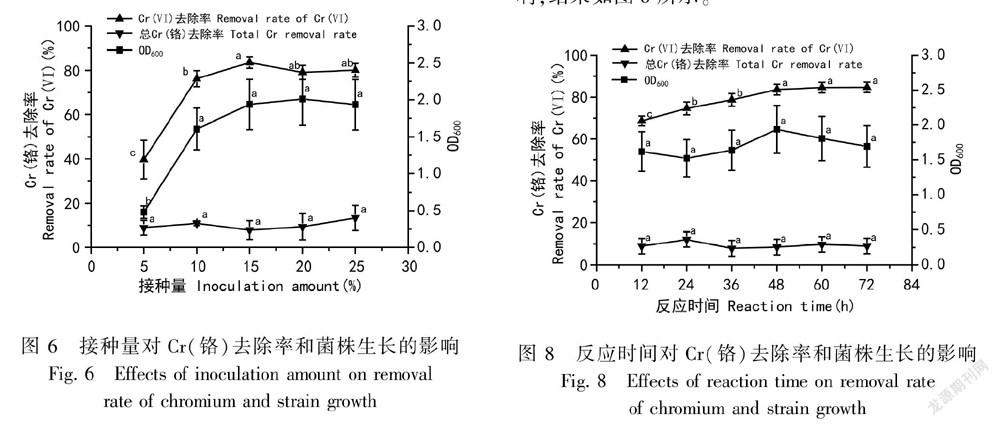
2.2.5 接种量的影响 按1.4方法,固定其他条件不变,考察接种量对G04菌株除Cr(VI)的影响,结果如图6所示。图6结果表明,当接种量小于15%时,菌株的生长情况和除Cr(VI)呈正相关性,Cr(VI)的去除率随着接种量的增加而增大,即生长较好的菌液具有更高的Cr(VI)去除能力。统计分析结果表明,接种量对Cr(VI)去除率和菌株生长的影响显著(P<0.05),而对总铬去除率不显著。当接种量为15%时,Cr(VI)去除效果最佳,故选择Enterobacter cloacae G04接种量为15%。
2.2.6 摇床转速的影响 按1.4方法,固定其他条件不变,考察接种量对G04菌株除Cr(VI)的影响,结果如图7所示。
2.2.7 反应时间的影响 按1.4方法,固定其他条件不变,考察反应时间对G04菌株除Cr(VI)的影响,结果如图8所示。
3 讨论与结论
本研究从铬超积累植物李氏禾根部组织中分离获得一株Cr(VI)抗性内生细菌E. cloacae G04,采用单因素试验研究pH、温度、底物浓度、装液量、接种量、摇床培养以及反应时间等因素对该菌株去除Cr(VI)性能的影响。在牛肉膏蛋白胨液体培养基中,较优反应条件是pH为5.0、温度为37 ℃、Cr(VI)底物浓度为100 mg·L-1、装液量为80 mL/250 mL、接种量为15%、摇床转速为120 r·min-1、反应时间48 h。此条件下,菌株E. cloacae G04对Cr(VI)的去除率约为84%,总铬去除率为8%。该菌株对Cr(VI)的去除率远高于总Cr(铬)去除率,表明该菌株主要是通过改变Cr(VI)价态的形式实现去除Cr(VI)的作用。关于阴沟肠杆菌(E. cloacae)的除Cr(VI)作用, Rahman et al.(2016)、张剑(2011)和Wang et al.(1989)等的研究表明其作用机制主要为还原Cr(VI)。本研究的结果与上述报道一致,推测李氏禾内生细菌E. cloacae G04对Cr(VI)去除机制可能也是以还原为主,但具体的作用机制还有待更加深入地研究。与已有的除Cr(VI)微生物相比较,如耐酸脱硫弧菌Desulfovibrio SRB7(马小珍等,2009)、炭疽芽孢杆菌(徐卫华,2007)等,李氏禾内生细菌E. cloacae G04在耐Cr(VI)浓度、除Cr(VI)效率方面具有一定的优势。
本研究结果表明,从李氏禾中分离的Cr(VI)抗性内生细菌E. cloacae G04菌株具有较强的除Cr(VI)性能,在土壤、水环境铬污染的修复中具有较好的应用潜力,也有可能作为促进植物修复铬污染的备选菌株,另外也可为深入研究李氏禾的铬积累作用机制提供一定参考。今后尚需深入研究该菌株的除Cr(VI)作用机制、除Cr(VI)动力学、实际应用条件等,以便在今后的应用中发挥最大效益。
参考文献:
ALSALAMAH AA, 2011. Bioreduction of Cr(VI) by potent novel chromate resistant alkaliphilic Bacillus sp. strain KSUCr5 isolated from hypersaline soda lakes [J]. Afr J Biotechnol, 10(37):7207-7218.
BROOKS RR, CHAMBERS MF, NICKS LJ, et al., 1998. Phytomining [J]. Trends Plant Sci, 3(9):359-362.
CAO Z, LUO SL, ZENG GM, et al., 2009. Removal of Cd2+ by an endophytic bacteria SDE06 obtained from Solanum nigrum L. [J]. Microbiol Chin, 36(3):328-333. [曹喆, 羅胜联, 曾光明, 等, 2009. 一株龙葵内生细菌SDE06去除Cd2+的实验 [J]. 微生物学通报,36(3):328-333.]
CHEN J, WANG DQ, ZHANG XH, et al., 2008. Study on the potential of Leersia hexandra Swartz for remediation of heavy metal(Cr, Cu, Ni) polluted water [J]. J Agro Environ Sci, 27(4):1514-1518. [陈俊, 王敦球, 张学洪, 等, 2008. 李氏禾修复重金属(Cr, Cu, Ni)污染水体的潜力研究 [J]. 农业环境科学, 27(4):1514-1518.]
CHEN Z, ZOU L, ZHANG H, et al., 2014. Thioredoxin is involved in hexavalent chromium reduction in Streptomyces violaceoruber strain LZ-26-1 isolated from the Lanzhou reaches of the Yellow River [J]. Int Biodeterior Biodegrad, 94:146-151.
CHIBUIKE GU, OBIORA SC, 2014. Heavy metal polluted soils:Effect on plants and bioremediation methods [J]. Appl Environ Soil Sci, 2014:1-12.
COSTA M, 1997. Toxicity and carcinogenicity of Cr(VI) in animal models and humans [J]. Crit Rev Toxicol, 27(5):431-442.
DHAL B, THATOI H, DAS N, et al., 2010. Reduction of he-xavalent chromium by Bacillus sp. isolated from chromite mine soils and characterization of reduced product [J]. J Chem Technol Biotechnol, 85(11):1471–1479.
DONG RZ, 2012. Application of endophytes of arsenic hyperaccumulator in the resistance and adsorption of arsenic and lead in the aqueous solution [D]. Nanchang:Nanchang Hangkong University. [董睿智, 2012. 砷超累积植物内生菌对重金属砷、铅抗性及吸附性能的研究 [D]. 南昌:南昌航空大学.]
GE S, ZHOU M, DONG X, et al., 2013. Distinct and effective biotransformation of hexavalent chromium by a novel isolate under aerobic growth followed by facultative anaerobic incubation [J]. Appl Microbiol Biotechnol, 97(5):2131-2137.
HU C, 2008. Study on mechanism of Cr accumulation and detoxification in Leersia hexandra Swartz [D]. Guilin:Guilin University of Technology. [胡澄, 2008. 李氏禾对铬的富集解毒机制研究 [D]. 桂林:桂林工学院.]
LIN KM, GUAN XF, MA LN, et al., 2008. The biological characteristics of organophosphorus pesticide-degrading bacterium, Enterobacter cloacae [J]. Chin Agric Sci Bull, 24(9):382-386. [林抗美, 官雪芳, 马丽娜, 等, 2008. 有机磷农药降解菌-阴沟肠杆菌的生物学特性 [J]. 中国农学通报, 24(9):382-386.]
LONG XX, CHEN XM, HUANG HZ, et al., 2013. Feasibility of enhanced phytoextraction of Zn contaminated soil with Zn mobilizing and plant growth promoting endophyticbacteria [J]. Trans Nonferr Metal Soc Chin, (8):2389-2396. [龙新宪, 陈雪梅, 黄焕忠, 等, 2013. 促植物生长内生细菌强化植物修复锌污染土壤 [J]. 中国有色金属学报, (8):2389-2396.]
LU WX, 2015. Identification and characterization of manganese-resistant endophytic bacteria from manganese hyperaccumulator Phytolacca acinosa [D]. Quanzhou:Fujian Normal University. [盧文显, 2015. 超富集植物商陆抗锰内生菌的筛选鉴定及其特性的研究 [D]. 泉州:福建师范大学.]
LU YY, ZHANG XH, LIU J, et al., 2013. Mechanism of Cr(VI) uptake by hyperaccumulator Leersia hexandra Swartz [J]. J Agro Environ Sci, 32(11):2140-2144. [卢媛媛, 张学洪, 刘杰, 等, 2013. 超富集植物李氏禾根系对Cr(Ⅵ)吸收机制的研究 [J]. 农业环境科学学报, 32(11):2140-2144.]
MALIK RN, HUSAIN SZ, NAZIR I, 2010. Heavy metal contamination and accumulation in soil and wild plant species from industrial area of Islamabad, Pakistan [J]. Pakistan J Bot, 42(1):291-301.
MA XZ, FEI BJ, JIN N, et al., 2009. Characteristic of reduce Cr(VI) by Desulfovibrio SRB7 [J]. Microbiol China, 32(9):1324-1328. [马小珍, 费保进, 金楠, 等, 2009. 脱硫弧菌SRB7对重金属铬Cr(VI)的还原特性 [J]. 微生物学通报, 32(9):1324-1328.]
OPPERMAN DJ, VAN HE, 2007. Aerobic Cr(VI) reduction by Thermus scotoductus strain SA-01 [J]. J Appl Microbiol, 103(5):1907-1913.
POOPAL AC, LAXMAN RS, 2008. Hexavalent chromate reduction by immobilized Streptomyces griseus [J].Biotechnol Lett, 30(6):1005-1010.
RAHMAN A, NAHAR N, OLSSON B, et al., 2016. Complete genome sequence of Enterobacter cloacae B2-DHA, a chromium-resistant bacterium [J]. Genome Announc, 4(3):e00483-516.
RAMASAMY S, ARUMUGAM A, CHANDRAN P, 2017. Optimization of Enterobacter cloacae, (KU923381) for diesel oil degradation using response surface methodology (RSM) [J]. J Microbiol, 55(2):104-111.
SHANKER AK, CERVANTES C, LOZA-TAVERA H, et al., 2005. Chromium toxicity in plants [J]. Environ Int, 31(5):739-753.
SHI R, WU XF, LI Y, et al., 2015. Plant species applied in phytoremediation of heavy metal contaminated soils [J]. J Centr S Univ For Technol, (4):139-146. [石润, 吴晓芙, 李芸, 等, 2015. 应用于重金属污染土壤植物修复中的植物种类 [J]. 中南林业科技大学学报, (4):139-146.]
WANG PC, MORI T, KOMORI K, et al., 1989. Isolation and characterization of an Enterobacter cloacae strain that reduces hexavalent chromium under anaerobic conditions [J]. Appl Environ Microbiol, 55(7):1665-1669.
WANG XJ, LIU J, 2012. Study on experimental conditions of determination the total chromium in water by flame atomic absorption spectrophotometry [J]. J Med Pest Contr, (4):462-464. [王新建, 刘健, 2012. 原子吸收火焰光度法测定水中总铬实验条件的探讨 [J]. 医学动物防制, (4):462-464.]
XU C, HE S, LIU Y, et al., 2017. Bioadsorption and biostabilization of cadmium by Enterobacter cloacae TU [J]. Chemosphere, 173:622.
XU YP, ZANG RC, CHEN WL, et al., 2001. Promoting plant growth and IAA of Enterobacter cloacae B8 fermentation liquid [J]. J Zhejiang Univ (Agric Life Sci), 27(3):282-284. [徐幼平, 臧荣春, 陈卫良, 等, 2001. 阴沟肠杆菌B8发酵液对植物的促生作用和IAA分析 [J]. 浙江大学学报 (农业与生命科学版), 27(3):282-284.]
XU WH, 2007. Research on characteristic and mechanisms of microbial Cr(VI) reduction [D]. Changsha:Hunan University. [徐卫华, 2007. 微生物还原Cr(Ⅵ)的特性与机理研究 [D]. 长沙:湖南大学.]
YANG HL, SUN XL, SONG W, et al., 2001. Studies on the rice endophytic bacteria Enterobacter cloacae MR12s identification and its effects of nitrogen fixation and biological control to plant disease [J]. Acta Phytopathol Sin, 31(1):92-93. [楊海莲, 孙晓璐, 宋未, 等, 2001. 水稻内生阴沟肠杆菌MR12的鉴定及其固氮和防病作用研究 [J]. 植物病理学报, 31(1):92-93.]
ZHANG J, 2011. Screening, identification and characteristics of a strain with high Cr(VI) degradation capacity [D]. Xiangtan:Xiangtan University. [张剑, 2011. 高效降Cr(Ⅵ)菌的筛选、鉴定及其降解特性 [D]. 湘潭:湘潭大学]
ZHANG JK, WANG ZH, YE Y, 2016. Heavy metal resistances and chromium removal of a novel Cr(VI)-reducing pseudomonad strain isolated from circulating cooling water of iron and steel plant [J]. Appl Biochem Biotechnol, 180(7):1328-1344.
ZHANG XH, LIU J, HUANG HT, et al., 2007. Chromium accumulation by the hyperaccumulator plant Leersia hexandra Swartz [J]. Chemosphere, 67(6):1138-1143.
