山药腐烂微生物的分离、鉴定及抑制研究
2019-09-10刘少军孙亚玲姚甜甜舒锐岳林旭臧传江许念芳李晓龙焦健彭勇
刘少军 孙亚玲 姚甜甜 舒锐 岳林旭 臧传江 许念芳 李晓龙 焦健 彭勇


摘要:为研究山药储藏过程中腐烂问题,以4个山药品种为试材,分离出采后山药腐烂病原微生物,通过形态学、18S rRNA序列测序和构建系统进化树的方法对分离菌株进行生物学鉴定。结果表明,引起山药腐烂的微生物与青霉菌家族Penicillium, sclerotigenum亲缘关系最近,确定该菌株为Peizicillium,sclerotigenum。利用不同pH值(3、5、7、9、11)和不同生防剂(EM原液、多粘芽孢杆菌、哈茨木霉菌、枯草芽孢杆菌、细黄链霉菌)對山药青霉菌生长特性进行研究,结果表明,青霉菌生长最适pH 5—7,培养42 h最适pH 5;枯草芽孢杆菌和细黄链霉菌对山药腐烂微生物青霉菌有较好的抑菌效果。
关键词:山药;贮藏型蔬菜;病原微生物;生物学鉴定;生防剂
中图分类号:S632.1
文献标志码:A
论文编号:cjas18100004
0 引言
山药是一种药食兼用的薯蓣科薯蓣属一年生或多年生藤本植物,深受大家喜爱,己成为农民创收的重要经济作物。山药为一年只收获一季(11-12月)的蔬菜作物。为满足市场对鲜山药的需求,山药采收后需进行贮藏保鲜,避免腐烂,山药的适宜贮藏温度为1℃—4℃,相对湿度维持在80%—85%为宜。应注意贮藏环境湿度过高过低,以免发生腐烂。引起山药腐烂的主要病害有真菌群(链格孢属、葡萄孢属、镰刀菌属和青霉属)所致的干腐病、青霉病和黑斑病所致的软腐病。王庆美等调查了山东省山药总种植面积约1.3万hm2,据最新调查显示,山药在山东地区种植面积达到2.3万hm2以上,每年因储存不当损失严重,损失数量占总产量的10%—20%。即便是用冷库储藏,且伤口处蘸有纯石灰粉,达到很高的储藏标准,仍有2—3cm的长度不能食用。山药属于耐贮藏型蔬菜,有较耐低温的特点,具有生理休眠期,因此,如何延长其休眠期是山药贮藏的关键。薛婧等以产自河北省蠡县的紫药为试材,研究了山药采后在不同温度下的贮藏效果,结果表明,在4℃下可贮藏150天,失重率仅为4.4%,腐烂率仅为2.1%。姚甜甜等在研究不同药剂处理对山药种茎的贮藏效果时发现,25%咪鲜胺乳油和30%乙蒜素乳油处理过的山药种茎腐烂霉变率为0,没有腐烂现象,效果最好。姜瑜倩等研究表明壳聚糖、l一甲基环丙烯和特克多对山药保鲜也有较好的效果。然而,对于微生物防腐剂在山药上的应用研究较少。
为探究一项简单有效的方法阻止山药腐烂,延长山药储藏时间,本研究以收集到河南省和河北省的4个山药品种(大长和芋、水山药、铁棍、长山细毛)为试材,分离引起山药腐烂的病原微生物,分析其生长的最适条件,并利用不同生防剂对该微生物进行抑制研究,以期找到能够对山药腐烂微生物起抑制作用的微生物防腐剂,从而替代或减少化学防腐剂的用量,为新型微生物防腐剂的开发提供理论基础。
1 材料与方法
1.1 供试材料
将大长和芋、水山药、铁棍、长山细毛4个山药品种无菌下折断,使两端带伤口,密封包装,于25℃培养箱中培养,直至山药伤口处长出病原微生物后进行分离、鉴定。
1.2 试验仪器、试剂
超净工作台(SJ-CJ-1D,苏州苏洁净化设备有限公司),恒温振荡培养箱(ZQTY-70F,上海知楚仪器有限公司),电子天平(AL204,梅特勒一托利多仪器(上海)有限公司),恒温培养箱(HWS-500,宁波江南仪器厂),立式压力蒸汽灭菌器(YXQ-LS-50S,上海博迅实业有限公司),离心机,DNA电泳槽(DYCP-31DN,北京六一仪器厂),扫描电子显微镜(JSM-6610LV,日本电子株式会社)。DNA提取所用的Rnase购置Sigma公司,其他化学试剂均为国产化学纯,PDA培养基配方参照文献。
1.3 供试杀菌剂
哈茨木霉菌(可溶性粉剂,有效活菌数含量≥5亿/,山东绿陇生物技术有限公司),多粘芽孢杆菌(可溶性粉剂,有效活菌数100亿cfu/g,山东绿陇生物技术有限公司),细黄链霉菌(可溶性粉剂,有效活菌数≥20亿/,山东绿陇生物技术有限公司),枯草芽孢杆菌(可溶性粉剂,有效活菌数含量≥200亿/g,山东绿陇生物技术有限公司),EM原液(有效活菌数≥20亿/mL,山东绿陇生物技术有限公司)。
1.4 方法
1.4.1 山药腐烂微生物的分离筛选采用稀释分离法,取腐烂长菌的山药,用镊子夹一小块于150 mL PDA液体培养基的锥形瓶中,在28℃、180r/min条件下振荡培养48h,取lmL溶液至无菌试管内,加入9mL无菌水,摇匀静置,依次进行稀释,获得10-1、10-2、10-3、10-4、10-5、10-6、10-7的稀释液,分别吸取10-5、10-6和10-7的100μL样液至PDA平板上,用无菌涂布器涂匀,放置1h后将培养皿倒置于28℃培养箱中培养。2天后根据菌落形态挑选单菌落,分别接种到PDA平板上,培养48 h后用于后续试验。经纯化的菌株于4℃保存。
1.4.2 形态学和分子生物学鉴定铁棍和水山药2个品种分离后的微生物菌落,取1 mmXl mm小块放入小玻璃瓶,用磷酸缓冲液冲洗后,加入2.5%(v/v)戊二醛和1%锇酸固定,45%—100%酒精梯度脱水后,临界点干燥,离子溅射金后,扫描电镜观察。
将纯化的菌株接种于30 mL无菌的PDA液体培养基中,置于30℃培养48 h,采用SDS法提取其基因组DNA, 利 用 16S 上 游 引 物 27f(AGAGTTTGATCMTGGCTCAG)、下游引物1492R(TACGGYTACCTTGTTACGACTT),18S上游引物ITSl(5’-TCCGTAGGTGAACCTGCGG-3')、下游引物ITS4(5’- TCCTCCGCTTATTGATATGC- 3'),PCR扩增其16S rRNA和18S rRNA片段。PCR扩增体系(30μL):模板lμL,dNTP 2μL,引物各lμL,Buffer 3μL,ddH2017.8μL,Taq酶0.2μL。PCR扩增程序为:95℃5 min;95℃30 s,55℃30 s,72℃1 min,循环35次;72℃10 min,4℃保温。琼脂糖凝胶电泳检测PCR产物,胶回收后送北京六合华大基因科技股份有限公司完成测序。测序结果与NCBI数据库中己知序列进行相似性比对;采用基因序列分析软件DNAMAN和构建系统发育树软件MEGA5.22,与GenBank数据库中相关属种基因序列进行系统发育分析。
1.4.3 不同pH对山药微生物生长状况的影响得到的微生物单菌落于28℃培养箱内培养,观察菌落生长状况。应用菌体湿重法测定pH值对山药青霉菌的影响。分别用0.01 mol/L醋酸和0.01 mol/L氢氧化钙配制pH 3、5、7、9、11的溶液,取20μL过夜培养的山药青霉菌,转至不同pH值的溶液中,每隔一段时间称取l mL菌液于离心管中,测定菌液质量。
1.4.4 不同杀菌剂对山药微生物的抑制效果参考多粘芽孢杆菌、细黄链霉菌、枯草芽孢杆菌、哈茨木霉菌、EM菌5种常见生物杀菌剂的最佳剂量,取相应量至50℃左右PDA培养基中,混匀至终浓度为多粘芽孢杆菌1∶100,细黄链霉菌1:80,枯草芽孢杆菌1:800,哈茨木霉菌80 g/L,EM原液1:400的含杀菌剂的固体培养基,以不加杀菌剂的PDA培养基为对照。用灭菌的镊子将培养2天的山药青霉菌菌饼(直径6 mm)接种于上述固体培养基上,在28C、80%相对湿度条件下培养66 h后,测量菌落直径。并计算抑制率,如式(1)。
抑制率:对照菌直径-处理菌落直径X100%
对照菌落直径
……………(1)
1.5 数据分析
结果以平均值士标准差表示,采用IBM SPSSStatistics 20统计软件进行数据分析,Excel作图。
2 结果与分析
2.1 山药腐烂微生物的分离与鉴定
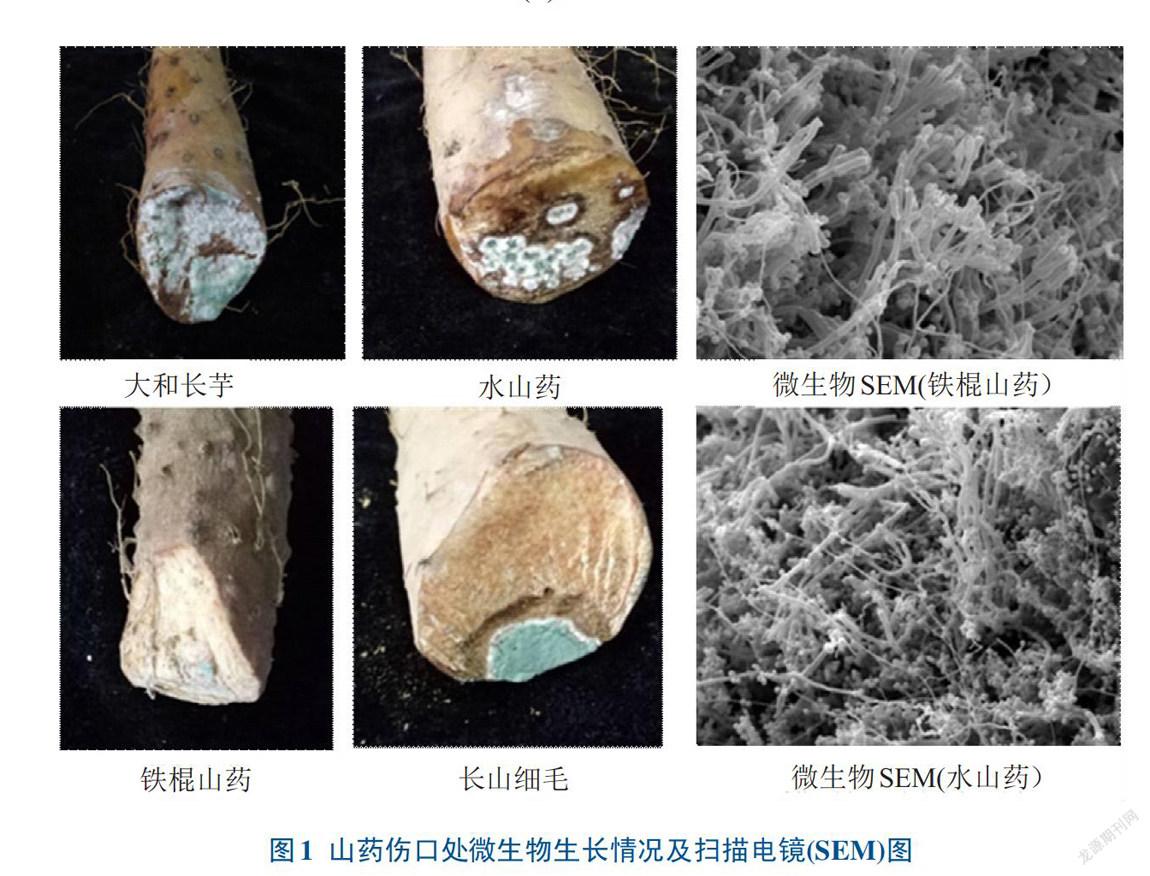
2.1.1 不同山药品种伤口处微生物生长情况及形态学鉴定4个山药品种被腐烂病原微生物感染情况如图1所示。虽然生长菌落大小不一,但外观基本一致,经分离筛选后,发现采后山药所生长的病原微生物表观菌落形态基本一致,可能是同一种微生物,因此,后续试验只选择了铁棍山药和水山药2个品种的微生物进行了扫描电镜和分子生物学鉴定。经扫描电镜检测(图1),发现2种山药的微生物有相同的形态特征,因此,确定为同一种微生物。
2.1.2 山药微生物的分子生物学鉴定以水山药和铁棍山药2个基因组DNA为模板,分别以16S引物和18S引物进行PCR扩增。结果(图2)发现,16S扩增无带,18S扩增条带正常,且18S扩增条带显示水山药和铁棍山药菌株的18S rRNA基因序列长度分别为566、580 bp,因此,按照18S引物进行后续试验。
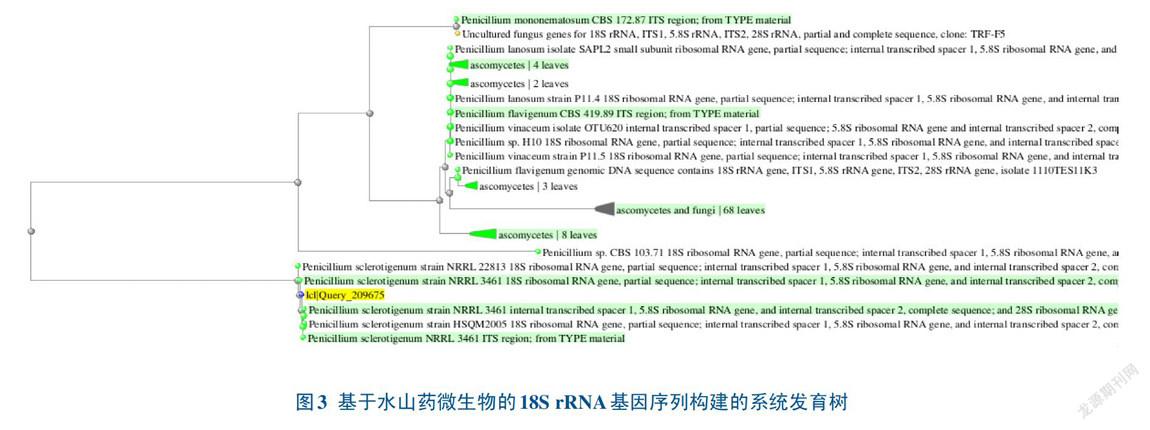
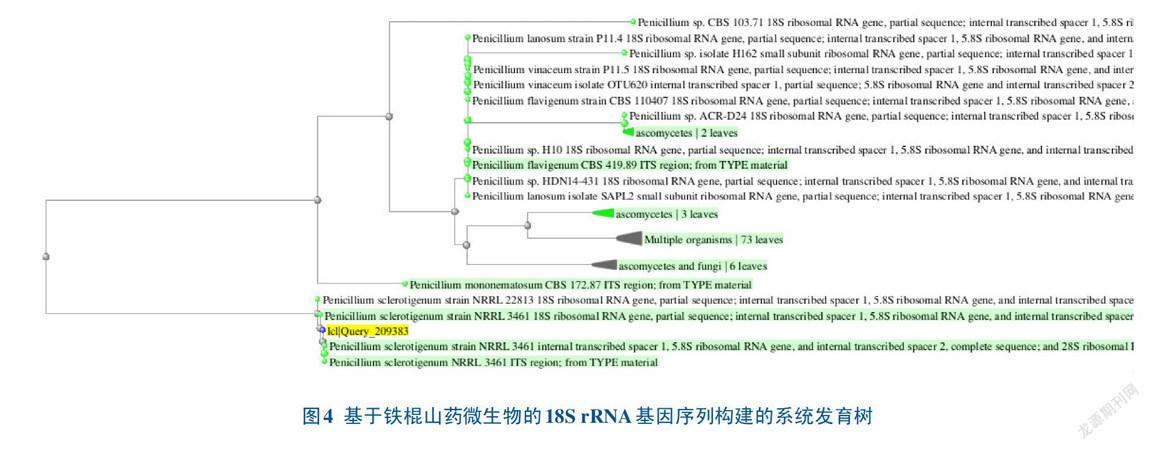
将18S引物扩增后的产物进行纯化、测序,序列通过NCBI比对后,选取相似序列构建系统发育树。结果表明,水山药(图3)和铁棍山药(图4)的微生物均与Penicillium, sclerotigenum, strain NRRL 3461在同一分支上,遗传进化距离最近,因此,水山药和铁棍山药上的微生物为同一种微生物。
2.2 山药微生物的生长特性及抑制
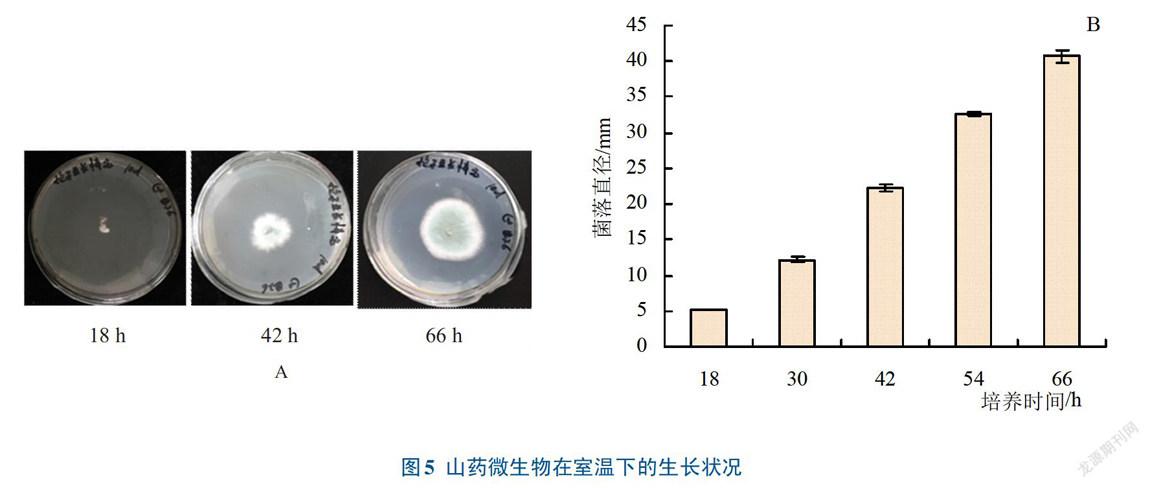
2.2.1 微生物在室溫下的生长情况试验表明,在低温0—4℃下,平板放置7天微生物均不生长,可能低温能抑制孢子的萌发,同时可延长山药贮藏时间,这与赵丹丹等低温处理能较好地延长青枣贮藏期的结果一致。本试验探究了常温下(20℃)菌落生长情况,如图5所示,18 h菌落开始生长,42 h时生长较快,66 h生长达到高峰。
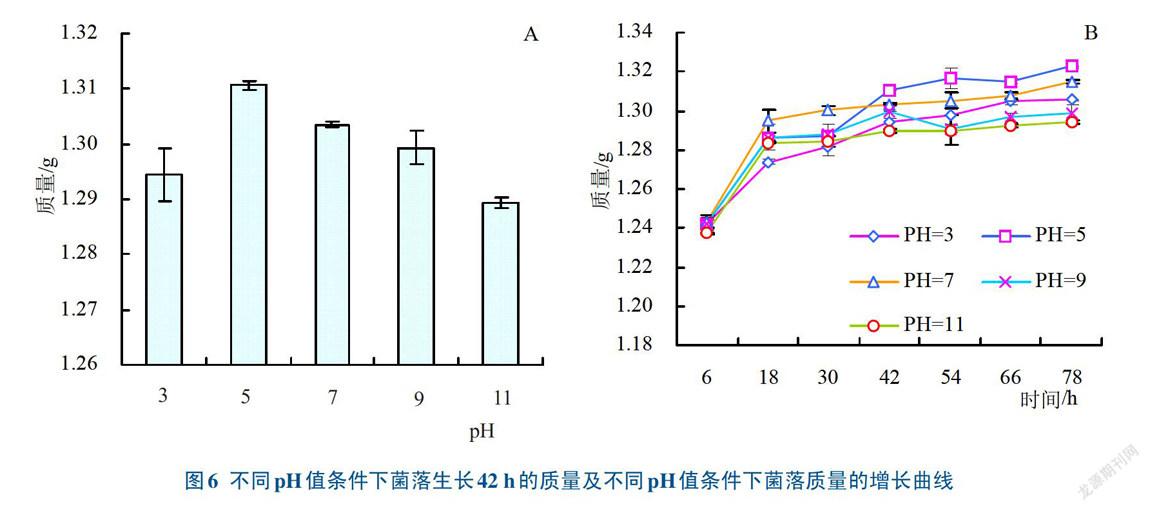
2.2.2 微生物最适生长pH值从图6A可以看出,菌落在不同pH值中培养42 h后,以pH5时菌落质量最大,其次是pH 7,表明pH 5是山药微生物最适宜的pH值。图6B菌落质量增长曲线也可以看出,在6—18 h,菌落生长最快,质量增加明显,18 h后微生物生长缓慢,至42 h基本稳定。其中,在42 h之前,菌落在pH 7时生长最快,质量最大;而42 h后,pH 5的条件下,生长量最大。表明山药微生物生长的最适pH 5—7,前期在中性条件下生长较好,而后期在弱酸性条件下生长较好。
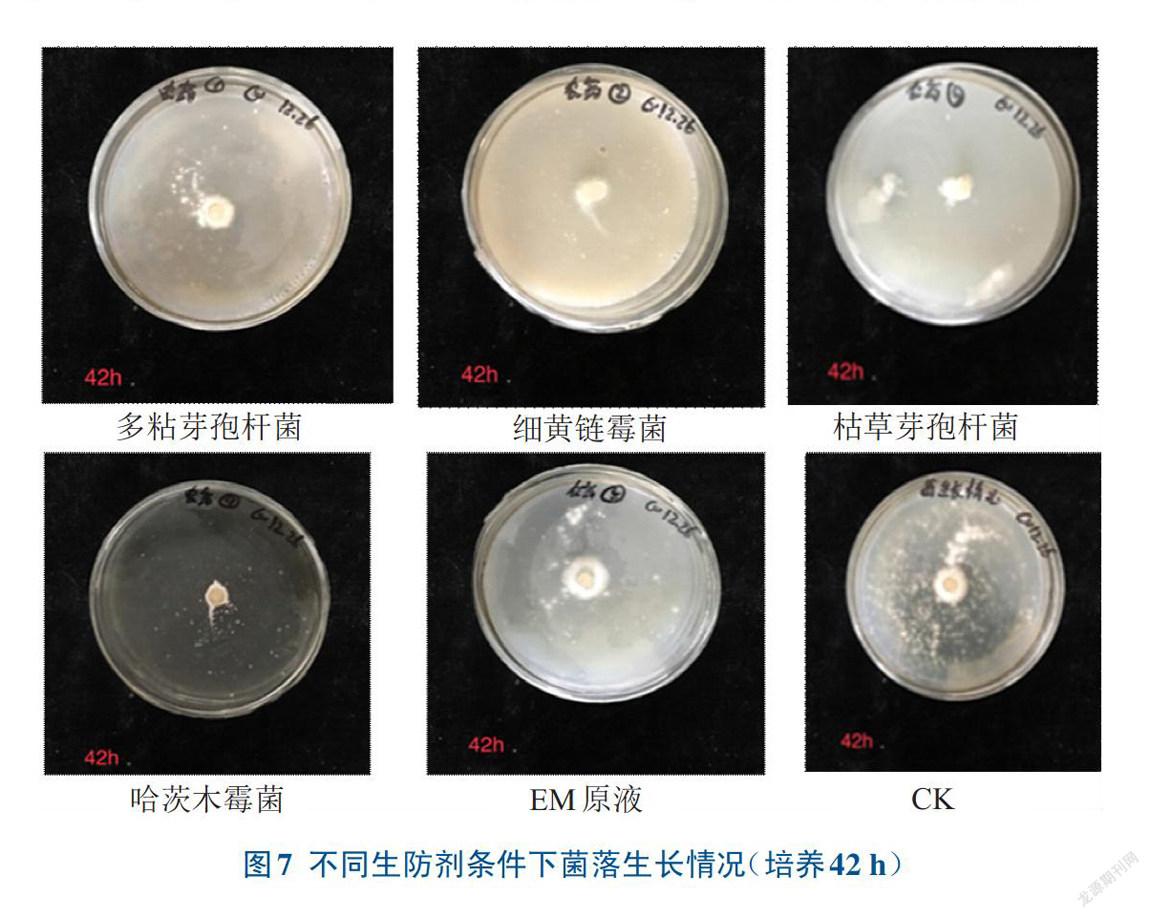
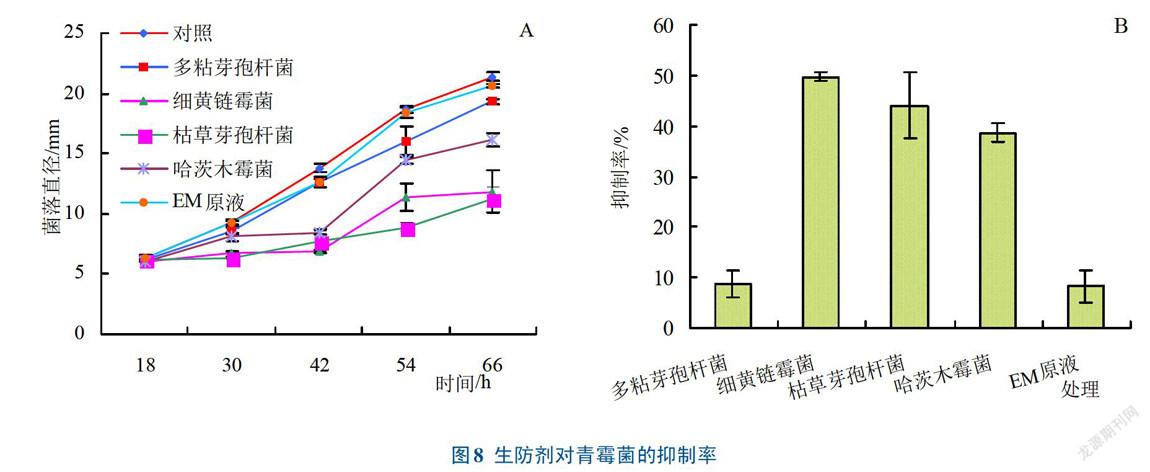
2.2.3 生防剂对山药微生物的抑制效果不同生防剂(EM原液、多粘芽孢杆菌、哈茨木霉菌、枯草芽孢杆菌、细黄链霉菌)及对照培养42 h时,微生物菌落生长状况如图7所示。5种生防剂与腐烂微生物共同培养后,通过测量共培养的菌落直径也能反映出生防剂对菌落的抑制情况(图8A),从中可以发现,对照、EM原液、多粘芽孢杆菌和哈茨木霉菌的菌落直径随着时间的延长而增加,而枯草芽孢杆菌和细黄链霉菌的菌落直径随着时间的延长增加趋势不大,杀菌效果好。从图8B培养42h后杀菌剂对青霉菌的抑制率可以看出,细黄链霉菌对青霉菌具有较强的抑制效果,枯草芽孢杆菌的抑菌效果次之,EM原液的抑菌效果最差,抑菌效果依次为细黄链霉菌>枯草芽孢杆菌>哈茨木霉菌>多粘芽孢杆菌>EM原液,与菌落直径测出的结果一致。因此,为防治山药贮藏期间发生腐烂,可采用细黄链霉菌、枯草芽孢杆菌对山药进行处理。
3 结论与讨论
病原微生物在山药储藏过程中造成的损失最大,病害造成山药产量降低,品质下降,山药苗期或储藏期易感染病害。引起山药病害的病原微生物有很多种,其中真菌性病害报道的较多。山药块茎外围有保护的皮层,此时病原微生物不易穿透,然而,在除草、收割和采后处理过程中,啮齿动物、线虫和人类很容易伤害山药块茎,病原微生物从伤口处渗透到山药内部。本研究以河南省和河北省的4个采后山药品种(大长和芋、水山药、铁棍、长山细毛)为试材,分离出引起山药腐烂的病原微生物为真菌类微生物,这与陈莲研究的青枣腐败变质的主要病原菌是真菌类微生物结果一致。山药腐烂微生物的分离与鉴定的研究也有报道,检测了5个山药品种的微生物,引起山药腐烂的病原微生物有5个真菌物种(其中包括青霉菌)和4个细菌物种。本研究通过形态学、18S rRNA序列测序和构建系统进化树的方法对分离菌株进行了生物学鉴定,结果表明,引起山药腐烂的微生物与青霉菌家族P.sclerotigenum,亲缘关系最近,确定该菌株为P.sclerotigeizum。利用不同pH值(3、5、7、9、11)对青霉菌生长特性进行研究,结果表明,青霉菌生长最适值为pH 5—7,培养42 h的最适值为pH 5;利用不同生防剂(EM原液、多粘芽孢杆菌、哈茨木霉菌、枯草芽孢杆菌、细黄链霉菌)对青霉菌进行抑制研究,发现枯草芽孢杆菌和细黄链霉菌对山药青霉菌有较好的抑菌效果。笔者筛选出2种对青霉菌有抑制作用的微生物生防剂剂,对生防剂在山药上的应用效果需进一步研究,以减少山药在贮藏过程中的腐烂量,为新型微生物防腐剂的开发提供理论基础。
