黑尾叶蝉RNAi途径关键蛋白AGO2多克隆抗体制备及应用
2019-09-10李歌董旭危婉婷叶彦杰兰汉红
李歌 董旭 危婉婷 叶彦杰 兰汉红


摘要:【目的】制备效价高且特异性强的黑尾叶蝉RNAi途径关键蛋白Argonaute 2(AGO2)多克隆抗体,为进一步研究AGO2蛋白在叶蝉RNAi免疫途径中的调控功能及作用机制提供技术支持。【方法】通过RT-PCR从黑尾叶蝉基因组扩增出AGO2基因的功能片段,与原核表达质粒pET-28a重组构建重组质粒,然后转化大肠杆菌BL21感受态细胞进行诱导表达;以纯化的AGO2融合蛋白免疫雄性新西兰大白兔获得高效价的多克隆抗体,并以多克隆抗体为一抗,采用Western blotting检测AGO2蛋白在健康和带毒黑尾叶蝉中的表达情况。【结果】RT-PCR扩增获得的黑尾叶蝉AGO2基因片段为1635 bp,构建的pET-AGO2重组质粒能在BL21感受态细胞中成功表达出AGO2融合蛋白,其最适表达条件:温度28 ℃,IPTG浓度0.5 mmol/L,诱导时间5 h,摇床转速220 r/min。以纯化AGO2融合蛋白免疫雄性新西兰大白兔获得的多克隆抗体效价为1∶106,抗体浓度约350 μg/mL。Western blotting检测结果表明,AGO2蛋白在健康和水稻矮缩病毒(RDV)感染黑尾叶蝉中均有表达,但与健康黑尾叶蝉相比,AGO2蛋白在RDV感染黑尾叶蝉中的表达水平更高,即RDV侵染能提高AGO2蛋白的表达水平。【结论】制备获得的黑尾叶蝉RNAi途径关键蛋白AGO2多克隆抗体具有高纯度和高效价,且特异性强,可用于检测AGO2蛋白在病毒感染黑尾叶蝉中的表达水平,进而揭示AGO2蛋白在介体昆虫RNAi途径中的功能机制。
关键词: 水稻矮缩病毒(RDV);黑尾叶蝉;RNAi;AGO2蛋白;多克隆抗体;效价
0 引言
【研究意义】黑尾叶蝉(Nephotetlix cincticeps)是热带亚热带地区的主要水稻害虫之一,通过刺吸植物韧皮部而导致水稻枯萎及叶片褪绿(戴仁怀和倪琳,2011),除了影响水稻生长发育外,还通过持久增殖型方式传播水稻矮缩病毒(Rice dwarf vrirus,RDV)(Chen et al.,2011),但至今尚未研发出防治该虫害的特效药剂及有效策略。已有研究运用深度测序技术从水稻黑条矮缩病毒(Rice black-streaked dwarf virus,RBSDV)和水稻条纹病毒(Rice stripe virus,RSV)侵染的灰飞虱(Xu et al.,2012;Li et al.,2013)、南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)侵染的白背飞虱或灰飞虱(兰汉红等,2015;Lan et al.,2015,2016)及水稻瘤矮病毒(Rice gall dwarf virus,RGDV)侵染的电光叶蝉(Lan et al.,2016)中检测出大量病毒来源的siRNA(small interference RNA),并证实通过干扰Argonaute 2基因(AGO2)的表达能显著提高病毒在介体昆虫内的增殖水平,即AGO2蛋白组分在RNA干扰(RNA interference,RNAi)抗病毒免疫过程中发挥重要作用。因此,加强介体昆虫黑尾叶蝉RNAi免疫反应及其与水稻病毒互作方面的研究将有助于制定有效的防治措施。【前人研究进展】由small RNA介导的RNAi是生物体内保守且重要的抗病毒免疫反应。根据small RNA生成机制可将RNAi途径分为small interference RNA(siRNA)、microRNA(miRNA)和PIWI-interacting RNA(piRNA)3种通路类型(Karlikow et al.,2014)。在siRNA途径中,Dicer2(DCR2)识别并切割长的双链RNA(dsRNA)为21 nt siRNA,而siRNA与AGO2结合形成RNA诱导的沉默复合体(RNA-induced silencing complex,RISC),最终沉默外源病毒等病原物基因的表达(Ding,2010)。在miRNA途径中,Dicer1(DCR1)切割单链RNA(ssRNA)形成的茎环结构双链区,生成的22 nt miRNA与Argonaute 1(AGO1)结合形成RISC,通过沉默内源基因表达而调节生物机体的生长发育过程(Lee et al.,2004)。piRNA途径发现于果蝇和小鼠等的生殖细胞中,在该途径中,非Dicer依赖生成的piRNA与Argonaute亚家族蛋白Piwi结合形成RISC,从而抑制转座子移动(Bronkhorst and van Rij,2014)。可见,siRNAs、miRNAs和piRNAs 3种small RNA均需与AGO蛋白结合形成RISC复合物后才能进行目标基因沉默,即AGO蛋白是RNAi的核心成分之一。AGO蛋白家族较大,且其功能较复杂。现已发现果蝇有5种AGO蛋白,秀麗隐杆线虫(Caenorhabditis elegans)有27种AGO蛋白,人类有8种AGO蛋白,水稻有18种AGO蛋白,拟南芥(Arabidopsis thaliana)有10种AGO蛋白(Vaucheret,2008)。其中,果蝇的AGO2蛋白、拟南芥的AGO1和AGO7蛋白及栗疫病菌的AGO2蛋白功能缺失后,其抗病毒免疫活性丧失(van Rij et al.,2006;Qu et al.,2008),说明在昆虫、植物和真菌中AGO蛋白介导的沉默对于抗病毒免疫起关键作用。至今,在血吸虫(Schistosoma japonicum)、家蚕(Bombyx mori)、绿僵菌(Metarhizium anisopliae)和水稻等物种中已有AGO蛋白抗体制备及检测应用的研究报道(杨燕萍等,2010;汪章勋等,2013;程小玲和杨加伟,2014;朱兵等,2018)。【本研究切入点】叶蝉和飞虱是引发水稻病害的主要介体昆虫,但由于缺乏针对叶蝉或飞虱AGO2蛋白的适当抗体,进而阻碍了介体昆虫AGO2蛋白在RNAi天然免疫途径中的功能及机制研究。【拟解决的关键问题】克隆黑尾叶蝉RNAi途径中的AGO2基因,经大肠杆菌BL21原核表达获得黑尾叶蝉AGO2融合蛋白并免疫新西兰大白兔以获得效价高且特异性强的多克隆抗体,为进一步研究AGO2蛋白在叶蝉RNAi免疫途径中的调控功能及作用机制提供技术支持。
1 材料与方法
1. 1 试验材料
大肠杆菌(Escherichia coli)DH5α和BL21感受态细胞及原核表达质粒pET-28a由闽南师范大学生物科学与技术学院保存提供;总RNA、质粒和核酸抽提纯化试剂盒、DNA Marker和蛋白分子量标准品等购自天根生化科技(北京)有限公司;限制性内切酶、T4连接酶、反转录试剂盒和Taq DNA聚合酶均购自美国Thermo Fisher Scientific公司;弗氏完全佐剂与弗氏不完全佐剂购自美国Sigma-Aldrich公司;鼠源6×His单抗购自美国Proteintech Group公司;HRP标记羊抗兔免疫球蛋白和TMB底物显色试剂购自天根生化科技(北京)有限公司;聚偏二氟乙烯膜购自美国Millipore公司。
1. 2 载体构建
根据黑尾叶蝉AGO2基因序列,以Primer Premier 5.0设计特异性引物(AGO2-F:5'-TTTTGGATC CATGAACACTCGGCGAATCTAC-3';AGO2-R:5'-TTTTGCGGCCGCTTACTCCAAATAGACTCTTCC-3')进行RT-PCR。RT反应体系20.0 μL:RNA 0.1 μg,AGO2-R 2.0 μL,RT Buffer 4.0 μL,M-MLV反转录酶1.0 μL,ddH2O补足至20.0 μL。反转录程序:70 ℃ 10 min,42 ℃ 1 h,70 ℃ 10 min。PCR反应体系50.0 μL:cDNA模板2.0 μL,AGO2-F和AGO2-R各2.0 μL,dNTPs 5.0 μL,Taq DNA聚合酶1.0 μL,ddH2O补足至50.0 μL。扩增程序:94 ℃预变性3 min;94 ℃ 60 s,54 ℃ 30 s,72 ℃ 90 s,进行35个循环;72 ℃延伸60 s。RT-PCR产物与表达载体pET-28a分别用BamH І和Not I进行双酶切,酶切产物凝胶回收后以T4连接酶连接,然后转化DH5α感受态细胞。提取重组质粒,以引物AGO2-F/AGO2-R进行PCR验证并测序,阳性重组质粒命名为pET-AGO2。
1. 3 AGO2基因原核表达、鉴定及纯化
pET-AGO2重组质粒测序正确后转化BL21感受态细胞并涂布LB培养基上进行培养,挑取单克隆接种到LB液体培养基(含50 μg/mL Kan)中,28 ℃振荡培养12 h。第2 d按1%稀释后置于28 ℃摇床扩培至对数期,OD600为0.6~0.8,添加适量诱导剂IPTG(0、0.2、0.3、0.4、0.5和0.6 mmol/L),28 ℃振荡培养5 h。诱导表达产物离心收集菌体,用超声波裂解后进行SDS-PAGE电泳(分离胶浓度12%,浓缩胶浓度5%),确定最佳IPTG诱导浓度。
pET-AGO2重组质粒带有6×His标签,因此可用His抗体鉴定融合蛋白是否表达。pET-AGO2重组质粒经IPTG诱导表达后离心收集菌体,以超声波破碎细胞,收集蛋白进行Western blotting检测。Western blotting检测是以抗6×His抗体为一抗、辣根过氧化物酶HRP标记抗体为二抗,鉴定AGO2蛋白是否融合组氨酸标签。诱导表达的融合蛋白经纯化系统AKTA Prime 100的Ni2+-NTA琼脂糖亲和层析纯化后,采用SDS-PAGE电泳检测收集蛋白的纯度。
1. 4 抗血清制备、纯化及效价测定
诱导表达的AGO2融合蛋白纯化后以适量弗氏完全佐剂进行乳化(1.0 mg),蛋白乳化后注射5月龄雄性新西兰大白兔1次;加强免疫注射时以不完全佐剂乳化蛋白且蛋白量减半,每隔15 d加强免疫1次,共加强免疫5次。采集血样室温静置2 h后4 ℃冰箱保存过夜,待血液凝块收缩,5000 r/min离心15 min,收集血清,-80 ℃保存备用。
取适量CNBr-activated Sepharase 4B干粉制备纯化柱后,4 ℃下解冻血清,并将冻存管中的Beads转移至纯化柱内。按照说明取适量血清,4 ℃下3500 r/min离心20 min,吸出油脂;将处理好的血清与对应的蛋白Beads一起孵育,室温孵育2 h或4 ℃孵育过夜;孵育完成后用PBS洗涤3次;再以预冷的洗脱液(pH 2.5)洗脱,每次收集1.0 mL,EP管中预先加入50.0 μL中和液;将收集的低浓度抗体用PrA浓缩;纯化好的抗体加入10%甘油,-20 ℃保存。
采用ELISA检测纯化前后抗血清的抗体效价。将抗血清按照 1∶500、1∶2000、1∶5000、1∶104、1∶105和1∶106进行稀释,室温下一抗孵育1 h、二抗孵育45 min,显色反应20 min,以酶标仪于450 nm处测量吸光值。其中,阴性对照为AGO2融合蛋白免疫大白兔前所采血。
1. 5 AGO2蛋白在健康和带毒黑尾叶蝉中的表达情况
取健康和RDV感染的黑尾葉蝉各200头,用液氮研磨后,添加1.0 mL蛋白提取液;混匀后4 ℃下振荡提取20 min;然后4 ℃下12000 r/min离心15 min,收集上清液即获得昆虫总蛋白,分装后-80 ℃保存备用。提取的昆虫蛋白样品经SDS-PAGE电泳后转移至PVDF膜,以1∶106倍比稀释的AGO2免疫球蛋白为一抗、辣根过氧化物酶HRP标记抗体为二抗,采用Western blotting检测AGO2蛋白在健康和RDV感染黑尾叶蝉中的表达情况。
2 结果与分析
2. 1 黑尾叶蝉AGO2基因扩增及表达载体构建
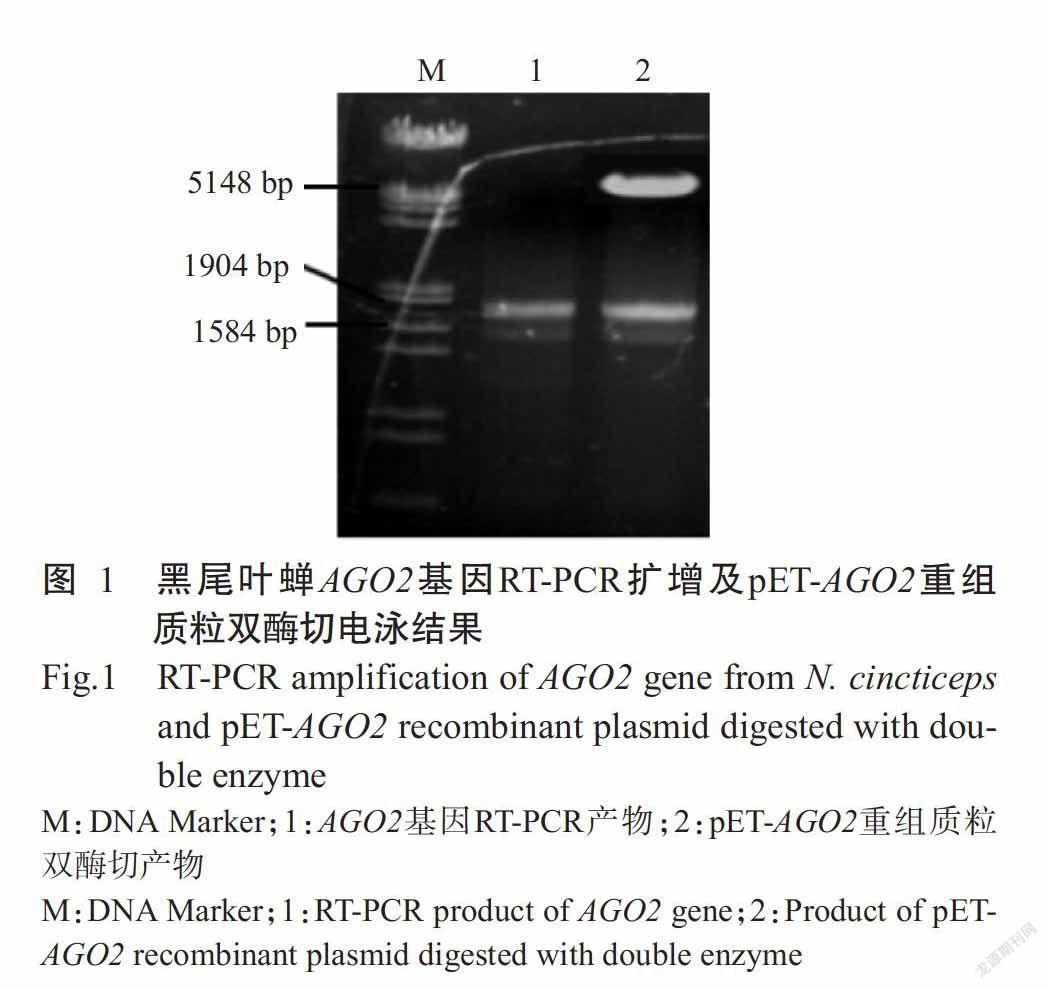
以黑尾叶蝉总RNA为模板、AGO2-F/AGO2-R为引物,RT-PCR扩增黑尾叶蝉AGO2基因,经琼脂糖凝胶电泳检测,结果显示扩增获得的目的片段约1600 bp(图1),与预期结果一致。RT-PCR产物与表达载体pET-28a经BamH I和Not I双酶切后重组获得pET-AGO2重组质粒,以其转化DH5α感受态细胞,随机挑取PCR鉴定呈阳性的单菌落提取质粒,采用BamH I和Not I进行双酶切验证,结果显示pET-AGO2重组质粒可酶切获得与RT-PCR扩增产物大小一致的目的条带(图1),约1600 bp。pET-AGO2重组质粒送至深圳华大基因股份有限公司测序,测序结果表明黑尾叶蝉AGO2基因为1635 bp,进一步验证表达载体构建成功。
2. 2 AGO2融合蛋白的表达、鉴定及纯化
预试验结果表明,AGO2融合蛋白在BL21感受态细胞中表达的适合温度约28 ℃、诱导时间约5 h、摇床转速220 r/min。为进一步明确AGO2融合蛋白在BL21感受态细胞中表达的最适IPTG浓度,分别在0(对照)、0.2、0.3、0.4、0.5和0.6 mmol/L 6个IPTG浓度下进行诱导表达,结果(图2)显示,IPTG浓度为0.5 mmol/L时AGO2融合蛋白表达量最高。即AGO2融合蛋白在大肠杆菌中表达的最适条件:温度28 ℃,IPTG浓度0.5 mmol/L,诱导时间5 h,摇床转速220 r/min。此外,Western blotting检测结果显示,鼠源6×His单抗能特异结合His标签(图3),表明AGO2融合蛋白在BL21感受态细胞中正确表达。
AGO2融合蛋白主要以可溶性的形式进行表达,经超声波破碎后的上清液经Ni2+-NTA琼脂糖亲和层析纯化,收集洗脱液进行SDS-PAGE电泳,结果表明融合蛋白纯度约95%(图4)。纯化AGO2融合蛋白再经透析袋透析处理,其终浓度为3.0 mg/mL。
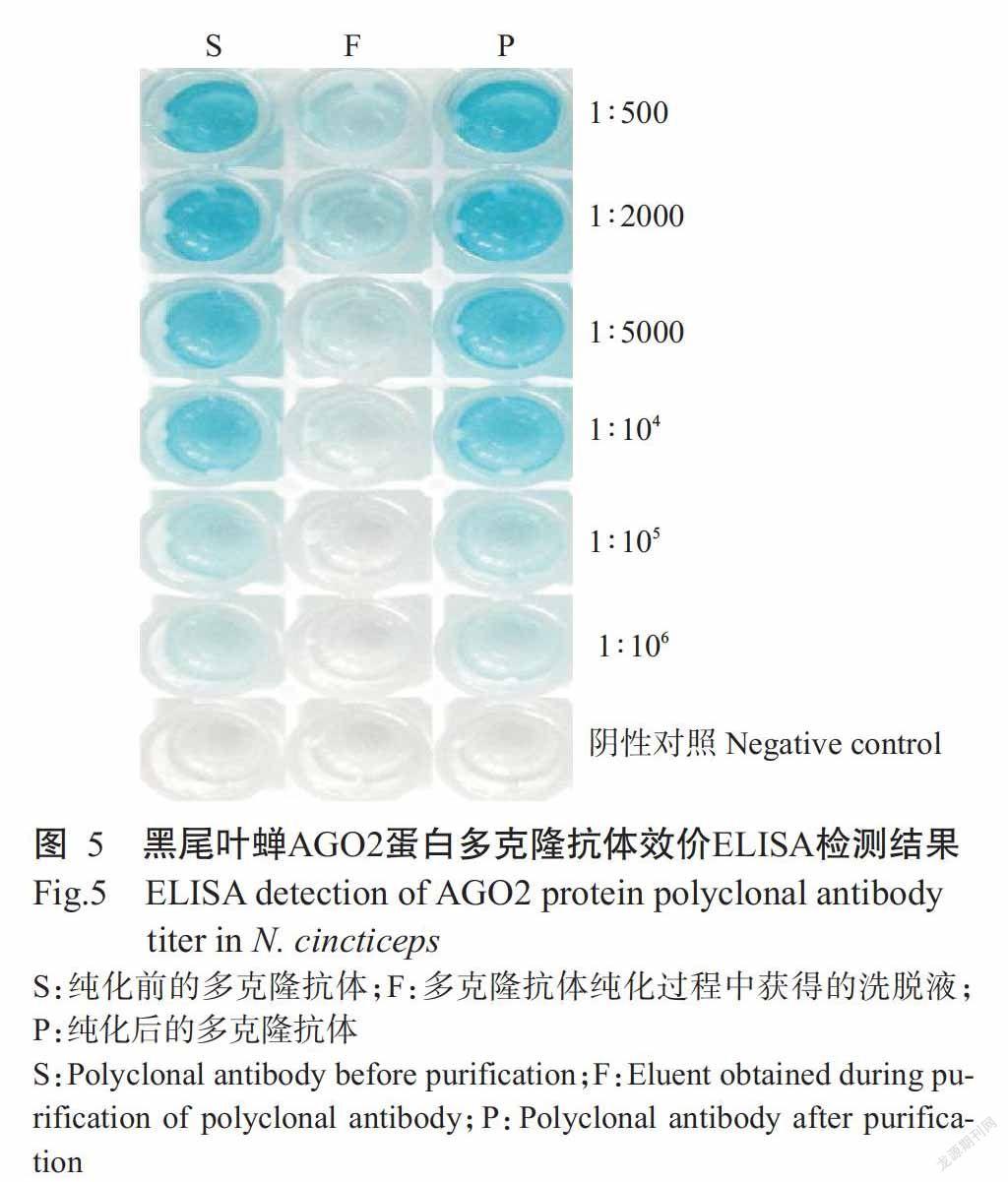
以纯化AGO2融合蛋白免疫雄性新西兰大白兔获得的多克隆抗血清按不同比例稀释后作为一抗进行ELISA检测,结果显示,阴性对照(免疫前抗血清)无颜色反应,免疫获得的多克隆抗血清按不同比例稀释后均有颜色反应(图5),能检测到抗原抗体特异结合所呈颜色反应的最大稀释比为1∶106,即多克隆抗体效价为1∶106。
多克隆抗体经亲和配体纯化后,以ELISA检测其抗体效价,结果显示,阴性对照(纯化后的免疫前抗血清)无颜色反应,而纯化后按不同比例稀释的多克隆抗体均有颜色反应,纯化多克隆抗体效价也为1∶106。多克隆抗体纯化过程中获得的洗脱液颜色反应较微弱(图5),表明大部分抗体能与亲和配体结合后得以纯化,经测定多克隆抗体浓度约350 μg/mL。此外,纯化后的多克隆抗体经SDS-PAGE电泳能检测到抗体免疫球蛋白的单一重链,进一步说明制备获得的多克隆抗体纯度较高。
2. 3 多克隆抗体检测黑尾叶蝉AGO2蛋白表达水平的效果
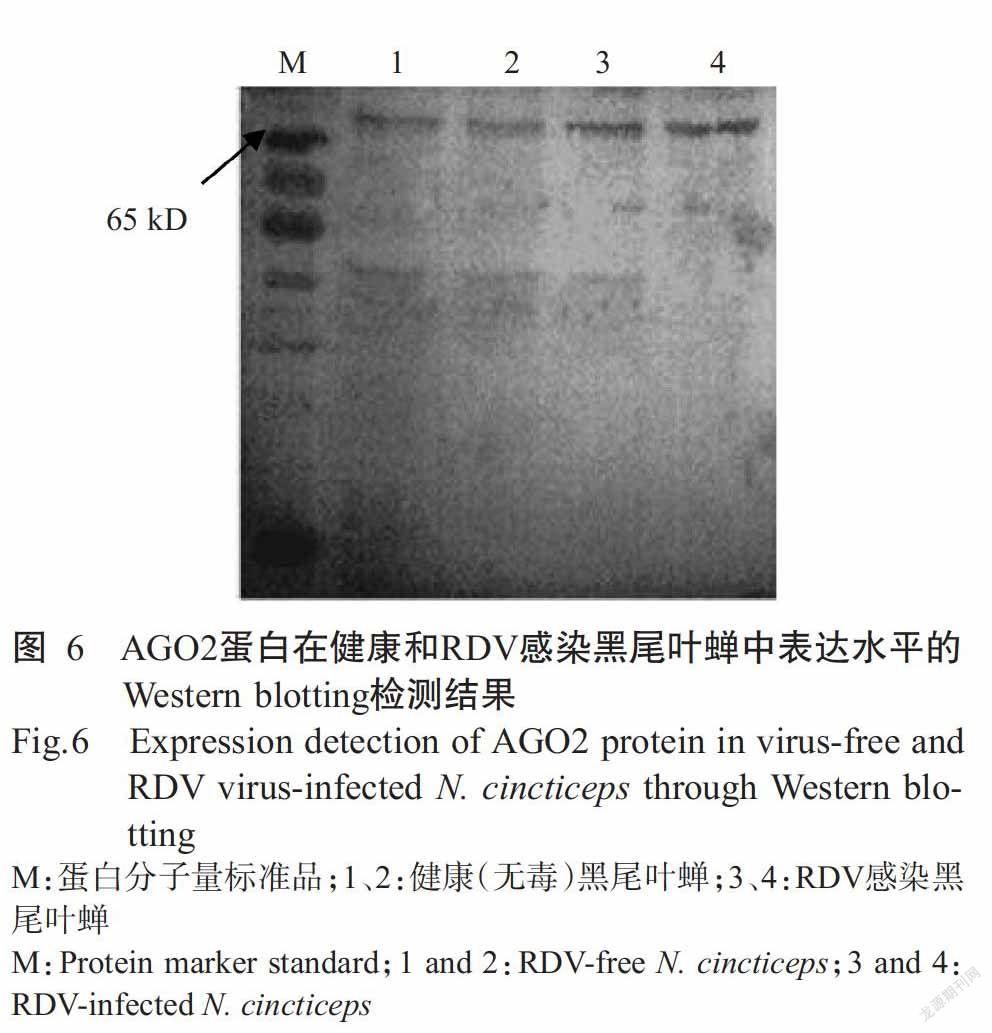
采用制备的多克隆抗体检测AGO2蛋白在健康和RDV感染黑尾叶蝉中的表达水平,Western blo-tting检测结果表明,AGO2蛋白在健康和RDV感染黑尾叶蝉中均有表达(图6);但与健康黑尾叶蝉相比,AGO2蛋白在RDV感染黑尾叶蝉中的表达水平更高,即RDV侵染能提高AGO2蛋白的表达水平,也表明AGO2融合蛋白免疫新西兰大白兔后制备获得的多克隆抗体特异性强,可用于后续研究。
3 讨论
AGO蛋白是RNAi途径中沉默RISC的核心成分之一(Ding,2010),在RNAi途径中发挥着不可替代的作用(Guo et al.,2019)。叶蝉和飞虱都是热带亚热带地区水稻的主要害虫,但由于受到基因组背景的限制,叶蝉和飞虱究竟具有几种AGO蛋白尚不清楚。此外,目前虽已有研究报道黑尾叶蝉、灰飞虱和白背飞虱RNAi途径中AGO2基因在调控水稻病毒侵染时发挥重要作用(兰汉红,2015;Lan et al.,2015,2016),但AGO2的相关作用机制也尚未明确。因此,制备黑尾叶蝉AGO2抗体有利于进一步探讨AGO蛋白的生物学功能及其在RNAi途径中发挥的作用,为从分子水平揭示其作用机理打下基础。
抗体制备是研究目的基因转录和表达等特性、蛋白间相互作用、蛋白亚细胞定位及蛋白生物学功能的基础(Wootla et al.,2014)。目前,利用重组蛋白免疫新西兰大白兔制备多克隆抗體的方法成熟、过程简单,且制备周期短(贾慧娜和罗海玲,2012),因此已得到推广应用。成功制备抗体的关键在于选择合适的蛋白抗原区段,而抗原区段的选择主要以亲水性、疏水性、可及性、抗原性、可塑性、二级结构预测和电荷分布等为参考,其中亲水性和可及性是形成抗原表位的首要条件(Tiller and Tessier,2015)。本研究通过分析黑尾叶蝉AGO2蛋白分子的抗原指数、可及性、亲水性和疏水性等特性,选取抗原指数较高的304~846 aa区段作为抗原,构建原核表达载体并进行高效表达,获得的AGO2融合蛋白经Ni2+-NTA琼脂糖亲和层析纯化后作为抗原免疫雄性新西兰大白兔,成功制备获得黑尾叶蝉AGO2多克隆抗体,且证实制备获得的AGO2多克隆抗体纯度较高,其浓度和效价分别为350 μg/mL和1∶106。
叶蝉是目前水稻生产中的重大害虫,但尚缺乏有效的防治措施(Lan et al.,2016)。在家蚕、血吸虫、绿僵菌、水稻及拟南芥等物种(杨燕萍等,2010;汪章勋等,2013;程小玲和杨加伟,2014;朱兵等,2018)虽有AGO蛋白抗体制备及应用的相关报道,但很少将其应用于AGO蛋白作用机理研究。本课题组前期的研究表明,干扰飞虱或叶蝉AGO2基因表达后,水稻病毒在介体昆虫内的复制增殖水平显著提高(Xu et al.,2012;Li et al.,2013;兰汉红等,2015),暗示飞虱或叶蝉AGO2蛋白组分在RNAi抗病毒免疫中发挥重要作用。本研究利用制备获得的高效价AGO2多克隆抗体,通过Western blotting检测得知AGO2蛋白在健康和RDV感染黑尾叶蝉中均有表达,但在RDV感染黑尾叶蝉中的表达水平更高,与RDV感染能提高AGO2转录水平的结论(兰汉红,2015)一致。这也进一步证实黑尾叶蝉RNAi免疫途径中AGO2蛋白在与RDV的互作过程中发挥了重要作用。此外,利用制备获得的AGO2多克隆抗体将有助于揭示RNAi途径的具体作用机制,从而找到防治黑尾叶蝉的有效办法或靶点。
4 结论
制备获得的黑尾叶蝉RNAi途径关键蛋白AGO2多克隆抗体具有高纯度和高效价,且特异性强,可用于检测AGO2蛋白在病毒感染黑尾叶蝉中的表达水平,进而揭示AGO2蛋白在介体昆虫RNAi途径中的功能机制。
参考文献:
程小玲,杨加伟. 2014. 水稻Argonaute 2蛋白的原核表达与多克隆抗体制备[J]. 西北植物学报,34(10):1951-1955. [Cheng X L,Yang J W. 2014. Prokaryotic expression and polyclonal antibody preparation of Argonaute 2 in rice (Oryza sativa L.)[J]. Acta Botanica Boreali-Occidentalia Sinica,34(10):1951-1955.]
戴仁怀,倪琳. 2011. 黑尾叶蝉对寄主选择性及机理初步研究[J]. 湖北农业科学,50(17):3549-3551. [Dai R H,Ni L. 2011. Preliminary study on host selectivity and mechanism of Nephotettix cincticeps(Uhler)[J]. Hubei Agricultural Sciences,50(17):3549-3551.]
贾慧娜,罗海玲. 2012. 多克隆抗体制备方法的研究进展[J]. 中国草食动物科学,32(S1):66-69. [Jia H N,Luo H L. 2012. Progress in preparation of polyclonal antibodies[J]. China Herbivore Science,32(S1):66-69.]
兰汉红. 2015. 介体昆虫RNA干扰途径调控水稻病毒的侵染[D]. 福州:福建农林大学. [Lan H H. 2015. RNA interference pathway modulates the infection of rice viruses in insect vectors[D]. Fuzhou:Fujian Agriculture and Fo-restry University.]
兰汉红,张玲华,刘宇艳,陈红艳,贾东升,陈倩,魏太云. 2015. RNA干扰途径调控南方水稻黑条矮缩病毒在介体白背飞虱体内的持久侵染[J]. 科学通报,60(15):1361-1369. [Lan H H,Zhang L H,Liu Y Y,Chen H Y,Jia D S,Chen Q,Wei T Y. 2015. An RNA interference pathway modulates the persistent infection of Southern rice black-streaked dwarf virus in insect vector,Sogatella furcifera[J]. Chinese Science Bulletin,60(15):1361-1369.]
汪章勋,孟慧敏,周权. 2013. 绿僵菌Argonaute基因片段原核表达载体的构建及其表达[J]. 安徽科技学院学报,27(6):39-43. [Wang Z X,Meng H M,Zhou Q. 2013. Construction and expression of the prokaryotic expression vector of argonaute gene related segment from Metarhizium anisopliae[J]. Journal of Anhui Science and Technology University,27(6):39-43.]
楊燕萍,郭素霞,陈晶,林矫矫,刘宗平,程国锋. 2010. 编码日本血吸虫Argonaute蛋白全长cDNA克隆、表达及初步鉴定[J]. 中国人兽共患病学报,26(9):830-834. [Yang Y P,Guo S X,Chen J,Lin J J,Liu Z P,Cheng G F. 2010. Cloning,expression and identifying of a full-lenght cDNA encoding argonaute from Schistosoma japonicum[J]. Chinese Journal of Zoonoses,26(9):830-834.]
朱兵,曹赟洁,周雍,盛清,聂作明. 2018. 家蚕AGO2蛋白的单克隆抗体制备[J]. 蚕业科学,44(3):376-381. [Zhu B,Cao Y J,Zhou Y,Sheng Q,Nie Z M. 2018. Preparation of monoclonal antibody against BmAGO2 protein of silkworm[J]. Science of Sericulture,44(3):376-381.]
Bronkhorst A W,van Rij R P. 2014. The long and short of antiviral defense:Small RNA-based immunity in insects[J]. Current Opinion in Virology,7:19-28. doi: 10.1016/j.coviro.2014.03.010.
Chen H,Chen Q,Omura T,Uehara-Ichiki T,Wei T. 2011. Sequential infection of Rice dwarf virus in the internal organs of its insect vector after ingestion of virus[J]. Virus Research,160(1-2):389-394.
Ding S W. 2010. RNA-based antiviral immunity[J]. Nature Reviews. Immunology,10(9):632-644. doi:10.1038/nri 2824.
Guo Z,Li Y,Ding S W. 2019. Small RNA-based antimicrobial immunity[J]. Nature Reviews. Immunology,19(1):31-44. doi: 10.1038/s41577-018-0071-x.
Karlikow M,Goic B,Saleh M C. 2014. RNAi and antiviral defense in Drosophila:Setting up a systemic immune response[J]. Developmental and Comparative Immunology,42(1):85-92.
Lan H,Chen H,Liu Y,Jiang C,Mao Q,Jia D,Wei T. 2015. Small interfering RNA pathway modulates initial viral infection in the midgut epithelium of insect after ingestion of virus[J]. Journal of Virology,90(2):917-929.
Lan H,Wang H,Chen Q,Chen H,Jia D,Mao Q,Wei T. 2016. Small interfering RNA pathway modulates persistent infection of a plant virus in its insect vector[J]. Scien-tific Reports,6:20699. doi: 10.1038/srep20699.
Lee Y S,Nakahara K,Pham J W,Kim K,He Z,Sontheimer E J,Carthew R W. 2004. Distinct roles for Drosophila Di-cer-1 and Dicer-2 in the siRNA/miRNA silencing pathways[J]. Cell,117(1):69-81.
Li J M,Andika I B,Shen J F,Lv Y,Ji Y,Sun L,Chen J. 2013. Characterization of Rice black-streaked dwarf virus- and Rice stripe virus-derived siRNAs in singly and doubly infected insect vector Laodelphax striatellus[J]. PLoS One,8(6):e66007.
Qu F,Ye X,Morris T J. 2008. Arabidopsis DRB4,AGO1,AGO7,and RDR6 participate in a DCL4-initiated antiviral RNA silencing pathway negatively regulated by DCL1[J]. Proceedings of the National Academy of Sciences of the United States of America,105(38):14732-14737.
Tiller K E,Tessier P M. 2015. Advances in antibody design[J].
Annual Review of Biomedical Engineering,17:191-216.
van Rij R P,Saleh M C,Berry B,Foo C,Houk A,Antoniewski C,Andino R. 2006. The RNA silencing endonuclease Argonaute 2 mediates specific antiviral immunity in Drosophila melanogaster[J]. Genes and Development,20 (21):2985-2995.
Vaucheret H. 2008. Plant Argonautes[J]. Trends in Plant Scien-ce,13(7):350-358.
Wootla B,Denic A,Rodriguez M. 2014. Polyclonal and monoclonal antibodies in clinic[M]//Human Monoclonal Antibodies. Rochester: Humana Press: 79-110.
Xu Y,Huang L Z,Fu S,Wu J,Zhou X. 2012. Population diversity of rice stripe virus-derived siRNAs in three diffe-rent hosts and RNAi-based antiviral immunity in Laodelphgax striatellus[J]. PLoS One,7(9):e46238.
(責任编辑 兰宗宝)
