基于仿生提取法研究黄精蒸制过程抗氧化活力动态变化
2019-09-10金剑劳嘉钟灿贺炜蔡媛周伟良邓敏张水寒
金剑 劳嘉 钟灿 贺炜 蔡媛 周伟良 邓敏 张水寒


〔摘要〕 目的 研究黄精蒸制加工过程的抗氧化活力动态变化,探讨黄精九蒸九制的机理。方法 对比仿生提取和化学提取黄精样品的抗氧化活力,采用ABTS、FRAP和AAPH法测定不同蒸制次数黄精样品抗氧化活力动态变化。结果 仿生提取的抗氧化活力整体更强,最高是化学提取的2.97倍。抗氧化活力随着蒸制次数增加而增强。ABTS、FRAP和AAPH 3种方法的测定结果显示,黄精蒸制后抗氧化活力较鲜黄精分别增强了1.35、2.54和2.53倍。结论 仿生提取更能全面的代表黄精的抗氧化能力,抗氧化活力的增强是黄精炮制增效的一个很好解释。
〔关键词〕 黄精;仿生提取;蒸制;抗氧化
〔中图分类号〕R284.2;R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.07.010
〔Abstract〕 Objective To investigate the dynamic changes of antioxidant activity of Polygonati Rhizoma during the process of steaming and to explore the mechanism of nine-time steaming and nine-time processing of Polygonati Rhizoma. Methods Polygonati Rhizoma samples with different steaming times were extracted by biomimetic and chemical extraction. The antioxidant activity was determined by ABTS, FRAP and AAPH methods. Results The antioxidant activity of the bionic extraction was stronger overall, and the highest was 2.97 times to that of the chemical extraction. The antioxidant activity was increased as the times of steaming increased. According to the results of ABTS, FRAP and AAPH, the antioxidant activity of steamed Polygonati Rhizoma was respectively 1.35, 2.54 and 2.53 times higher than that of the fresh samples. Conclusion Bionic extraction can more comprehensively represent the antioxidant capacity of Polygonati Rhizoma, and the enhancement of the antioxidant activity is a good explanation for the enhanced efficacy of Polygonati Rhizoma after the steaming process.
〔Keywords〕 Polygonati Rhizoma; bionic extraction; steaming; antioxidant
黃精是我国重要的大宗药食两用中药资源,具有补气养阴、健脾、润肺、益肾等功效[1]。黄精生品具有刺激性,不宜鲜食,传统认为其需要九蒸九制,以增效减毒。研究表明,在黄精的蒸制过程中,5-羟甲基麦芽酚[2]、5-羟甲基糠醛[3]、皂苷[4]和糖类[5]等成分发生了变化。但是蒸制过程中,增效机理尚不清楚。
黄精具有抗氧化、降血糖、抗疲劳、提高免疫等药理作用[6]。其中,抗氧化是药食两用中药资源常见的功效作用,可以降低机体内氧代谢物对机体的损伤作用,从而保护机体[7]。然而,对于抗氧化评价,大多采用化学提取方式对某一类极性相似的化学成分进行抗氧化活性分析[8],而忽略了中药是多成分协同作用的整体。仿生提取利用“灰思维方式”,根据中药大部分药效成分未知的特点和中药物质基础整体特征,采用模拟口服给药经胃肠道吸收和转运的过程,得到有效成分更高的活性混合物[9]。仿生提取已部分应用于当归、黄芪、水蛭等中药[10-11],本研究首次采用仿生提取法探讨黄精蒸制过程的抗氧化活力动态变化。
1 材料与方法
1.1 主要试剂与仪器
仿生提取试剂α-淀粉酶和胆汁盐购买于合肥博美生物科技有限责任公司;胃蛋白酶和胰酶购买于Gen-View公司。2,2’-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三吡啶基三嗪(TPTZ)、2,2'-偶氮二异丁基脒二盐酸盐(AAPH)和6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)均购买于Sigma-Aldrich公司;UV 2450紫外分光光度计(日本岛津公司);PHS-3E酸度计(上海佑科仪器仪表公司);Vortex-5振荡器(海门市麒麟医用仪器厂);LDZX-75KRBS立式高压蒸锅(上海申安医疗器械厂);H3-20K台式高速离心机(湖南可成仪器设备公司)。
1.2 鲜黄精药材
鲜黄精药材收集于湖南省新化县,经湖南省中医药研究院刘浩和谢昭明老师鉴定为多花黄精(Polygonatum cyrtonema Hua),为2015版《中华人民共和国药典》一部所收载的品种。
1.3 黄精蒸制过程
将鲜黄精去根须,洗净,晾干,切厚片,置于温度121 ℃,0.12 Mpa条件下蒸制,蒸制时间为30 min。待黄精隔夜自然冷却后进行第二次蒸制,直至蒸制9次[5]。
1.4 化学提取
将黄精样品干燥至恒重,打粉,过三号筛。取25 mg样品加入5 mL甲醇-水(50∶50 v/v),室温下振荡60 min,离心(9 000 r/min,10 min),取上清液Ⅰ备用;沉淀中加入5 mL丙酮-水(70∶30 v/v),室温下振荡60 min,离心(9 000 r/min,10 min),取上清液Ⅱ。分别将上清液Ⅰ和上清液Ⅱ合并得到上清液Ⅲ,用于抗氧化活性测定[12]。
1.5 仿生提取
将干燥粉碎的0~9号黄精样品各取25 mg加入5 mL超纯水,加入α-淀粉酶溶液,37 ℃振荡110 r/min,30 min。6 mol/L HCl调节提取体系pH为2后,加入胃蛋白酶溶液,37 ℃加水浴振荡110 r/min,2 h。1 mol/L NaHCO3调节提取体系pH为6后,加入胰酶和胆汁盐混合液,用1 mol/L NaHCO3调pH为7.5,37 ℃振荡110 r/min。2 h后100 ℃水浴中热处理4 min(酶钝化),冰浴冷却样品后离心(9 000 r/min,10 min),分别收集0~9号黄精样品上清液Ⅳ用于抗氧化活性测定。以超纯水替换黄精样品作为空白测定仿生提取体系抗氧化活力。其中,仿生提取体系中所用酶浓度和用量参照[12-13]操作。
1.6 抗氧化活性测定
1.6.1 ABTS法 将7 mmol/L的ABTS溶液与2.45 mmol/L的过硫酸钾溶液混合,在室温黑暗环境下放置12~16 h。分别取0.2 mL上清液Ⅲ和Ⅳ,加入2.8 mL稀释后的混合液,反应20 min后用紫外分光光度计测定吸光度。用Trolox水溶液制作标准曲线,计算每克样品相当于多少Trolox[12-13]。
1.6.2 FRAP法 分别取0.2 mL上清液Ⅲ和Ⅳ加2.8 mL预热至37 ℃的 FRAP试剂,反应30 min后在595 nm波长下用紫外分光光度计测定吸光度。用Trolox标准溶液计算每克样品相当于多少Trolox[12,14]。
1.6.3 AAPH法 取0.4 mL靛蓝指示剂与2.3 mL磷酸缓冲液混合后,加入0.2 mL AAPH溶液和0.1 mL上清液Ⅲ和Ⅳ,摇匀,37 ℃水浴65 min后在610 nm测定其吸光度。用Trolox水溶液制作标准曲线,计算Trolox相当量[15]。
1.7 数据分析
实验进行3个重复,数据为“x±s”,采用Origin软件进行统计学方差分析,显著差异水平设置为P<0.05。
2 结果
2.1 仿生提取与化学提取的抗氧化活力比较
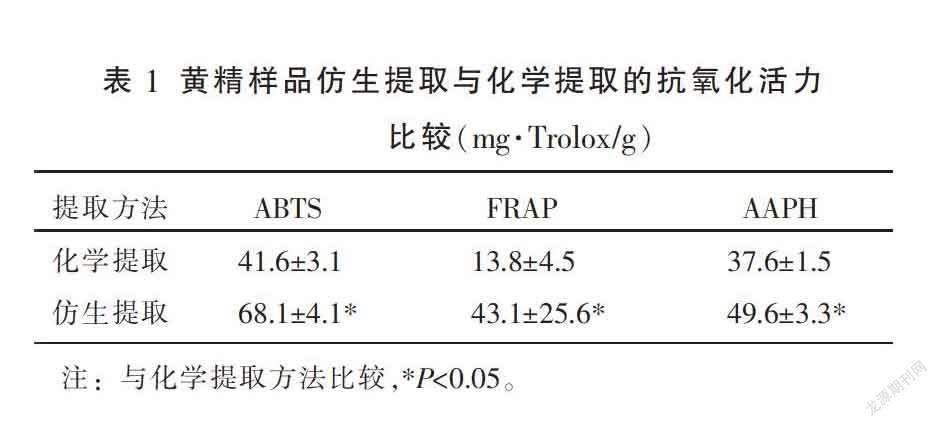
分别采用仿生提取和化学提取方法提取新鲜黄精样品,进行抗氧化活力比较,其抗氧化活力见表1。ABTS方法测定下,化学提取的黄精样品抗氧化活力是41.6 mg Trolox/g,而仿生提取的抗氧化活力值是68.1 mg Trolox/g。FRAP方法测定下,化学提取的黄精样品抗氧化活力是13.8 (mg·Trolox/g),仿生提取的抗氧化活力值是43.1 mg Trolox/g。AAPH方法測定下,化学提取的黄精样品抗氧化活力是37.6 mg Trolox/g,仿生提取的抗氧化活力值增加到了49.6 mg Trolox/g。通过比较发现,采用仿生提取的抗氧化活力明显强于化学提取,其中ABTS法中,仿生提取最大是化学提取的1.64倍,FRAP法是2.97倍,AAPH法是1.32倍,且均存在显著差异(P<0.05)。
2.2 不同蒸制次数黄精的颜色变化
黄精经过蒸制后,其颜色发生了变化,如图1所示。鲜黄精未经蒸制干燥后呈现白色略带黄色,蒸制之后呈现黄色,且在1~5次范围内,随着蒸制次数的增加,颜色加深。蒸制4次后,黄精干燥品基本呈现黑色。
2.3 不同蒸制次数黄精的抗氧化活力变化
通过仿生提取法,分别采用ABTS、FRAP和AAPH方法对黄精蒸制过程的抗氧化活性进行测定,结果如图2。在蒸制1~5次范围内,随着蒸制次数增加,黄精样品的抗氧化活力逐渐增强,在蒸制5次之后,抗氧化活力逐渐趋于平稳。黄精经蒸制后,其最高抗氧化活力与鲜黄精相比,ABTS、FRAP和AAPH测定下,分别增强了1.35、2.54和2.53倍。
3 讨论
本研究首先对比了黄精仿生提取和化学提取的抗氧化活力。仿生提取过程通过调控酶、pH和温度等环境因素来模拟口腔、胃肠道吸收和转运过程,提取液中包含人体可利用有效成分更高的活性混合物[9]。仿生提取方式也符合中药资源多成分协同作用的整体特征。仿生提取液抗氧化活力更强,更能全面的代表黄精的抗氧化能力,为其他药食两用中药资源的提取方案提供了参考。
本研究进一步基于仿生提取,以ABTS、FRAP和AAPH法研究黄精蒸制加工过程的抗氧化动态变化,探讨黄精九蒸九制的炮制机理。ABTS经活性氧氧化后生成稳定的蓝绿色阳离子自由基,抗氧化物质的存在会有反应体系褪色[16]。FRAP法是基于氧化还原反应,在酸性pH环境下,Fe3+与TPTZ形成复合物,在还原物质的作用下,复合物被抗氧化物质还原为二价铁而呈现明显的蓝色[17]。AAPH法则是评估抗氧化物质通过氢原子转移来清除AAPH产生的自由基的能力[16]。这3种方法都是常见的抗氧化活力体外评价方法[16-17]。黄精富含多糖[18]、多酚[19]等物质,是一种极具潜力的天然抗氧化剂,能通过降低活性氧水平来延缓大鼠骨髓细胞衰老进程[20]。研究发现随着蒸制过程进行,抗氧化活力增加,蒸制达到一定的程度,抗氧化活力趋于稳定。这也与黄精蒸制颜色变化相一致,随着颜色加深,抗氧化活力增强[21]。可见,不同蒸制抗氧化活力的增强,是黄精炮制增效的原因之一。
参考文献
[1] 常 亮,陈珍珍,吴 毅,等.HPLC-ELSD法测定黄精炮制过程中四种糖的含量[J].中国现代中药,2016,18(12):1653-1656.
[2] 曾林燕,宋志前,魏 征,等.黄精炮制过程中新产生成分分离及含量变化[J].中草药,2013,44(12):1584-1588.
[3] 钟凌云,张 莹,霍慧君,等.黄精炮制前后成分及药效变化初步研究[J].中药材,2011,34(10):1508-1511.
[4] 杨圣贤,杨正明,陈奕军,等.黄精“九蒸九制”炮制过程中多糖及皂苷的含量变化[J].湖南师范大学学报(医学版),2015,5:141-144.
[5] JIN J, LAO J, ZHOU R, et al. Simultaneous identification and dynamic analysis of saccharides during steam processing of rhizomes of Polygonatum cyrtonema by HPLC-QTOF-MS/MS[J]. Molecules,2018,23(11): 2855.
[6] 杨华杰,龚千锋,于 欢,等.黄精不同炮制品抗疲劳及抗氧化作用比较研究[J].江西中医药,2018(2):64-67.
[7] 詹 皓,沈竟民,姜桂荣.中药抗氧化作用的研究概况[J].中国中药杂志,1990,15(10):54-57.
[8] JARA P J, FULGENCIO S C. Literature data may underestimate the actual antioxidant capacity of cereals[J]. Journal of Agricultural and Food Chemistry, 2005,53(12): 5036-5040.
[9] 王秋红,赵 珊,王鹏程,等.半仿生提取法在中药提取中的应用[J].中国实验方剂学杂志,2016,18:187-191.
[10] 吴国泰,景琪,刘五州,等.当归黄芪半仿生提取物对腹部术后大鼠胃肠运动功能障碍的影响[J].中国现代应用药学,2016,33(5):533-539.
[11] 单 宇,张伽妹,丁月珠.水提取法和仿生提取法研究水蛭不同炮制品的体外抗凝活性[J].中国中药杂志,2016,41(10):1843-1848.
[12] PASTORIZA S, DELGADO-ANDRADE C, HARO A, et al. A physiologic approach to test the global antioxidant response of foods: the GAR method[J]. Food Chemistry, 2011,129(4): 1926-1932.
[13] RUFIAN-HENARES J A, DELGADO-ANDRADE C. Effect of digestive process on Maillard reaction indexes and antioxidant properties of breakfast cereals[J]. Food Research International, 2009,42(3): 394-400.
[14] BENZIE I F F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay [J]. Analytical Biochemistry,1996,239(1): 70-76.
[15] PEREZ-BURILLO S, RUFIAN-HENARES J A, PASTORIZA S. Towards an improved global antioxidant response method (GAR+): physiological-resembling in vitro digestion-fermentation method[J]. Food Chemistry, 2018, 239:1253-1262.
[16] 周昇昇,楊月欣.抗氧化能力体外评价方法的进展和比较[J].卫生研究,2010,39(2):164-167.
[17] 陈玉霞,刘建华,林 峰,等.DPPH和FRAP法测定41种中草药抗氧化活性[J].实验室研究与探索,2011,30(6):11-14.
[18] 王玉勤,吴晓岚,张广新,等.黄精多糖对大鼠抗氧化作用的实验研究[J].中国现代医生,2011,49(5):6-11.
[19] 张国强,郭晓东,薛文华,等.西藏野生卷叶黄精多酚的提取及其抗氧化活性分析[J].食品科学,2017,38(6):236-241.
[20] 秦 臻,韦正新,宰青青,等.黄精降低活性氧水平促进衰老内皮祖细胞功能的研究[J].中国药理学通报,2019,35(1):123-127.
[21] SIAH S, WOOD J A, AGBOOLA S, et al. Effects of soaking boiling and autoclaving on the phenolic contents and antioxidant activities of faba beans (Vicia faba L.) differing in seed coat colours[J]. Food Chemistry, 2014,142: 461-468.
