超长链脂肪酸的研究进展
2019-09-10万静雅涂行浩魏芳江正兵徐淑玲吕昕董绪燕向极钎Siew-youngQuek陈洪
万静雅 涂行浩 魏芳 江正兵 徐淑玲 吕昕 董绪燕 向极钎 Siew-young Quek 陈洪

摘 要:对超长链脂肪酸的合成代谢途径、生物学功能、分离纯化方法、分析检测技术以及应用等进行综述,并对其研究及应用前景进行了展望。
关键词:超长链脂肪酸;延长;生物学功能;分离;定量分析
超长链脂肪酸(VLCFAs)目前还无统一的碳链长度定义,但大多数研究者认为其一般是指碳链长度在20以上的脂肪酸[1-2]。根据碳链上双键数目的不同,VLCFAs一般可分为超长链饱和脂肪酸(VLCSFAs)、超长链单不饱和脂肪酸(VLCMUFAs)和超长链多不饱和脂肪酸(VLCPUFAs)。按照ω编号系统又可以分为ω-3、ω-6、ω-9脂肪酸。在动物体中,超长链脂肪酸作为营养物质及皮肤屏障组成对动物体的生长发育起着至关重要的作用。在植物体中,超长链脂肪酸不仅能作为能源物质,参与种子中甘油酯、生物膜膜脂及鞘脂的合成,并为角质层蜡质的生物合成提供前体物质[3],还以蜡质的形式存在于植物表皮细胞中,对植物体的保水抗旱能力及生长发育发挥着重要作用。在一些真菌和细菌中同样存在着超长链脂肪酸,为其生命活动提供保障。在细胞中,超长链脂肪酸不仅是磷脂层的重要组成成分,并有研究认为,其作为信号分子也担负着细胞间的交流与信号传导功能[4]。超长链脂肪酸在食品、医疗及工业上也有着广阔的应用价值。本文主要综述了超长链脂肪酸的生物学功能、分离纯化方法、分析检测技术及应用方面的研究进展,并对其应用前景进行了展望。
1 超长链脂肪酸的生物学功能
超长链脂肪酸的延长机制是由缩合反应、还原反应、水解反应、还原反应四个核心步骤来完成的,每个步骤需要用到不同的酶,每个循环可将底物分子增加2个碳单位[5]。
1.1 超长链脂肪酸对细胞生命活动的意义
超长链脂肪酸作为磷脂分子的重要组成部分,在细胞内对细胞生化反应、营养物质的储藏及细胞间的交流都发挥着重要作用。脂肪酸积累过多,由于输送和利用间的不平衡可能会对一些组织细胞产生毒性,其表现为氧化应激和炎症,甚至导致细胞凋亡[6]。Laura R.Parisi等[7]使用非靶向液质联用(LC-MS)技术在分子水平上探究了细胞程序性死亡期间脂类物质的调节情况,发现神经酰胺和超长链脂肪酸会在这个过程中积累,通过添加一种脂肪酸合成酶抑制剂——浅蓝菌素,发现其能抑制脂肪酸的生物合成以及消耗超长链脂肪酸,可更好地保持质膜的完整性并防止细胞死亡。
1.2 超长链脂肪酸对植物生命活动的作用
植物表皮细胞会在植物叶片表面形成一种叫蜡质的保护物质,其主要化学成分是高级脂肪酸及高级一元醇的脂类物质,这其中有着多种VLCFA衍生物,包括游离脂肪酸、醛、酮、伯醇、仲醇、烷烃和烷基酯。此外,许多植物的角质蜡还含有环状化合物,如三萜类化合物和芳香族化合物[8]。Bigang Mao等[9]研究了水稻基因WSL2突变体的遗传、生理及形态学特征,发现该突变体相比野生型对干旱胁迫更敏感,因WSL2基因与超长链脂肪酸的碳链延伸有关,因此进一步证实了植物表皮蜡质中超长链脂肪酸的保水抗旱功能。一些研究还表明,超长链脂肪酸及其衍生物对植物的抗寒性能、花粉的形成及可育性也起到了一定的作用[10]。
超长链脂肪酸是合成三酰甘油、蜡质和鞘脂类物质的一类脂肪酸,而这些脂类物质是种子贮藏营养物质所必需的。细胞分裂素是调控植物生长发育的重要植物激素,Takashi Nobusawa等[11]通过研究拟南芥超长链脂肪酸合成缺陷的突变体,发现植物表皮中的超长链脂肪酸对植物的正常发育是必要的,轻度降低超长链脂肪酸的含量可以促进细胞增殖,从而促进芽的生长,过多的超长链脂肪酸会抑制细胞分裂素的合成,这是抑制植物脉管系统过度增殖所必需的。Yong-Mei Qin等[12]发现,在胚珠的培养基中添加超长链饱和脂肪酸(从C20∶0到C30∶0)能显著地促进棉花纤维细胞的伸长,除草剂中的乙草胺会抑制纤维的生长,而超长链饱和脂肪酸C24∶0在没有乙烯生物合成抑制剂时可以解除乙草胺对纤维生长的抑制效果。徐宗余等[13]证实,噬吩草胺及其类似物的存在会导致由油酸延长而成的超长链单不饱和脂肪酸的合成效果降低,这为除草剂的研究提供了科学依据。
1.3 超长链脂肪酸对动物生长发育的影响
超长链脂肪酸作为皮肤屏障的组成成分可以起到对人体的保护作用。Miyoung Suh等[14]研究表明,在新生儿发育过程中,通过在膳食中少量添加ARA和DHA足以影响视觉细胞膜的超长链脂肪酸组成,也影响着视紫红质及光感受细胞的发育。Wenmei Li等[15]研究发现,ELOVL4缺陷型小鼠会由于其超长链脂肪酸衍生的神经酰胺的缺乏,从而致使皮肤产生通透性屏障功能缺陷并造成小鼠在新生期死亡。Matthew S.Thimgan等[16]研究bgm和hll缺陷型果蠅证明了参与脂质代谢的基因可以调节睡眠的动态平衡,并认为睡眠不足或者体质指数(BMI)增加可能与超长链脂肪酸有关。Bernice H.Wong等[17]对敲除Mfsd2a基因的小鼠进行实验,发现Mfsd2a介导的LPC转运是人脑生长所必需的,通过Mfsd2a转运LPC是眼睛从血液中摄取DHA及发展光感受器膜盘的重要途径。M.Suh等[18]对喂食ARA及DHA的大鼠视网膜进行分析,证实在断奶前后期饮食中的ARA和DHA摄入量是影响视觉细胞膜脂肪酸组成及发育的重要因素。James L.Hargrove等[19]讨论了在粗谷物、蜂蜡和许多植物衍生食品中发现的蜡酯、脂肪酸和醇产生的营养及调节作用,提出从植物蜡和蜂蜡中提取的超长链脂肪醇能够降低人体血浆胆固醇,每天食用几克小麦胚芽油可提高身体耐力、抵抗身体压力并有利于训练后的身体恢复。
2 超长链脂肪酸的分离与纯化方法
超长链脂肪酸可以通过化学合成的方式获得,也可以通过转基因的方式在植物或者微生物中生产,但这些方法容易引入较多杂质并对生态环境产生影响,因此,从天然生物体中获得并分离出各种超长链脂肪酸引起了研究者们的关注。目前超长链脂肪酸的分离纯化方法主要有薄层色谱法与柱层析法、金属盐沉淀法与重结晶法、超临界萃取法、尿素包合法及分子蒸馏法等。除上述方法外,也有少部分研究者利用乳化分离法、气相色谱法及高效液相色谱法等对超长链脂肪酸进行分离纯化。
2.1 薄层色谱法与柱层析法
薄层色谱法(TLC)的原理是固-液吸附,在玻璃板、塑料或者金属板上涂上固定相形成薄层,再利用展开剂将需分离的样品在固定相中展开,以此来达到样品的快速分离与纯化。该方法的特点是操作简便,适用于少量样品的分离纯化,分离出的物质纯度较高,可用于样品的精制。吸附剂及展开剂的选择对于样品的分离效果有着重要影响。常用的吸附剂有硅胶、硅藻土、氧化铝、纤维素、葡聚糖凝胶、聚酰胺等。展开剂的选择一般是挥发性的有机溶剂,如石油醚、甲醇、正己烷、乙酸乙酯等以及它们的混合体系。王性炎等[20]利用TLC将混合脂肪酸中的神经酸进行分离,经过萃取、结晶,得到了纯度在90%以上的神经酸纯品。叶在荣等[21]利用风干的硅藻土G反向薄层、液体石蜡饱和的乙腈溶剂作为展开剂、0.03%的荧光素乙醇溶液和溴蒸汽作为显色剂,将亚麻酸、亚油酸、油酸、花生烯酸及芥酸这5种不饱和脂肪酸的甲酯很好地分离开。柱层析的原理与TLC相似,也是利用样品各组分在固定相与流动相中的分配系数的不同达到各组分间的分离,但由于柱层析上样量较大,适用于大量样本的分离。
2.2 金属盐沉淀法与重结晶法
金属盐沉淀法是利用混合脂肪酸金属盐因脂肪酸碳链长度及饱和程度等结构上的差异而在有机溶剂中的溶解度不同进行脂肪酸金属盐分离的一种方法。首先将混合脂肪酸经过皂化反应生成脂肪酸金属盐,通过金属盐沉淀法分离后再将脂肪酸金属盐进行酸化从而得到分离后的脂肪酸。侯静德等[22]利用金属盐沉淀法,以丙酮作为溶剂进行脂肪酸的分离,最终可将产物中的神经酸质量百分比提高到82%以上。重结晶法是添加一定量的有机试剂后,将混合脂肪酸置于合适的温度下进行结晶。J.M.Vargas-Lopez等[23]在38~42℃时将混合脂肪酸溶解在乙醇中然后置于-14℃下进行结晶,经过2次结晶后芥酸的纯度达到87.1%。重结晶法常用的有机溶剂有甲醇、乙醇、石油醚、乙醚等,也可将这些物质混合物作为有机溶剂。一般来说,脂肪酸的溶解度随碳链长度增加而减少,随不饱和度的增加而增加,低温有利于多不饱和脂肪酸的富集。该方法操作较简单,但需使用大量溶剂,成本较高,分离效果一般。
2.3 超临界萃取法
超临界萃取法是利用流体(一般为CO2),通过改变温度及压力来控制不同碳链长度和饱和程度的脂肪酸在流体及油相间的分配系数从而达到分离的目的。王建民等[24]利用超临界CO2萃取法,以乙醇作为夹带剂得到神经酸甘油酯粗品。刘伟民等[25]用超临界CO2萃取法在填料塔压为12.5 MPa、塔温40~85℃、CO2流量5 L/min、进料流速0.8 mL/min时将鱼油中DHA和EPA浓度提高至83%,回收率达到84%的最佳分离效果。该方法将蒸馏及萃取相结合,从而能够得到大量纯度较高的分离样品,且CO2属于惰性气体,对自然界无毒,将其作为介质还能防止不饱和脂肪酸的氧化及超长链脂肪酸的分解,但较难分离碳数相同、双键数不同的组分。
2.4 尿素包合法
尿素包合法的原理是利用混合脂肪酸在低温结晶过程中,尿素分子只与饱和脂肪酸及单不饱和脂肪酸相结合形成络合物并在低温下产生结晶,而多不饱和脂肪酸尤其是碳链较长的多不饱和脂肪酸,因其双键较多、碳链较长难以被尿素分子包合,故无法与尿素形成络合物,将结晶后的样品经过过滤处理便可实现部分脂肪酸组分的分离。敬思群等[26]将尿素与鱼油比为1∶1,溶剂与鱼油比为7∶1,置于-5℃下结晶,可将EPA和DHA的含量从56%提高至72%。敬思群等[27]以混合多不饱和脂肪酸为原料,尿素/混合脂肪酸(m/m)=1∶1,混合脂肪酸/乙醇(m/v)=1∶16,包合24h,可将多不饱和脂肪酸含量由68.12%增加到91.35%。该方法成本较低,操作较为简单,能实现大量脂肪酸的分离,适用于超长链多不饱和脂肪酸的分离与纯化,对于被尿素包合的饱和及单不饱和脂肪酸还需进行进一步解析,过程较复杂。
2.5 分子蒸馏法
分子蒸馏法是蒸馏方法的一种,其原理是高真空的条件下,利用不同分子运动自由程的差别导致蒸发速率的不同来达到液体混合物分离的目的。分子蒸馏可以在远低于脂肪酸沸点的温度下进行,同时分子蒸馏时因其真空度很高,因此脂肪酸也不易被氧化。方旭波等[28]以乙基酯类鱼油为原料,经二级分子蒸馏和尿素包合后,EPA和DHA的含量可从30.72%提高到83.42%。周琴芬等[29]研究发现,在温度为110℃、压力低于110 Pa、进料速度为0.02g/s时,可将神经酸乙酯的质量分数提高到87.03%,回收率达到64.55%,采用轻组分再蒸馏法得到神经酸乙酯的质量分数为71.67%。分子蒸馏法分离纯化超长链脂肪酸工艺虽然较复杂,但其过程无毒无污染,可进行大量生产,且得到的产品的纯度较高。
3 超长链脂肪酸的分析检测技术
超长链脂肪酸的定量分析常用到的技术有色谱法、色谱与质谱联用法等,运用这些方法能够在探究超长链脂肪酸的功能、开展其相关应用及提純时有效地对VLCFAs进行定量检测分析。
3.1 气相色谱法及气相色谱质谱联用技术
气相色谱法(GC)是将脂肪酸样品甲酯化、乙酯化或者三甲基硅烷化后,载气作为流动相,利用各组分间的沸点、极性或吸附性能的差异在气相色谱柱进行分离,再串联上火焰电离检测器(FID)、热导检测器(TCD)或者电子俘获检测器(ECD),便可测定出各组分的浓度。该方法比较稳定,但衍生过程较为繁琐。Hazem Jabeur等[30]利用GC-FID法可以检测出脂肪酸甲酯标准溶液中C20∶0、C20∶1、C20∶2、C21∶0以及初榨橄榄油中的C20∶0、C20∶1等超长链脂肪酸含量,并用GC-FID法结合液相色谱法验证了橄榄油中掺入大豆油、向日葵油、玉米油等廉价植物油的阈值,为辨别特纯橄榄油是否掺杂常见植物油提供了科学依据。N C Shantha等[31]将蜂酸(C23∶0)和神经酸作为内标,运用GC-FID法测定了市售鱼油乙基酯胶囊中的EPA和DHA的含量,结果显示,蜂酸和神经酸在FID检测器中响应相似,可以在定量鱼油胶囊时作内标使用。Cristian Tudor Matea等[32]通过GC-FID法测定了罗马尼亚6个谷物样品中脂肪酸的含量,其中包括C20∶0、C20∶1等超长链脂肪酸,该研究有助于评估人群营养摄入量。气相色谱分析超长链脂肪酸的常用方法见表1。
气相色谱与质谱联用技术(GC-MS)是将质谱(massspectrum,MS)作为气相色谱的检测器,结合了气相色谱的高效分离和质谱检测器的高灵敏度优势,可以检测出FID等检测器所检测不到的一些痕量物质,但设备成本会相应增加。Dongmei Yu等[33]在探究植物表皮蜡质中超长链脂肪酸的相关合成酶及基因时,通过GC-MS检测了日本裸稻叶片蜡质中的C20~C34的超长链脂肪酸的合成情况。Rezanka T等[34]用GC-MS法测定了南极采集的Calothrix sp.中的长达C34的超长链脂肪酸衍生物,并通过实验证明其样本中不饱和脂肪酸如C17∶1存在量很低时,只有在用猪胰腺磷脂酶A2水解后用GC-MS才能被成功鉴定出来。S J Hardy等[35]在探究超长链脂肪酸对人体细胞中的Ca2+和超氧化物的产生之间的关系时,运用了GC-MS法来定量超长链脂肪酸,发现C30∶4脂肪酸能够使胞内的Ca2+释放出来。
3.2 高效液相色谱法及高效液相色谱质谱联用技术
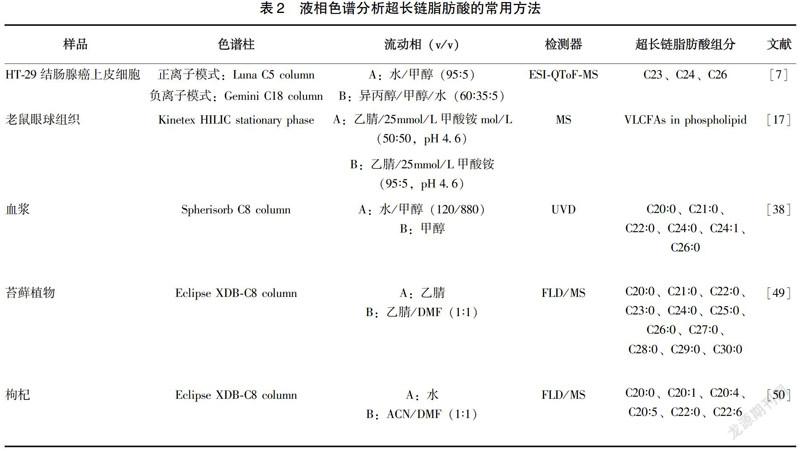
与GC相比,液相色谱没有健全的谱库,后续分析较为复杂,但其有以下优点[36]:(1)可以检测一些不耐高温的化合物,许多碳链较长的不饱和脂肪酸在高温下可能发生结构变化、异构化甚至分解;(2)能够更方便地收集分离后的样品组分以作进一步分析;(3)气相色谱分析经常需要用到衍生化的步骤,相比之下,液相色谱法的样品前处理过程更加便捷等。液相色谱常用的检测器有紫外吸收检测器(UVD)、荧光检测器(FLD)、二极管阵列检测器(PDAD)、MS等。熊辉等[37]以C17∶0作为内标,改良了Doles法萃取血清中游离脂肪酸,用HPLC法对92名健康体检者空腹外周血中游离脂肪酸进行了定量分析,其中包括对C20∶4、C20∶5等超长链脂肪酸的测定。Nlcholas A.Hall等[38]通过HPLC法鉴定出正常血浆、肾上腺脑蛋白营养不良者血浆以及婴儿患该病者血浆中的C20~C26的超长链脂肪酸,并将C24/C22以及C26/C22的比值与GC-MS的检测结果进行了比较,验证了HPLC方法检测结果的准确性。液相色谱分析超长链脂肪酸的常用方法见表2。
高效液相色谱与质谱联用技术(HPLC-MS)将液相色谱的分离优势与质谱的结构鉴定优势相结合,能够有效降低复杂组分样品的基质效应,这将大大提高物质分析的效率及精确度。Liubin等[39]在探究Rubus niveus Thunb.油时通过HPLC-MS法测定了C22∶0及C20∶4的含量。Ding Yang-Jun等[40]运用HPLC-APCI-MS法测定了深海鱼油中的C20∶1、C20∶5、C22∶6等超长链不饱和脂肪酸的含量。
4 超长链脂肪酸的应用
超长链脂肪酸在工业、医学、食品等领域有着广泛的应用前景。在工业领域,花生酸(C20∶0)常用于加工制造洗涤剂、肥皂等日用品,并可作为润滑剂、润滑油添加剂用于零件中,还可用作照相材料。山嵛酸(C22∶0)主要用于生产各种山嵛酸衍生物,其衍生物如醇、酯、酰胺等可广泛用于纺织、石油、化妆品等行业。芥酸(C22∶1)多用于生产芥酸酰胺用于制造各种塑料、抗粘剂、抗静电剂及润滑剂等。其他超长链脂肪酸如木蜡酸(C24∶0)、蜡酸(C26∶0)、虫漆蜡酸(C32∶0)等也广泛用于特殊的有机合成等研究领域。
研究者发现,超长链脂肪酸与代谢类疾病有着极大的相关性[41-45]。Rie Matsumori等[42]认为,红细胞中的C24∶0水平与代谢症候群(MS)患者的特异性动脉粥样硬化的脂蛋白谱及炎症状态有关,MS组红细胞的C24∶0水平显著高于非MS组。Vijitha K.Senanayake等[43]也发现,炎症和线粒体应急与MS的病因有着某种相关性。Hugo W.Moser等[44]发现,VLCFAs除了会在肾上腺脑白质营养不良(ALD)患者的肾上腺皮质及脑白质等组织中积累,其在血浆中的代谢水平也会有明显地增加。除此之外,Ruling Shi等[45]还发现,阿尔茨海默症(AD)患者脑中的VLCFAs水平也有增加,这意味着过氧化物酶氧化功能障碍可能与AD的发病有关。这些研究都表明了VLCFAs在未来医疗上有极大潜力作为有效的生物标志代谢物来检测相关疾病,利用超长链脂肪酸分子水平上的调节来治疗或者辅助治疗代谢类的疾病极具前景。
在婴幼儿配方食品中,人们发现DHA与ARA的添加比例对于营养效果至关重要,《食品安全国家标准婴幼儿配方食品》[46]明确指出,添加DHA时至少要添加同等量的ARA,并且EPA的量不应超过DHA。除此之外,在油类产品中,超长链脂肪酸或饱和脂肪酸的比例会对油品的凝固点产生影响,过多的超长链脂肪酸会使油品更容易产生冬化现象。高油酸花生油与普通花生油的脂肪酸成分分析表明[47],高油酸品种花生油中的油酸含量在76%~81%之間,普通品种花生油中的油酸含量在39%~47%之间,但高油酸花生油中的花生酸、鳕油酸、山嵛酸、木蜡酸这些超长链脂肪酸的总含量仍然有7%左右,因此在低温下依然容易产生冬化现象。所以,高油酸花生油中的超长链脂肪酸已经成为备受关注的研究重点。
5 结论
研究者们已经对超长链脂肪酸的合成代谢路径有了初步的了解[48],进一步挖掘超长链脂肪酸的生物学功能能够为植物的育种及品质改良提供参考,拓展人们对生物体的认识,并为其在食品、药品领域的运用提供科学依据。寻找有效的超长链脂肪酸作为生物标志物能使未来的疾病诊断及身体状况检查变得更加精确、便捷。此外,发明更先进的提取手段,寻找更有效的分离、提纯方法能够提高对天然脂肪酸的利用率。优化超长链脂肪酸的定量检测技术,开发更先进、灵敏、便捷的分析方法,是其今后研究与应用的可靠保障。
参考文献
[1]Cassagne C,Lessire R,Bessoule J J,et al.Biosynthesis of very long chain fatty acids in higher plants[J].Progress in Lipid Research,1994,33(1-2):55.
[2]Tanetani Y,Fujioka T,Kaku K,et al.Studies on the inhibition of plant very-long-chain fatty acid elongase by a novel herbicide,pyroxasulfone[J].Journal of Pesticide Science,2011,36(2):221-228.
[3]倪郁,郭彦军.植物超长链脂肪酸及角质层蜡质生物合成相关酶基因研究现状[J].遗传,2008,30(5):561-567.
[4]Paz R A,Lagüe P,Lamoureux G,et al.Effect of saturated very long-chain fatty acids on the organization of lipid membranes:a study combining(2)H NMR spectroscopy and molecular dynamics simulations[J].Journal of Physical Chemistry B,2016,120(28):6951-6960.
[5]Jakobsson A,Westerberg R,Jacobsson A.Fatty acid elongases in mammals:their regulation and roles in metabolism[J].Progress in Lipid Research,2006,45(3):237-249.
[6]Savary S,Trompier D,Andréoletti P,et al.Fatty acids-induced lipotoxicity and inflammation[J].Current Drug Metabolism,2012,13(10):1358-1370.
[7]Parisi L R,Li N,Atilla-Gokcumen G E.Very long chain fatty acids are functionally involved in necroptosis[J].Cell Chem Biol,2017,24(12):1445-1454.
[8]Jetter R,Riederer M.Localization of the transpiration barrier in the epi-and intracuticular waxes of eight plant species:water transport resistances are associated with fatty acyl rather than alicyclic components[J].Plant Physiology,2016,170(2):921.
[9]Mao B,Cheng Z,Lei C,et al.Wax crystal-sparse leaf2,a rice homologue of WAX2/GL1,is involved in synthesis of leaf cuticular wax[J].Planta,2012,235(1):39-52.
[10]胡曉君,张正斌,刘文,等.植物表皮蜡质及极长链脂肪酸类物质的研究进展[J].安徽农业科学,2013(12):5176-5178.
[11]Nobusawa T,Okushima Y,Nagata N,et al.Synthesis of very-long-chain fatty acids in the epidermis controls plant organ growth by restricting cell proliferation[J].Plos Biology,2013,11(4):e1001531.
[12]Qin Y M,Hu C Y,Pang Y,et al.Saturated very-long-chain fatty acids promote cotton fiber and arabidopsis cell elongation by activating ethylene biosynthesis[J].Plant Cell,2007,19(11):3692.
[13]徐宗余.2-氯-N-(3-甲氧基-2-噻吩甲基)-2,6-二甲基乙酰替苯胺及其类似物对超长链脂肪酸生物合成的抑制作用[J].世界农药,2002,24(5):7-10.
[14]Suh M,et al.Dietary 20:4n-6 and 22:6n-3 modulates the profile of long-and very-long-chain fatty acids,rhodopsin content,and kinetics in developing photoreceptor cells[J].Pediatric Research,2000,48(4):524-530.
[15]Li W,Sandhoff R,Kono M,et al.Depletion of ceramides with very long chain fatty acids causes defective skin permeability barrier function,and neonatal lethality in ELOVL4 deficient mice[J].International Journal of Biological Sciences,2007,3(2):120-128.
[16]Thimgan M S,et al.Identification of genes associated with resilience/vulnerability to sleep deprivation and starvation in drosophila[J].Sleep,2014,38(5):801.
[17]Wong B H,et al.Mfsd2a is a transporter for the essential ω-3 fatty acid docosahexaenoic acid(DHA)in eye and is important for photoreceptor cell development[J].Journal of Biological Chemistry,2016,291(20):10501-10514.
[18]Suh M,et al.Relationship between dietary supply of long-chain fatty acids and membrane composition of long-and very long chain essential fatty acids in developing rat photoreceptors[J].Lipids,1996,31(1):61-64.
[19]Hargrove J L,Greenspan P,Hartle D K.Nutritional significance and metabolism of very long chain fatty alcohols and acids from dietary waxes[J].Experimental Biology & Medicine,2004,229(3):215-226.
[20]王性炎,馬新世,李全新,等.用元宝枫油提取神经酸的工艺方法[P].CN:1609090,2005.
[21]叶在荣,单友谅,朱文适.薄层色谱法分离植物种子中主要不饱和脂肪酸的研究[J].植物生理学报,1983(6):57-60.
[22]候镜德,袁晓悟,胡伟.金属盐沉淀法分离神经酸[J].生物技术,1996,6(1):39-41.
[23]Vargas-Lopez J M,et al. Processing of crambe for oil and isolation of erucic acid[J].Journal of the American Oil Chemists Society,1999,76(7):801-809.
[24]王建民.神经酸的提取、纯化生产工艺[P].CN:02136802.3,20020904.
[25]刘伟民,马海乐,李国文.超临界CO2连续浓缩鱼油EPA和DHA的研究[J].农业工程学报,2003,19(2):167-170.
[26]闵征桥,高盼,何东平,等.尿素包合法富集鱼油中EPA和DHA的工艺研究[J].粮油食品科技,2013,21(6):25-29.
[27]敬思群,陈婧萱.尿素包合法富集马齿苋全草油多不饱和脂肪酸及脂肪酸分析[J].粮食与油脂,2015(2):33-36.
[28]方旭波,龚戬芳,蒋雅美,等.分子蒸馏和尿包结合法富集乙酯化EPA/DHA[J].中国食品学报,2013,13(4):101-106.
[29]周琴芬.蒜头果种仁神经酸制备工艺研究[D].杭州:浙江大学,2017.
[30]Jabeur H,et al.Detection of Chemlali extra-virgin olive oil adulteration mixed with soybean oil,corn oil,and sunflower oil by using GC and HPLC[J].Journal of Agricultural & Food Chemistry,2014,62(21):4893-4904.
[31]Shantha N C,Ackman R G.Nervonic acid versus,tricosanoic acid as internal standards in quantitative gas chromatographic analyses of fish oil longer-chain n-3 polyunsaturated fatty acid methyl esters[J].Journal of Chromatography B Biomedical Sciences & Applications,1990,533(2):1-10.
[32]Matea C T,Bele C.Quantification of tocopherol and fatty acid content in selected Romanian cereal using HPLC-FL and GC-FID[J].Bulletin of University of Agricultural Sciences and Veterinary Medicine Cluj-Napoca.Agriculture,2008,65(2):268-272.
[33]Yu D,Ranathunge K,Huang H,et al.Wax Crystal-Sparse Leaf1 encodes a beta-ketoacyl CoA synthase involved in biosynthesis of cuticular waxes on rice leaf[J].Planta,2008,228(4):675-685.
[34]Rezanka T,Nedbalová L,Elster J,et al.Very-long-chain iso and anteiso branched fatty acids in N-acylphosphatidylethanolamines from a natural cyanobacterial mat of Calothrix sp[J].Phytochemistry,2009,70(5):655-663.
[35]Hardy S J,Robinson B S,Ferrante A,et al.Polyenoic very-long-chain fatty acids mobilize intracellular calcium from a thapsigargin-insensitive pool in human neutrophils.The relationship between Ca2+mobilization and superoxide production induced by long-and very-long-chain fatty acids[J].Biochemical Journal,1995,311(2):689.
[36]Carvalho M S,Mendonca M A,Pinho D M M,et al. Chromatographic analyses of fatty acid methyl esters by HPLC-UV and GC-FID[J].Journal of the Brazilian Chemical Society,2012,23(4):763-769.
[37]熊辉,陈薇,刘松梅,等.高效液相色谱与酶法检测血清游离脂肪酸的对比分析[J].武汉大学学报(医学版),2015,36(2):278-280.
[38]Hall N A,Lynes G W,Hjelm N M.Ratios for very-long-chain fatty acids in plasma of subjects with peroxisomal disorders,as determined by HPLC and validated by gas chromatography-mass spectrometry[J].Clinical Chemistry,1988,34(6):1041-1045.
[39]Liubin,Caidan R,Cairang L,et al.Simultaneous analysis of fatty acids in rubus niveus Thunb.Fruits by HPLC-MS/MS[J].Asian Journal of Chemistry,2013,25(4):1866-1870.
[40]Ding Y J,Zhao X E,Zhu F,et al.Identification of long-chain unsaturated fatty acids in deep-sea fish oil by liquid chromatography/mass spectrometry/atmospheric pressure chemical ionization[J].Chinese Journal of Analytical Chemistry,2007,35(3):375-381.
[41]Galea E,et al.Oxidative stress underlying axonal degeneration in adrenoleukodystrophy:a paradigm for multifactorial neurodegenerative diseases?[J].Biochimica Et Biophysica Acta,2012,1822(9):1475-1488.
[42]Matsumori R,Miyazaki T,Shimada K,et al.High levels of very long-chain saturated fatty acid in erythrocytes correlates with atherogenic lipoprotein profiles in subjects with metabolic syndrome[J].Diabetes Research & Clinical Practice,2013,99(1):12.
[43]Senanayake V K,Wei J,Mochizuki A,et al.Metabolic dysfunctions in multiple sclerosis:implications as to causation,early detection,and treatment,a case control study[J].Bmc Neurology,2015,15(1):154.
[44]Moser H W,Moser A B,Frayer K K,et al. Adrenoleukodystrophy:increased plasma content of saturated very long chain fatty acids[J].Neurology,1981,31:1241-1249.
[45]Shi R,Zhang Y,Shi Y,et al.Inhibition of peroxisomal β-oxidation by thioridazine increases the amount of VLCFAs and Aβ generation in the rat brain[J].Neuroscience Letters,2012,528(1):6-10.
[46]GB 10765—2010.食品安全國家标准婴幼儿配方食品[S].
[47]Dong X Y,Zhong J,Wei F,et al.Triacylglycerol composition profiling and comparison of high-oleic and normal peanut oils[J].Journal of the American Oil Chemists Society,2015,92(2):233-242.
[48]Cassagne C,Lessire R,Bessoule J J,et al.Biosynthesis of very long chain fatty acids in higher plants[J].Progress in Lipid Research,1994,33(1-2):55-69.
[49]You J,Zhao X,Suo Y,et al.Determination of long-chain fatty acids in bryophyte plants extracts by HPLC with fluorescence detection and identification with MS[J].Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2007,848(2):283-291.
[50]Li G,You J,Suo Y,et al.A developed pre-column derivatization method for the determination of free fatty acids in edible oils by reversed-phase HPLC with fluorescence detection and its application to Lycium barbarum seed oil[J].Food Chemistry,2012,125(4):1365-1372.
(责任编辑 李婷婷)
