降脂理肝汤对非酒精性脂肪肝大鼠肠黏膜屏障的影响
2019-09-10尹抗抗王柏果徐琦程婉红邓天好谭达全唐标
尹抗抗 王柏果 徐琦 程婉红 邓天好 谭达全 唐标

〔摘要〕 目的 觀察降脂理肝汤对非酒精性脂肪肝大鼠肠黏膜屏障的影响,探讨降脂理肝汤干预非酒精性脂肪肝的机制。方法 40只SD雄性大鼠随机分为正常组(10只)和造模组(30只),采用高脂饮食喂养复制非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)大鼠模型,造模组大鼠再随机分为高脂饮食模型组、降脂理肝汤低剂量及高剂量组(4.6、9.2 g/kg),分别予以相应干预6周后取小肠和门静脉血液,检测肠黏膜结构、紧密连接蛋白(Occludin)和ZO-1蛋白水平以及血浆内毒素水平。结果 与正常组比较,高脂饮食大鼠小肠绒毛稀疏且排列不整齐、小肠绒毛高度明显降低(P<0.01),Occludin和ZO-1蛋白表达水平显著降低(P<0.05),血浆内毒素水平显著上升(P<0.01)。与高脂饮食模型组比较,高剂量降脂理肝汤组小肠绒毛排列较整齐,断裂较少,绒毛高度显著升高(P<0.01),Occludin和ZO-1蛋白水平显著上升(P<0.05),血浆内毒素水平明显降低(P<0.01);而低剂量降脂理肝汤组仅显著降低了血浆内毒素水平(P<0.01)。结论 降脂理肝汤干预非酒精性脂肪肝的机制可能与其改善小肠绒毛结构,恢复Occludin和ZO-1蛋白水平从而减轻肠黏膜屏障损伤,降低血浆中的内毒素水平有关。
〔关键词〕 降脂理肝汤;非酒精性脂肪肝病;肠黏膜屏障;Occludin蛋白;ZO-1蛋白;内毒素
〔中图分类号〕R285.5;R575.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.09.008
Effects of Jiangzhi Ligan Decoction on Intestinal Mucosal Barrier in Rats with
Non-alcoholic Fatty Liver Disease
YIN Kangkang, WANG Baiguo, XU Qi, CHENG Wanhong, DENG Tianhao, TAN Daquan, TANG Biao*
(Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To explore the effects of Jiangzhi Ligan Decoction (JZLGT) on intestinal mucosal barrier in rats with non-alcoholic fatty liver disease (NAFLD), and to explore the intervention mechanism of JZLGT in NAFLD. Methods Forty male Sprague-Dawley (SD) rats were divided into a normal diet (ND) group (10 rats) and a model group (30 rats). NAFLD rat model was successfully replicated by high-fat diet (HFD) feeding. Then the 30 rats in the model group were randomly divided into a HFD model group, a JZLGT-Low group and a JZLGT-High group (treated with 4.6 and 9.2 g/kg, respectively). After 6 weeks of corresponding intervention, blood of intestine and portal vein was collected. The structure of intestinal mucosa, levels of Occludin, ZO-1 and plasma endotoxin were determined. Results Compared with the ND group, the villi of the small intestine in the HFD rats were sparse and irregularly ranged, with the length of the small intestinal villi dramatically decreased (P<0.01); the expression levels of Occludin and ZO-1 were significantly decreased (P<0.05), and the plasma endotoxin level was notably increased (P<0.01). Compared with the HFD model group, the villi of the small intestine in the JZLGT-High group were neatly ranged and less fractured, with the length of villi obviously increased (P<0.01); the levels of Occludin and ZO-1 were remarkably increased (P<0.05), and the plasma endotoxin level was significantly decreased (P<0.01). However, only the plasma endotoxin level was decreased significantly in rats of the JZLGT-Low group (P<0.01). Conclusion The intervention mechanism of JZLGT on NAFLD may be related to the structural improvement of small intestinal villi and the restored expression levels of Occludin and ZO-1 proteins, which can relieve the injury of intestinal mucosal barrier and decrease the level of plasma endotoxin.
〔Keywords〕 Jiangzhi Ligan Decoction; non-alcoholic fatty liver disease; intestinal mucosal barrier; Occludin protein; ZO-1 protein; endotoxin
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)是一种无过量饮酒史,以肝细胞脂肪变性和脂质沉积为主要特征的代谢综合征。目前普遍认为NAFLD是遗传-环境-代谢相关性疾病,其发病机制主要与胰岛素抵抗、氧化应激、脂质过氧化、细胞因子、内毒素血症和炎症反应等多种因素有关,并且部分NAFLD会进展为肝纤维化和肝硬化[1]。此外,也有研究提出“肠-肝轴”学说介导了NAFLD发生和发展过程,肠黏膜屏障功能受损导致肠道细菌移位和内毒素进入门静脉系统,加重肝脏炎症反应及肝脏损伤。近年来,“肠-肝轴”学说受到越来越多的关注,肠黏膜屏障在NAFLD发病机制中的作用成为NAFLD干预的重要问题[2]。
肠黏膜屏障由机械屏障、化学屏障、免疫屏障与生物屏障组成[2-3],其中机械屏障最为重要,机械屏障的结构基础主要包括完整的肠黏膜上皮细胞以及上皮细胞间的紧密连接。紧密连接由多种紧密连接蛋白构成,其中最为重要的两种连接蛋白为Occludin和闭合小环蛋白ZO-1,这些紧密连接蛋白的异常会导致紧密连接受损[4-5]。降脂理肝湯由泽泻、决明子、丹参、郁金、海藻、荷叶等6味中药组成。前期临床研究表明,降脂理肝汤具有调脂、护肝、减肥作用,治疗NAFLD疗效确切[6-8],我们前期研究揭示降脂理肝汤可通过调控肠道菌群的结构,抑制NAFLD大鼠肠道细菌的过度生长,干预NAFLD[9]。而肠道菌群对肠黏膜屏障的维持具有重要作用[10],本实验旨在进一步观察降脂理肝汤对NAFLD大鼠肠黏膜屏障的影响,探讨降脂理肝汤干预NAFLD的机制。
1 实验材料
1.1 动物
健康SPF级SD雄性大鼠40只,体质量(150±10)g,由湖南斯莱克景达实验动物有限公司提供,生产许可证号SYXK(湘)2011-0003。
1.2 药物及主要试剂
降脂理肝汤:泽泻10 g,决明子30 g,丹参10 g,郁金10 g,海藻30 g,荷叶10 g。参照前期研究制备药物和给药[7],中药饮片均购自湖南中医药大学第一附属医院药房,由制剂室煎制成含生药为0.92 g/mL和0.46 g/mL的浓缩液。兔抗大鼠Occludin多克隆抗体(货号:SAB4200593)、兔抗大鼠ZO-1多克隆抗体(货号:HPA001636)均由Sigma公司提供,山羊抗兔二抗(货号:AP132P ,Merck Millipore公司),DAB显色试剂盒(货号:AR1021博士德公司),内毒素检测试剂盒(货号:H178南京建成生物工程研究所)。
1.3 主要仪器
LEICADNLB2型双目显微镜,德国LEICA公司;Shandon325石蜡切片机,英国Shandon公司。
2 方法
2.1 动物分组及干预
将SD大鼠随机分为正常 (normal chow diet,ND)组(10只)和造模组(30只)。造模组采用高脂饮食喂养复制NAFLD大鼠模型,再随机分为高脂饮食模型(high-fat diet,HFD)组,降脂理肝汤低剂量(4.6 g/kg,JZLGT-Low)组,降脂理肝汤高剂量(9.2 g/kg,JZLGT-High) 组,每组10只。参照前期研究构建模型和进行药物干预[7]。ND组用普通饲料喂养,HFD组和降脂理肝汤实验组用高脂饲料喂养,造模后,随机取正常组和模型组大鼠肝组织进行HE染色,检测模型复制是否成功。降脂理肝汤组在造模成功后(6周)采用灌胃给药干预6周,每天1次,ND组和HFD组每天灌胃给予等容量生理盐水,并且在后6周HFD组和降脂理肝组继续高脂饲料喂养。干预结束后,静脉麻醉取小肠组织和门静脉血液待检测。
2.2 小肠绒毛染色及高度和宽度的测量
在距盲口5 cm处取大鼠回肠组织,经4%多聚甲醛固定后石蜡包埋,切片机切片,每张厚度为4 μm,放入水育箱内展片,待切片充分展开后用载玻片来捞取组织,在烘干机上彻底烘干后进行HE染色。HE染色后于光镜下观察小肠绒毛病理学改变,并通过Image-Plus Pro软件测量和分析小肠绒毛高度和宽度。小肠绒毛高度测量从绒毛基部到顶部的长度,小肠绒毛宽度共测量3个部位,分别为小肠绒毛基部、中部和尖端,再求3个部位宽度平均值,评价小肠绒毛的宽度。
2.3 小肠免疫组织化学染色观察小肠紧密联结蛋白Occludin和闭锁小带蛋白ZO-1的表达
小肠石蜡切片经常规脱蜡水化,蛋白酶37 ℃消化10 min,PBS缓冲液冲洗后,兔抗大鼠Occludin抗体或兔抗大鼠ZO-1抗体于4 ℃孵育过夜,PBS缓冲液冲洗后,加入二抗于37 ℃孵育30 min,PBS冲洗。DAB显色,并控制显色时间,PBS代替一抗做空白对照。通过Image-Plus Pro软件测量阳性染色区域的平均光密度值,平均光密度值与蛋白水平成正相关。
2.4 血浆内毒素检测
操作按照内毒素检测试剂盒说明书进行,首先向预先包被了抗体的酶标孔中加入样本,再加入生物标记的识别抗原,于37 ℃孵育1 h,PBST洗涤3次,加入亲和素HRP,于37 ℃孵育1 h,在450 nm波长下测吸光度值,以标准孔吸光值及其对应浓度绘制出标准曲线,计算各组血浆中内毒素的浓度。
2.5 统计学分析方法
实验数据通过SPSS 23.00软件进行处理,计量数据采用“x±s”表示,组间比较采用单因素方差分析,每两组间比较用LSD检验,P<0.05表示差异有统计学意义,P<0.01表示差异有显著统计学意义。
3 结果
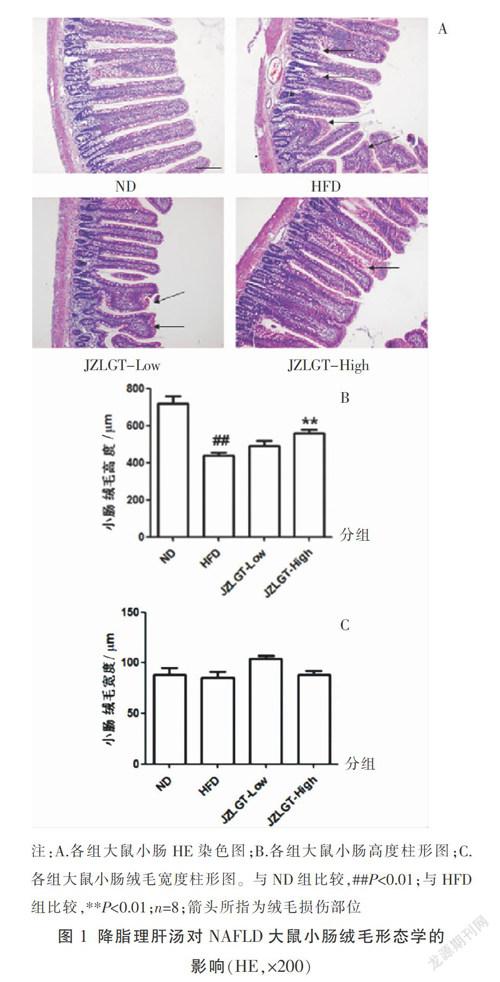
3.1 降脂理肝汤对NAFLD大鼠小肠绒毛形态的影响
HE染色结果显示,HFD组大鼠,小肠绒毛稀疏、排列不整齐、呈倒伏状并且部分缺失;JZLGT-Hight组,小肠绒毛排列整齐,断裂较少;JZLGF-Low组小肠绒毛形态介于两者之间。与ND组相比,HFD组大鼠小肠绒毛高度显著降低(P<0.01);与HFD组相比,JZLGF-Low组小肠绒毛高度差异无统计学意义 (P>0.05);与HFD组相比,JZLGT-Hight组小肠绒毛高度显著增加(P<0.01)。此外,各组间小肠绒毛宽度差异均无统计学意义(P>0.05)。见图1。
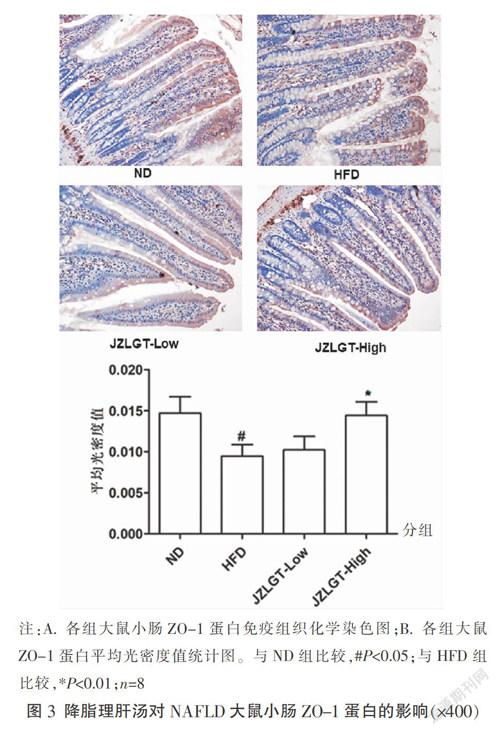
3.2 降脂理肝汤对NAFLD大鼠小肠紧密联结蛋白Occludin和ZO-1蛋白表达水平的影响
与ND组比较,HFD组大鼠小肠组织中连接蛋白Occludin和ZO-1蛋白水平均显著降低(P<0.05)。与HFD组比较,JZLGF-Low组小肠组织中Occludin和ZO-1蛋白水平差异无统计学意义(P>0.05);与HFD组比较,JZLGT-Hight组大鼠小肠组织中Occludin和ZO-1蛋白水平顯著升高(P<0.05),且ZO-1蛋白水平与ND组比较差异无统计学意义(P>0.05)。见图2和图3。
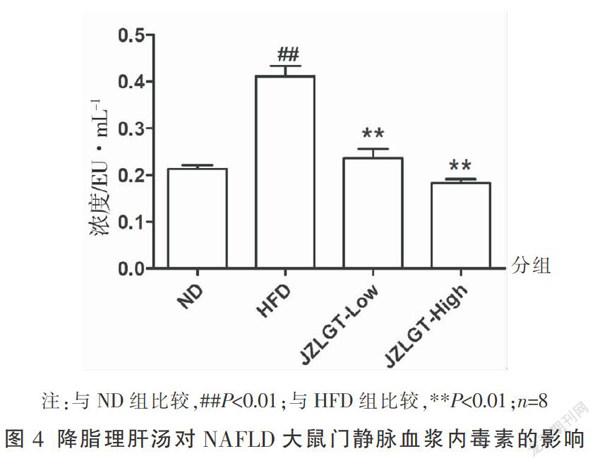
3.3 降脂理肝汤对肠源性内毒素的影响
与ND组比较,HFD组大鼠门静脉血浆中内毒素水平显著上升(P<0.01),低剂量和高剂量降脂理肝汤干预后,其血浆中内毒素水平均显著下降(P<0.01),且低剂量和高剂量降脂理肝汤组内毒素水平与ND组比较差异无统计学意义(P>0.05)。见图4。
4 讨论
研究表明,NAFLD发病伴随着肠黏膜屏障受损[11-12],大量研究揭示肝病患者常具有可见的肠黏膜屏障功能受损[13],改善肠黏膜屏障成为干预NAFLD的重要途径。前期我们的研究显示降脂理肝汤能调节NAFLD大鼠的肠道菌群,并降低肠道酶活性[9],而肠道菌群对肠黏膜屏障的维持具有重要作用[10]。因此,在本研究中从肠道屏障功能的调控探讨降脂理肝汤干预NAFLD的机制。
本研究结果显示,高脂饮食喂养后,大鼠小肠绒毛高度显著缩短,绒毛形态学上表现为稀疏、排列不整齐、呈倒伏状以及部分缺失;经高剂量降脂理肝汤干预后,大鼠小肠绒毛高度较高脂饮食模型组明显增加,小肠绒毛呈现排列较整齐、密集、断裂较少。小肠绒毛的高度和宽度决定小肠绒毛表面积,与小肠的消化吸收功能密切相关。因此,实验研究常通过测量小肠绒毛高度和宽度来评价断肠黏膜屏障损伤程度[13]。本研究结果提示高脂饮食能导致大鼠肠黏膜屏障受损,而降脂理肝汤的干预能减少肠黏膜屏障损伤。另外,本研究结果显示,各组大鼠小肠绒毛宽度均无明显改变,提示造模对小肠绒毛宽度的影响不大,这可能与高脂饲料喂养时间较短仅为12周有关。同样,也有研究报道,高脂持续喂养16周后,小肠绒毛宽度较12周要明显缩短[13]。
本研究结果显示,与正常组相比,高脂饮食模型组大鼠肠道连接蛋白Occludin和ZO-1蛋白水平明显降低,提示高脂饮食喂养诱导的肠黏膜屏障功能受损可能与Occludin和ZO-1蛋白有关,这一发现与之前的研究结果一致[14]。高剂量的降脂理肝汤干预能显著增加大鼠肠道Occludin和ZO-1蛋白水平。这提示降脂理肝汤可能通过调控肠道Occludin蛋白和ZO-1蛋白水平减少肠黏膜屏障损伤。
此外,我们前期的研究揭示,高脂饮食喂养可诱导大鼠肠道大肠杆菌数量增加[9],而大肠杆菌数量增加进而导致内毒素增加和蓄积。因此,本文检测发现在NAFLD大鼠门静脉血浆中内毒素水平显著上升,而经降脂理肝汤高剂量和低剂量干预后,血浆中内毒素水平均显著下降,这提示减少肠黏膜屏障损伤降低血浆中的内毒素水平可能是降脂理肝汤能显著改善NAFLD的重要原因。
综上所述,高脂饮食喂养诱导的NAFLD可能与高脂饮食导致的小肠绒毛结构以肠黏膜屏障受损有关。降脂理肝汤干预NAFLD的机制可能与修复NAFLD大鼠肠黏膜屏障,降低血浆中内毒素水平有关。本研究为降脂理肝汤的临床应用提供了进一步的实验依据。
参考文献
[1] KARIM M F, AL-MAHTAB M, RAHMAN S, et al. Non-alcoholic fatty liver disease (NAFLD)-A review[J]. Mymensingh Medical Journal, 2015, 24(4): 873-880.
[2] 戴 鑫,吕宗舜.肠道屏障功能在非酒精性脂肪性肝病发病机制中的作用[J].世界华人消化杂志,2012,20(8):656-661.
[3] BAUMGART D C., DIGNASS A U. Intestinal barrier function[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2002, 5(6): 685-694.
[4] VAN ITALLIE C M, FANNING A S, HOLMES J, et al. Occludin is required for cytokine-induced regulation of tight junction barriers[J]. Journal of Cell Science, 2010, 123(16): 2844-2852.
[5] FANNING A S, JAMESON B J, JESAITIS L A, et al. The tight junction protein ZO-1 establishes a link between the transmembrane protein occludin and the actin cytoskeleton[J]. The Journal of Biological Chemistry, 1998, 273(45): 29745-29753.
[6] 刘繁荣,郭新建,李君平.降脂理肝汤治疗非酒精性脂肪性肝炎34例[J].陕西中医,2015,36(1):8-9.
[7] 吴娅妮,周佩娟,陈 轶,等.降脂理肝汤治疗非酒精性脂肪肝临床疗效分析[J].辽宁中医药大学学报,2014,16(6):19-21.
[8] 王晓萍.降脂理肝湯对非酒精性脂肪性肝炎的治疗效果观察[J]. 中国继续医学教育,2015,7(30):177-178.
[9] 唐 标,肖新云,刘又嘉,等.降脂理肝汤对高脂饮食诱导的非酒精性脂肪肝大鼠肠道微生物及酶活性的影响[J].应用与环境生物学报,2016,22(3):442-445.
[10] FANG J, SUN X, XUE B, et al. Dahuang zexie decoction protects against high-Fat diet-Induced NAFLD by modulating gut microbiota-mediated toll-like receptor 4 signaling activation and loss of intestinal barrier[J]. Evidence-based Complementary and Alternative Medicine, 2017, 2017:2945803.
[11] MAO J W, TANG H Y, ZHAO T, et al. Intestinal mucosal barrier dysfunction participates in the progress of nonalcoholic fatty liver disease[J]. International Journal of Clinical and Experimental Pathology, 2015, 8(4): 3648-3658.
[12] GABELE E, DOSTERT K, HOFMANN C, et al. DSS induced colitis increases portal LPS levels and enhances hepatic inflammation and fibrogenesis in experimental NASH[J]. Journal of Hepatology, 2011, 55(6): 1391-1399.
[13] LIN P, LU J, WANG Y, et al. Naturally occurring stilbenoid TSG reverses non-alcoholic fatty liver diseases via gut-liver axis[J]. PloS One, 2015, 10(10): e0140346.
[14] 任卫英,沈继平,潘 刚,等.非酒精性脂肪肝大鼠小肠黏膜上皮屏障及紧密连接蛋白表达的变化[J].中华临床医师杂志(电子版), 2013,7(13):5975-5979.
