Mo部分替代Ti对V40Ti50Fe10合金储氢性能的影响
2019-09-10曹志杰马晓波
曹志杰,马晓波
(宁夏大学物理与电子电气工程学院,750021,银川)
钒基固溶体合金具有理论吸氢量(质量分数)高达3.8%、动力学性能好、吸放氢条件适中等优点,但存在平台压过低、室温下放氢量仅为理论值的一半、活化困难、成本较高等缺点,一定程度上影响了合金的应用[1-7]。例如,(FeV80)48Ti30Cr26合金的吸氢量达到了3.3%,但合金在室温下的放氢平台压低于0.15 MPa,氢化物在室温下的放氢量仅为2%[3]。因此,如何在提高合金平台压的同时保持较高的储氢量是研究高容量钒基固溶体合金的关键。
通过合金化的方法与其他金属形成多元合金能够有效地调节合金的平台压,从而显著地提高放氢量。在C14型Laves相Ti-Mn合金氢化物中,Nagasako等通过第一性原理计算发现,合金氢化物的焓变ΔH跟组成金属元素的晶胞体积V和体积模量B有关[8]。在温度和熵变ΔS一定的条件下,放氢平台压P和B/V之间的关系为lnP∝B/V,即体积模量增加,原子半径减小,金属氢化物的放氢平台压随之上升[9]。合金氢化物中P和B/V之间的线性关系在V基储氢合金中同样适用,按照这种线性关系调节合金元素的种类和添加量,能够有效地调节合金的晶胞体积和吸放氢反应焓变,从而在保持高储氢量的同时提高V基储氢合金的放氢平台压。因此,众多研究者利用体积模量较大、原子半径跟V接近的金属如Cr、Mo、W等来改善V基储氢合金的储氢性能。
在V1-xCrx(x=0.1~0.5)系列合金中,氢化物放氢平台压随Cr含量的增加逐渐上升,且x<0.2时合金的可逆储氢量保持在2%以上,其中V0.9Cr0.1合金在20 ℃下的放氢平台压达到了2.9 MPa,可逆吸氢量为2.33%[10]。V40Ti21.5Cr38.5合金在室温下的吸氢和放氢平台压分别为1.5、0.25 MPa,从10次到100次吸放氢循环其平台压基本保持不变,并且其可逆储氢量达到了2%[11]。V82Ti41Cr73Al0.08合金在20 ℃下的最大吸氢量高达3.75%,且此温度下的放氢平台压超过了0.2 MPa,可逆储氢量约为1.5%[12]。添加体积模量更大的Mo和W后,对V基储氢合金平台压的提升作用更加明显,尤其是添加原子分数为5%的金属Mo后,TiCrV合金在25 ℃下的放氢平台压提升了近6倍,从0.4 MPa上升至2.3 MPa,同时合金的有效储氢量基本保持不变,仍然维持在2.4%左右[13]。Asano等研究发现,V基储氢合金中添加Cr和Mo能够影响氢原子在晶胞中的占位,显著提高合金放氢压力平台,同时这些合金的储氢量能够保持和纯V合金相近[14-15],这对于进一步发展高容量V基储氢合金具有重要的意义。
上述研究表明,V基合金中的吸氢元素V和Ti含量较高时,储氢量往往较大。例如,Ti-40V-10Cr-10Mn体心立方(BCC)合金的吸氢量高达4.2%[16],Ti23-xHfxV40Mn37(x=2,4为Hf元素的原子分数百分点)系列合金的吸氢量超过了3.5%[17]。然而,纯金属钒十分昂贵的价格一定程度上影响了V基储氢合金的应用。为了降低V基储氢合金的成本,研究者尝试采用商业化成本较低的FeV80合金制备V-Ti基储氢合金[3,18-19]。在FeV80合金中,V和Fe的原子比接近4∶1。
为了后续能采用商业化的FeV80合金制备V基储氢合金,同时保证足够大的储氢量,合金中加入溶解度较大的Ti元素形成V40Ti50Fe10合金。本文采用纯金属制备V40Ti50Fe10合金,用Mo部分替代合金中的Ti,系统地研究了V40Ti50-xMoxFe10(Mo原子分数百分点x=0~30)合金的结构和储氢性能,并探讨了合金储氢容量的衰退机制,以期为后续工作采用FeV80合金制备成本较低的V基储氢合金奠定基础。
1 实验过程
1.1 合金的制备
原料为Ti锭、V锭、Mo锭和Fe锭,纯度(质量分数)均高于99.9%。合金通过电弧熔炼的方法制备,熔炼时为确保成分的均匀程度,合金翻身熔炼4~5次,同时熔炼过程在高纯氩气(体积分数为99.99%)的保护下进行,得到的铸态合金经过砂纸打磨和无水酒精清洗烘干后破碎成粉并过200目筛子,随后送入氩气气氛保护的手套箱(水和氧的体积分数均低于3×10-6)中。
1.2 合金的结构及性能表征
利用XRD对合金的相结构进行表征,衍射仪型号为Miniflex600,靶材为Cu靶Kα(λ=0.154 06 nm)。采用Highscore软件对XRD进行物相分析。利用扫描电子显微镜(Zeiss Supra 40)对样品的形貌和相分布进行分析,同时运用能谱(EDS)对样品进行成分分析。
采用美国AMC(Advanced Materials Corporation)自动气体反应装置测试材料的PCT曲线和吸放氢动力学曲线,样品质量为1 g左右,样品池温控精度为±1 ℃。测试前需要对合金进行活化处理,工艺如下:合金装入样品池中首先在室温下抽真空30 min以排净其中的气体,然后将样品池加热至400 ℃,并在该温度下抽真空30 min以清除合金表面的污染杂质,随后将样品池从加热器中取出迅速冷却到室温。该过程重复3次,以保证合金完全活化。利用热重(TG)分析法和质谱(MS)法分析合金氢化物的放氢过程,升温速率为5 ℃/min。
2 结果与讨论
2.1 V40Ti50-xMoxFe10合金的结构特征
图1为V40Ti50-xMoxFe10(x=0~30)合金的XRD图谱。由图可知,合金由BCC主相和少量的C14型Laves第2相组成。V40Ti50-xMoxFe10合金中Mo取代Ti并未改变合金的主相结构,但Laves第2相的含量明显降低,合金均匀性增加。随着Mo含量的增加,BCC相的衍射峰向高角度漂移,说明晶胞体积逐渐减小。
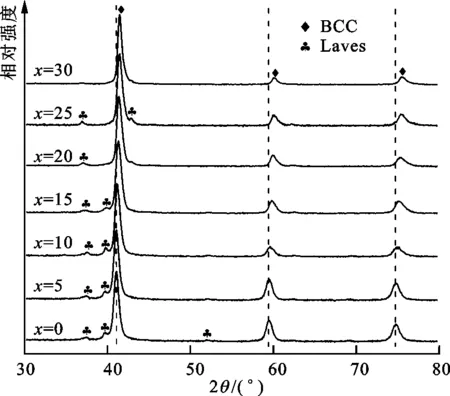
图1 V40Ti50-xMoxFe10(x=0~30)合金的XRD图谱
图2为V40Ti50-xMoxFe10(x=0~30)合金中BCC相晶格常数随Mo含量的变化图。由图可知,x由0上升至30时,晶格常数a由0.311 2 nm几乎呈线性降低至0.308 6 nm,晶胞体积由0.030 15 nm3减小为0.029 40 nm3,晶胞收缩率达到了2.55%。根据卫格定律,这是由于原子半径较小(0.139 nm)的Mo替代了半径更大(0.147 nm)的Ti造成的[20]。

图2 V40Ti50-xMoxFe10(x=0~30)合金中BCC相晶格常数随Mo含量的变化图

(a)x=0

(b)x=10

(c)x=20

(d)x=30图3 V40Ti50-xMoxFe10合金的SEM背散射照片
图3为V40Ti50-xMoxFe10(x=0~30)合金的SEM背散射照片。由图可见,所有合金均由两相组成,主相为BCC固溶体,沿主相晶界析出的为C14型Laves第2相,且随着Mo含量的上升,第2相含量逐渐减少,合金的均匀性增加,与XRD分析的结果吻合。当x≤10时,第2相在晶界处形成网状结构;当Mo含量进一步上升,晶界处第2相显著减少且逐渐趋于集中在一些特定的区域。Shen等的研究表明,在Ti25V35Cr40C0.5合金中,C14型Laves第2相会从BCC主相中析出并呈条状分布在基体相中[21],Zhou等则在退火处理后的BCC合金V35Ti20Cr45中发现了离散分布的C14型Laves第2相(Cr,V)2Ti[22]。这种相似的相组成情况同样出现在多种V基BCC固溶体合金中[23-25]。
对图3b中V40Ti40Mo10Fe10合金的主体相(见图中测试点①)和第2相(见图中测试点②)进行能谱分析,结果如表1所示。其中,合金中主体相的成分与设计的合金成分基本一致,而第2相为富钛相,Ti的原子分数高达95.62%。这是由于α-Ti相沿晶界析出并氧化形成富Ti杂相引起的[26]。Mouri等认为合金的表面性质会影响其活化时的孕育期,在活化初期阶段,合金中的第2相会先吸氢,导致其内部或者与BCC相的边界处出现缝隙,破坏氧化层,露出新鲜表面,从而加快合金活化速度[27]。Mo和V可以无限固溶,在V40Ti50-xMoxFe10(x=0~30)合金中随着Mo替代Ti含量的上升,Mo充分地固溶到BCC相中,合金的均匀性增加[28]。

表1 V40Ti40Mo10Fe10合金的能谱分析结果
2.2 V40Ti50-xMoxFe10(x=0~30)合金的储氢性能
图4为V40Ti50-xMoxFe10(x=0~30)合金在40 ℃下的PCT曲线。由图可见,合金的吸放氢性能随着Mo含量的上升发生了较大变化。在40 ℃下,V40Ti50-xMoxFe10合金的吸氢量呈先上升后下降的趋势。V40Ti50Fe10母合金的吸氢量为2.3%,x为5时吸氢量上升至2.72%,x超过5后吸氢量随着Mo含量的进一步上升而下降。由放氢PCT曲线可知,这一系列合金中只有V40Ti40Mo10Fe10合金的放氢压力平台较为平坦,放氢量相对较高,而其他合金的放氢PCT曲线倾斜度较大且放氢量较少。

图4 V40Ti50-xMoxFe10(x=0~30)合金在40 ℃时的PCT曲线
图5为V40Ti50-xMoxFe10(x=0~30)合金的放氢量和放氢平台压与Mo含量的关系。随着Mo含量的上升,合金的放氢量总体呈现下降趋势但中间出现上下波动状态,而放氢平台压则持续上升。V基BCC储氢合金吸氢时多数氢原子占据四面体间隙位置,对于同系列储氢合金,间隙越大,则储氢量越大[20]。

图5 V40Ti50-xMoxFe10(x=0~30)合金的放氢量和放氢平台压与Mo含量的关系
表2列出了V40Ti50-xMoxFe10合金(x=0~30)中BCC相的晶胞体积与吸放氢量和放氢平台压。晶胞中间隙的大小与本身的体积密切相关,原则上晶胞体积越大,BCC固溶体中氢的固溶度越高,合金储氢量越大。由表可见,V40Ti50-xMoxFe10(x=0~30)合金中晶胞体积随着Mo含量上升而下降,相应的储氢量降低。此外,Mo替代Ti导致BCC相中吸氢元素的含量减少,同样会导致合金的吸放氢量降低。另一方面,x≤5时,合金虽然具有较大的晶胞体积,但由于该温度下放氢平台压低于0.1 MPa,因而放氢量较低;x≥20时晶胞体积较小,吸氢量过低;x=10时合金的放氢量为1.05%,且放氢平台压达到了0.31 MPa。根据lnP∝B/V的关系可知,Mo替代Ti使得合金晶胞体积减小,体积模量增大,因而Mo含量的增加有助于提升合金的平台压。由图4可见,x=20时,合金的放氢过程并不完整。这是由于此时合金的吸氢平台压已经超过设备的测试极限,导致合金吸氢不完全造成的。相似的现象在V1-xFex(0.03≤x≤0.10)[29]、V1-xAlx(x=0.03,0.05,0.10)[30]和Zr1.04Fe2-xVx(x=0.1,0.2,0.3,0.5)[31]合金中同样存在。根据上述分析,V40Ti40Mo10Fe10合金具有相对宽泛且平坦的放氢压力平台,可逆储氢量较高,在这些合金中表现最好。

表2 V40Ti50-xMoxFe10(x=0~30)合金中BCC相的晶胞体积以及吸放氢量和放氢平台压
2.3 V40Ti40Mo10Fe10合金的吸放氢性能
图6a为V40Ti40Mo10Fe10在不同温度下的放氢PCT曲线,随着温度的升高,放氢PCT曲线向左偏移,说明放氢过程中合金氢化物中剩余的储氢量降低。图6b为合金的Van’t Hoff拟合曲线,根据拟合计算,合金氢化物的放氢ΔH和ΔS分别为37.8 kJ/mol和130.4 J/(mol·K)。
V40Ti40Mo10Fe10合金在PCT测试后进行了吸放氢动力学性能测试,其在不同温度下的吸氢曲线如图7a所示。由图可见,合金的吸氢过程非常迅速,且吸氢速率随着温度的升高而加快。合金在0 ℃下6 min即可完成吸氢过程,温度达到60 ℃时3 min便可以完成吸氢。由图7b可知,合金同样具有优异的放氢动力学性能,室温下放氢过程在5 min内完成。由图4中的吸放氢PCT曲线可知,V40Ti40Mo10Fe10合金吸氢量可以达到2.72%,但随后吸放氢循环过程中的有效储氢量仅为1.05%(见图7),说明在这些温度下合金氢化物中有超过半数的氢不能够释放出来。
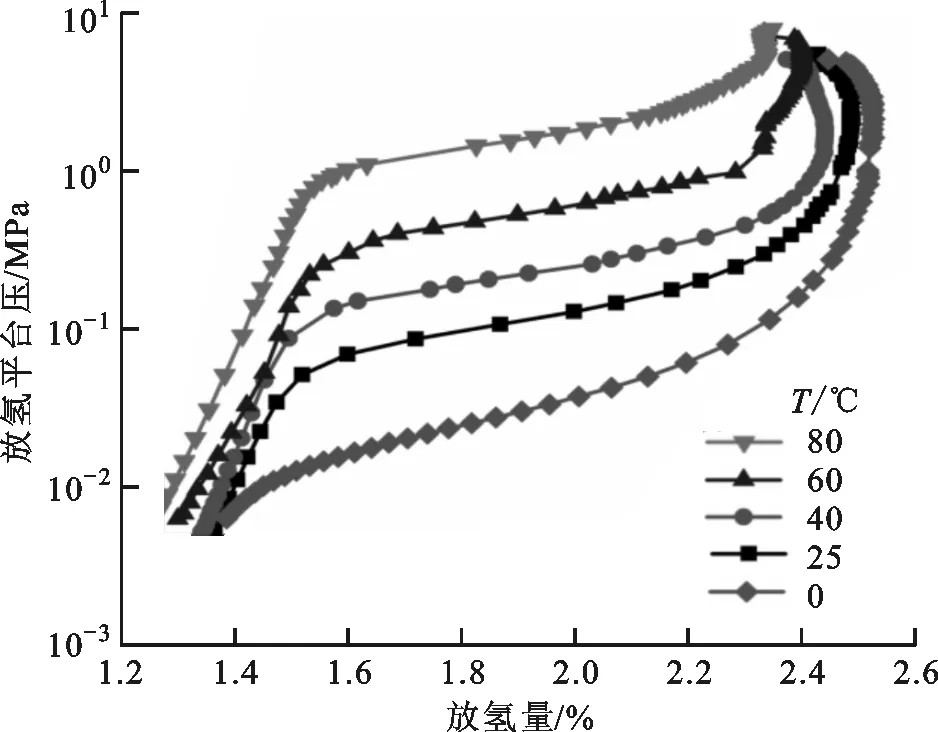
(a)放氢PCT曲线
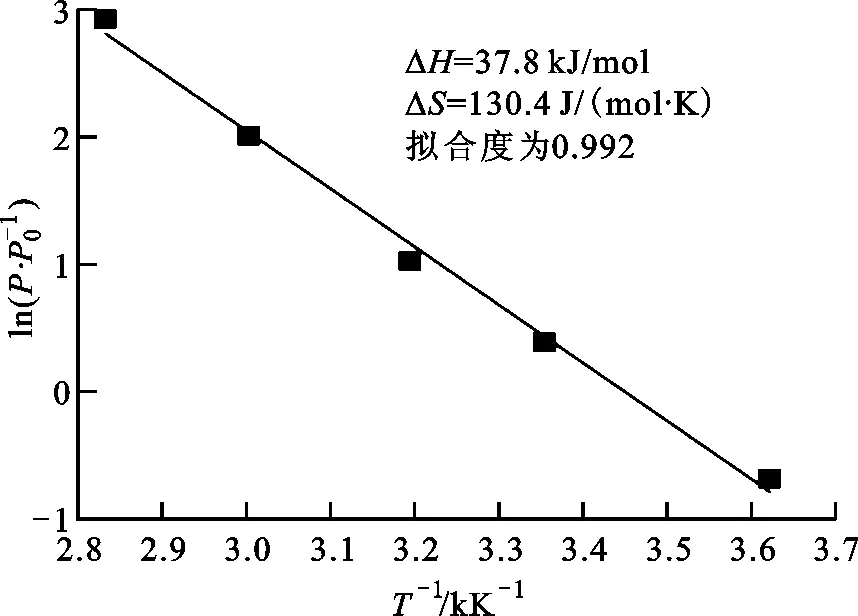
(b)Van’t Hoff拟合曲线图6 V40Ti40Mo10Fe10在不同温度下的放氢PCT曲线及Van’t Hoff拟合曲线
2.4 相转变及容量衰退机制
为了理解V40Ti40Mo10Fe10合金放氢容量低的原因,进一步对室温下放氢PCT测试后的样品进行MS和TG测试,结果如图8所示。由MS图可知,温度上升至200 ℃时,该合金氢化物开始释放氢,而主要放氢过程处于300~500 ℃的温度范围,放氢峰值温度为410 ℃。由TG曲线可见,从200 ℃开始合金氢化物的质量损失显著上升,温度达到420 ℃时总质量损失为1.1%,这一结果与放氢PCT曲线中有超过半数的氢不能够释放出来的结果吻合。

(a)吸氢动力学曲线
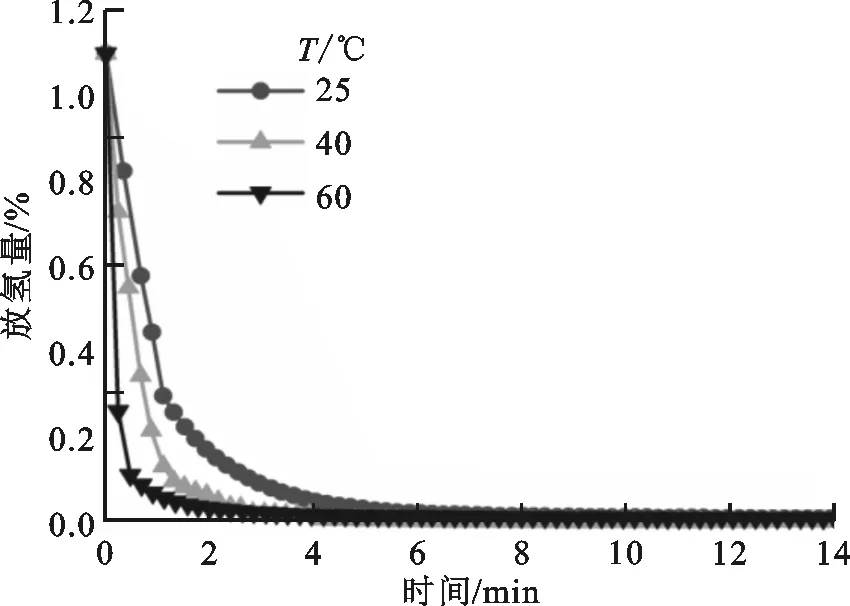
(b)放氢动力学曲线图7 V40Ti40Mo10Fe10合金在不同温度下的吸放氢动力学曲线

(a)MS曲线
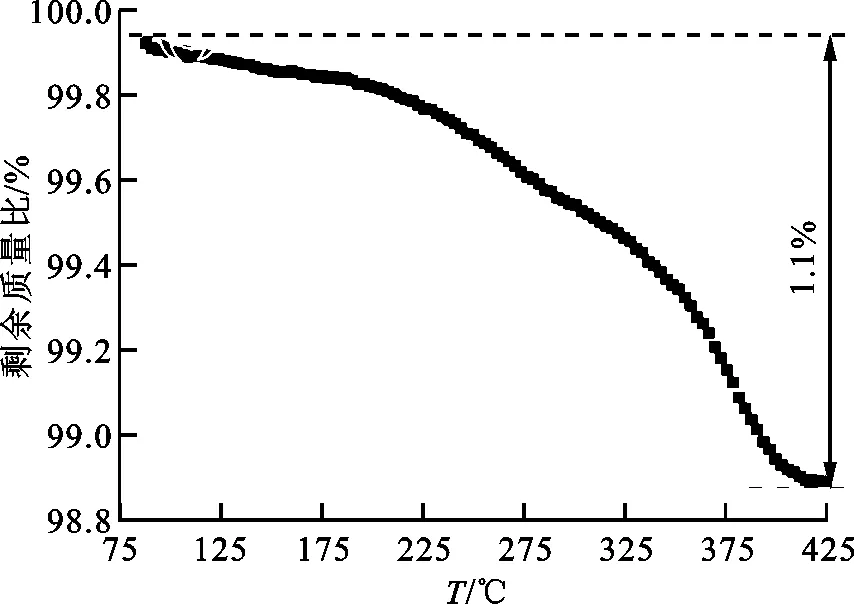
(b)TG曲线图8 V40Ti40Mo10Fe10合金放氢PCT测试后的MS和TG曲线
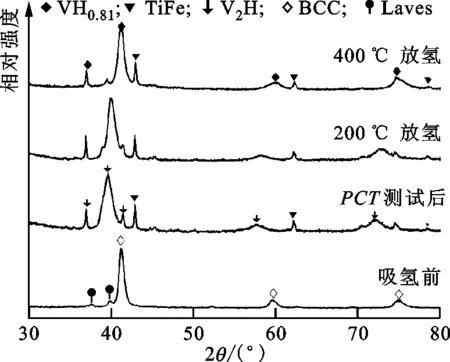
图9 V40Ti40Mo10Fe10合金在不同状态下的XRD图谱

图10 V40Ti40Mo10Fe10合金在40 ℃下不同吸放氢循环后的放氢XRD图谱
为了揭示V40Ti40Mo10Fe10合金的容量衰退机制,进一步对合金吸放氢过程中的相转变进行了XRD分析,结果如图9所示。由图可见,合金氢化物在40 ℃下进行放氢PCT测试后生成了V2H和大量的TiFe相。放氢温度上升至200 ℃后,V2H相的主峰向大角度方向漂移,这说明氢化物在此温度下进一步放氢。温度继续上升至400 ℃后,V2H持续放氢生成了体心四方(BCT)结构的VH0.81氢化物相。VH0.81相的放氢平台压为10-9MPa,远低于本实验仪器所能达到的最低压力极限,因而V40Ti40Mo10Fe10合金氢化物在该实验条件下不能实现完全放氢[32],这一结果与MS、TG的测试结果一致。同时值得注意的是,放氢过程中形成的TiFe相在重新吸氢过程中不能够回到基体合金中,说明放氢过程导致V40Ti40Mo10Fe10合金形成了相分离。图10为V40Ti40Mo10Fe10合金在40 ℃、4 MPa下不同吸放氢循环后的放氢XRD图。随着循环次数的增加,TiFe相的衍射峰明显增强,说明吸放氢循环过程中TiFe相的含量不断上升,导致合金相形成了相分离,降低了主体合金的稳定性。TiFe合金表面对杂质气体非常敏感,容易形成氧化层,因而TiFe相极难活化,需要400 ℃以上多次循环处理才能实现吸氢[33-36]。纯TiFe合金边抽真空边加热至400~450 ℃,高温下充入0.7 MPa的氢保温30 min,抽真空并冷却至室温后充入6.5 MPa的氢保温15 min,反复几次才能够活化[33],即使添加Mn形成了TiFe0.9Mn0.1,该合金仍然需要加热至400 ℃进行活化处理24 h[37]。在本实验条件(40 ℃、4 MPa氢压)下,TiFe相显然难以活化而成为非吸氢相,因而极大地降低了V40Ti40Mo10Fe10合金的储氢量。
3 结 论
在V40Ti50-xMoxFe10(x=0~30)合金中,Mo部分替代Ti并未改变合金的主相结构,该系列合金均由BCC固溶体主相和C14型Laves第2相组成。随着Mo含量的上升,BCC相的晶胞体积逐渐减小,合金的放氢平台压上升,放氢量总体呈现下降趋势,但中间出现上下波动状。其中,V40Ti40Mo10Fe10合金具有较优的综合储氢性能:40 ℃下的吸氢量达到2.72%,有效储氢量为1.05%,放氢平台压达到了0.31 MPa,且在室温下5 min内可完成吸放氢过程。循环测试表明,合金的储氢容量衰退是由于合金在吸放氢过程中Ti元素从主体合金中分离生成新的TiFe相、降低了合金的稳定性导致的。
