大豆肽-钙螯合物制备条件优化与质量评价
2019-09-10李国良侯俊财
李国良 侯俊财
(1.黑龙江八一农垦大学动物科技学院, 大庆 163319; 2.东北农业大学食品学院, 哈尔滨 150030; 3.东北农业大学乳品科学教育部重点实验室, 哈尔滨 150030)
0 引言
大豆及其新产品的开发越来越引起研究者的关注[1]。大豆蛋白作为一种优秀的膳食蛋白,被我国等亚洲国家视为最重要的可食用蛋白来源之一[2-3]。大豆蛋白中包含人体所需要的8种必需氨基酸,大豆蛋白消化率校正氨基酸评分为1.0[4]。大豆肽通过蛋白酶水解获得,与传统的大豆蛋白相比,大豆肽具有分子量小、容易消化吸收、无豆腥味等优点[5-6]。除了具有良好的理化特性外,大豆肽还可以提供人体所需要的营养物质,同时具有调节人体生理机能、预防骨质疏松、降低心血管疾病和高血压的风险等保健功效[7-9]。
钙元素是人体生长发育的重要元素之一,约占人体质量的1.5%~2%[10-11]。人体牙齿和骨骼中的钙约占钙总量的99%,其余1%的钙位于人体软组织内和血液中[12]。人类日常饮食中若缺乏钙,则会增加多种疾病的发生风险[13]。螯合是指配位体与金属离子的一种特殊类型的络合,螯合物是指一个或多个基团与一个金属离子的配位反应所形成的环状结构[14-15]。大豆肽-钙螯合物是由可溶性的钙离子与大豆肽按一定物质的量比以共价键结合而成,从结构的角度可以定义为:氨基酸的氨基端和羧基端与金属钙离子按一定的配比形成的环状结构产物[16]。
大豆脱脂豆粕是大豆提油后的副产物,其中的粗蛋白质量分数高达30%~50%,然而其利用率却较低,多用作动物饲料[17]。豆粕的酶水解能够有效改善其功能特性,并拓宽其应用领域。大豆肽-钙螯合物是将钙元素与大豆肽结合起来制成的新一代补钙营养性食品,可同时补充给人体所必需的钙元素和氮源,具有钙元素的利用率高、溶解性强和容易被人体吸收等优点[18]。文献[19]利用碱性蛋白酶进行大豆分离蛋白的酶解以及类蛋白反应修饰,并在醇-水介质中对其进行类蛋白反应修饰。文献[20]研究了酶解时间以及酸法脱酰胺改性对于脱植酸大豆分离蛋白肽钙离子螯合能力的影响,并对钙螯合物的结构特性和营养特性进行了分析。
本文以国产大豆脱脂豆粕为主要原料,研究肽钙比、反应温度、反应时间和pH值对钙结合量的影响,经过单因素和响应面优化试验,筛选大豆肽-钙螯合物最佳制备工艺,旨在为新型大豆营养保健产品及合成新型补钙制剂的研发提供新方法、新思路。
1 材料与方法
1.1 材料与试剂
大豆脱脂豆粕来自哈高科大豆食品有限责任公司;碱性蛋白酶来自诺维信(中国)生物技术有限公司;酒石酸钾钠、氢氧化钠、盐酸、硼酸、无水氯化钙、乙醇胺、邻甲酚酞、8-羟基喹啉、邻苯二甲醛、β-巯基乙醇、硫酸铜等均为国产分析纯。
1.2 仪器与设备
高效液相色谱仪,上海伍丰科学仪器有限公司;ALC-310.3型电子分析天平,北京赛多利斯仪器系统有限公司;DK-98-Ⅱ型电热恒温水浴锅,天津市泰斯特仪器有限公司;pHS-3C型精密pH计,塞多利斯科学仪器(北京)有限公司;LD4-2A型离心机,北京医用离心机厂;电动搅拌器,金坛市医疗仪器厂;DHG-9240型电热恒温鼓风干燥箱,上海一恒科技有限公司;电磁炉,广东容声电器股份有限公司;721型分光光度计,上海元析仪器有限公司;游标卡尺,上海量具刃具厂有限公司;S-3400N型扫描电子显微镜,日立扫描电镜公司。
1.3 加工工艺及要点
大豆钙肽产品的加工工艺为:大豆蛋白→大豆蛋白液→加入蛋白酶,酶解→灭酶→离心取上清液→冷冻干燥→取一定量加入氯化钙→螯合→冷冻干燥→大豆钙肽产品。其工艺要点如下:
(1)大豆蛋白液制备:取大豆蛋白溶于水中,制成蛋白溶液,可加热加速其溶解。加入1 mol/L的氢氧化钠将蛋白溶液pH值调节至7.0~8.0。
(2)酶解:向蛋白溶液中准确加入一定比例的碱性蛋白酶,将溶液调节至该蛋白酶最适条件(pH值8.0,最适温度50℃)进行水解,pH值保持恒定,偏差在±0.01范围内。
(3)灭酶:待反应结束后,溶液迅速升温至90℃,灭酶10 min。
(4)离心、冷冻干燥:灭酶后冷却至室温(20℃),pH值调到7.0,离心(4 000 r/min,20 min),收集上清液,即大豆肽溶液,冷冻干燥。
(5)螯合:50 g/L的肽溶液与0.04 mol/L氯化钙按一定肽钙比(肽溶液与氯化钙溶液质量比)进行混合,调节pH值,充分混合后,在一定温度下反应一段时间。
(6)成品:螯合后进行冷冻干燥,即得大豆肽-钙成品。
1.4 检测方法
钙结合量的测定采用邻甲酚酞比色法;溶解性的测定采用双缩脲法。
1.5 试验设计
1.5.1单因素试验
(1)肽钙比
选择1、2、3、4、5、6共6个肽钙比,固定pH值6.0,反应时间30 min,反应温度35℃的条件下,对钙结合量进行测定,以研究肽钙比对钙结合量的影响。
(2)反应温度
选择30、35、40、45、50℃共5个温度梯度,固定肽钙比为2,pH值7.0,反应时间为45 min的条件下,对钙结合量进行测定,以研究反应温度对钙结合量的影响。
(3)反应时间
选择25、30、35、40、45、50 min共6个时间梯度,固定肽钙比为2,pH值7.0,反应温度35℃的条件下,对钙结合量进行测定,以研究反应时间对钙结合量的影响。
(4)pH值
选择4.0、5.0、6.0、7.0、8.0共5个pH值,固定肽钙比为2,反应时间30 min,反应温度35℃的条件下,对钙结合量进行测定,以研究pH值对钙结合量的影响。
1.5.2大豆肽-钙合成工艺优化
在单因素试验的基础上,设计Box-Benhnken的中心组合试验,选取四因素三水平的响应面分析试验对大豆钙肽合成工艺进行优化。
1.6 大豆肽-钙螯合物的分子量分布测定
利用高效液相色谱法对大豆肽-钙螯合物的分子量分布情况进行表征[18]。采用乙腈-水-三氟乙酸(体积比45∶55∶0.1)作为流动相,用于溶解大豆肽-钙螯合物样品,控制最终质量浓度为5 mg/mL,通过滤膜过滤和超声后进样。试验参数设置:进样量为20 μL,流速为0.5 mL/min,柱温为30℃,检测器波长为214 nm,进样时间为35 min。
1.7 试验数据处理
所有数据采用Excel 2010进行处理,并通过SPSS 17.0对数据进行单因素方差分析。采用Design-Expert 7.0软件,根据Box-Benhnken中心组合原理进行响应面试验设计和回归分析。
2 试验结果与分析
大豆分离蛋白在经过碱性蛋白酶水解后,形成小分子量的大豆肽,这些大豆肽在一定条件下可与钙离子结合,形成肽-钙螯合物。但在螯合过程中有许多因素制约着螯合物中的钙结合量[21]。因此,需要进一步讨论螯合工艺的最佳条件,确定最优螯合条件,从而达到高含钙量的目的。
2.1 螯合条件对钙结合量的影响
2.1.1标准曲线的确定
邻甲酚酞与钙在pH值11.0±0.1的缓冲液中形成紫色络合物,利用可见分光光度计测定其吸光度,其最大吸收波长为570 nm。用掩蔽剂(8-羟基喹啉)消除其他二价阳离子的干扰。反复测定8次,得出标准曲线如图1所示。

图1 钙含量标准曲线Fig.1 Standard curve of calcium content
2.1.2肽钙比对钙结合量的影响
肽钙比是螯合工艺的重要参数,对钙结合量起着至关重要的作用。肽含量少,无法与钙完全结合;肽含量过多,与钙结合完仍有剩余,造成不必要的耗损[22]。在pH值6.0、反应时间30 min、反应温度35℃的条件下,考察不同肽钙比对钙结合量的影响,试验结果如图2所示。

图2 肽钙比对钙结合量的影响Fig.2 Effect of peptide calcium ratio on calcium-binding capacity
从图2可以看出,当肽钙比为2时,钙结合量达到最大值70.87 mg/g。继续增加肽钙比,钙结合量越来越低。呈现这种变化趋势主要是因为当肽钙比为1时,肽含量少,无法与钙完全结合;当肽钙比大于2时,与钙完全结合后,肽仍有剩余,导致每克中钙含量减少。因此,后续试验中选择肽钙比为2作为最适值。
2.1.3pH值对钙结合量的影响
pH值是钙结合量的重要影响因素之一。在大豆肽与钙螯合反应中,—COO—有至关重要的作用。Ca2+属于硬酸,易与氨基酸中的羧基发生配位作用,但与氮原子的配位作用较弱。在酸性条件下,大豆肽会发生解离生成—COO—,使得与Ca2+结合的—COO—增加,在pH值大于6.5时,由于质子化氨基的解离,可与Ca2+形成包括O、N配位原子的配合物,部分大豆肽与Ca2+通过吸附作用结合[23],从而使得钙结合量在pH值为7时达最大值。因在碱性条件下,OH—会与Ca2+反应产生Ca(OH)2,影响大豆肽与钙的螯合,因此,本试验不研究碱性条件下的螯合。
在肽钙比为2,反应时间30 min,反应温度35℃,分别在不同pH值的条件下进行螯合,然后测定钙结合量,试验结果如图3所示。通过此单因素试验可看出,在pH值为7.0时,钙结合量达到最大值,因此,在后续试验中选择pH 值7.0作为最佳参数。

图3 pH值对钙结合量的影响Fig.3 Effect of pH value on calcium-binding capacity
2.1.4反应时间对钙结合量的影响
在肽钙比为2,控制pH值7.0,反应温度35℃的条件下,分别反应25、30、35、40、45、50 min,然后测定钙结合量,考察反应时间对钙结合量的影响,结果如图4所示。
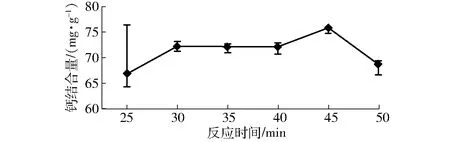
图4 反应时间对钙结合量的影响Fig.4 Effect of reaction time on calcium-binding capacity
由图4可知,螯合反应是需要一定反应时间的,30 min前反应较剧烈,30 min后变化趋于平稳,当反应时间为45 min时,钙结合量达到最大值,即75.89 mg/g。大豆肽与Ca2+通过吸附作用结合,随反应进行着动态的吸附和解析的过程,当45 min时整个过程达到动态平衡,因此,后续试验选择反应时间45 min为最佳参数。
2.1.5反应温度对钙结合量的影响
在肽钙比为2,pH值7.0,反应时间为45 min的条件下,选取反应温度为30、35、40、45、50℃进行试验,然后测定钙结合量,考察反应温度对钙结合量的影响,结果见图5。
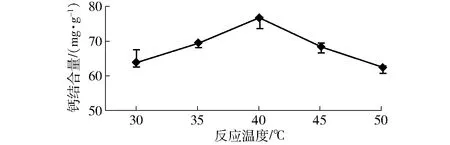
图5 反应温度对钙结合量的影响Fig.5 Effect of reaction temperature on calcium-binding capacity
从图5可看出,温度对钙结合量的影响也较明显,在反应温度为40℃时,钙结合量达到最大值,而高于40℃后钙结合量明显降低。由此可见,较高温度对大豆肽与钙结合是不利的。高温可能会使水分不断蒸发,部分氨基酸析出,螯合物分解或发生其它的反应;合适的温度有利于螯合向正方向发展,高于或低于这个温度都不利于螯合物生成[24]。因此,选择40℃为最佳反应温度进行后续试验。
2.1.6螯合工艺优化试验
根据单因素所得结果,以肽钙比、pH值、反应时间、反应温度为响应变量,以钙结合量Y为响应值,采用响应面法中的中心组合设计进行大豆钙肽螯合最佳配比优化,响应面因素编码见表1。
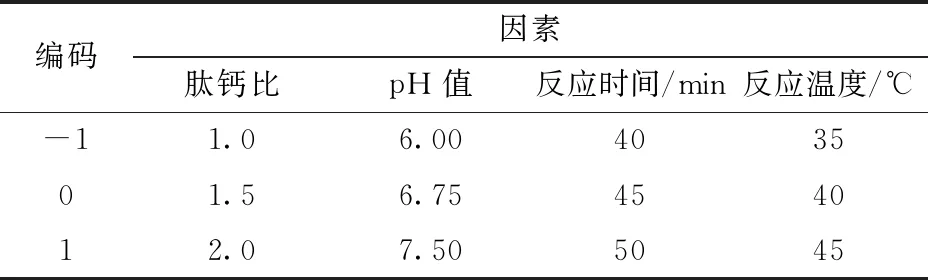
表1 响应面因素编码Tab.1 Factors and codes of response surface design
试验设计与结果见表2,表2中X1、X2、X3、X4分别表示肽钙比、pH值、反应时间、反应温度的编码值。采用Design-Expert软件对试验数据进行回归拟合分析,得到4个因素与响应值的模型回归方程为

对建立模型进行方差分析和显著性检验,分析结果分别见表3、4;响应面图见图6~11。



表2 响应面试验结果Tab.2 Experimental results of response surface

表3 方差分析Tab.3 Variance analysis of regression equation
由图6~11可以看出,钙结合量随着肽钙比、pH值、反应时间、反应温度的增加均呈现出先升高后降低的趋势,但增加和降低都较缓慢。从等高线形状可以看出,各因素之间的交互作用均不显著。

表4 回归方程系数显著性检验Tab.4 Significance test for each coefficient in established regression model
注: ** 代表差异极显著(P<0.01);*代表差异显著(P<0.05)。
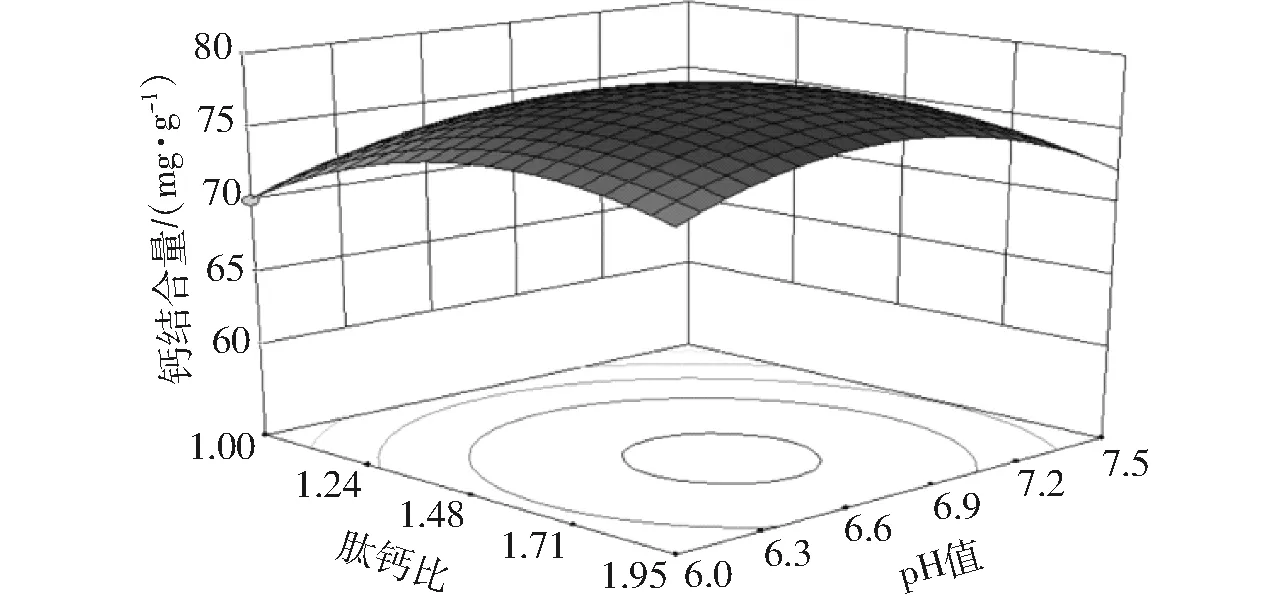
图6 肽钙比和pH值对钙结合量影响的响应面图Fig.6 Response surface plot for effect of peptide calcium ratio and pH value to calcium chloride on chelate ratio

图7 肽钙比和反应时间对钙结合量影响的响应面图Fig.7 Response surface plot for effect of peptide calcium ratio and reaction time to calcium chloride on chelate ratio

图8 肽钙比和反应温度对钙结合量影响的响应面图Fig.8 Response surface plot for effect of peptide calcium ratio and reaction temperature to calcium chloride on chelate ratio

图9 pH值和反应时间对钙结合量影响的响应面图Fig.9 Response surface plot for effect of pH value and reaction time to calcium chloride on chelate ratio

图10 pH值和反应温度对钙结合量影响的响应面图Fig.10 Response surface plot for effet of pH value and reaction temperature to calcium chloride on chelate ratio

图11 反应时间和反应温度对钙结合量影响的响应面图Fig.11 Response surface plot for effect of reaction time and reaction temperature to calcium chloride on chelate ratio
利用Design-Expert软件计算得到大豆钙肽螯合的最佳工艺参数为:肽钙比1.62、pH值6.65、反应时间43.64 min、反应温度38.43℃,钙结合量的预测值为78.86 mg/g。从实际操作考虑其可行性,最佳工艺参数修改为:肽钙比1.6、pH值6.6、反应时间44 min、反应温度38℃。在此条件下进行验证试验,重复3次,最终得到钙结合量平均值为78.73 mg/g,与理论预测值相差0.13 mg/g,说明利用此优化方法得到的大豆肽-钙的制备工艺是可靠的。
2.2 大豆肽-钙的溶解性
采用双缩脲法测定大豆肽-钙溶解性,得到标准曲线如图12所示。双缩脲法是基于铜离子与蛋白质之间的反应,溶解于碱性溶液中的硫酸铜加入蛋白质溶液中,二价的铜被还原成一价铜并在碱性环境中与蛋白质分子肽键中的氮形成络合物,该络合物呈紫红色,可在540 nm处进行检测,吸光度与蛋白质质量浓度成正比。

图12 溶解性标准曲线Fig.12 Standard curve of solubility
标准曲线线性良好,可用于溶解性计算。经过3次重复实验,得到大豆钙肽溶解度最终平均值为98.59%。
2.3 大豆肽-钙分子量分布
图13所示为大豆肽-钙螯合物的分子量分布情况,试验结果得出:分子量大于5 000 Da的大豆肽-钙螯合物占总体的1.76%;3 000~5 000 Da的占总体的2.79%;2 000~3 000 Da的占总体的3.51%;1 000~2 000 Da的占总体的11.70%;500~1 000 Da的占总体的25.87%;180~500 Da的占总体的47.91%;小于180 Da的占总体的6.64%。由此可知分子量小于5 000 Da的占绝大多数,是总体的98.24%,其中180~500 Da占比最大。优质大豆肽的分子量应小于1 000 Da,本试验所得分子量小于1 000 Da的大豆肽-钙螯合物占总体的80.24%。曾有研究发现,分子量大于1 000 Da的肽段与小于1 000 Da的肽段相比,更易参与大豆肽-钙螯合物的形成,这与本研究得到的结果有所不同,这可能是由于酶种类、效果及改性方式的差异所引起的[18]。此外,文献[25]采用超滤发现分子量低于1 000 Da的虾蛋白肽具有较高的钙结合量,这说明金属离子与不同相对分子量肽的结合与肽的来源也密切相关。

图13 分子量分布图Fig.13 Molecular weight distribution map
3 结论
(1)通过试验确定了肽钙比、反应时间、反应温度和pH值对钙结合量的影响,通过单因素试验和响应面试验设计,确定最佳螯合工艺为:钙肽比1.6,pH值6.6,反应温度38℃,反应时间为44 min,通过此工艺制备所得大豆肽-钙螯合物中钙结合量为78.73 mg/g。
(2)大豆肽-钙螯合物的溶解度为98.59%。大豆钙肽螯合物的分子量大于5 000 Da的占总体的1.76%,小于5 000 Da的占98.24%,小于1 000 Da的占80.24%,其中分子量180~500 Da占比最大。
