基于叶面叶绿素分布特征的黄瓜叶片氮钾元素亏缺诊断
2019-09-10石吉勇李文亭郭志明黄晓玮李志华邹小波
石吉勇 李文亭 郭志明 黄晓玮 李志华 邹小波
(江苏大学食品与生物工程学院, 镇江 212013)
0 引言
N、K元素亏缺往往引起作物叶绿素合成障碍,导致作物生长发育迟缓,甚至异常,进而影响作物的产量[1-2],且易导致产品内部营养组分含量下降,进而影响作物的质量[3-4]。凯氏定氮法、原子吸收法等元素分析方法可准确检测N、K元素亏缺,然而诊断过程耗时、操作复杂,难以实现N、K元素亏缺的高效诊断[5-6]。
叶绿素含量作为作物营养元素亏缺的诊断依据,已被广泛用于作物N、K元素亏缺的快速、无损诊断[7-9]。借助光谱信号与叶绿素含量之间的对应关系,可见光谱、近红外光谱等方法已被用于快速检测叶片的叶绿素含量,进而实现N、K元素亏缺的快速诊断[10-12]。然而,上述方法仅能感知叶片采样点处的叶绿素含量,无法描述叶绿素含量的叶面分布情况,故难以精确表征叶片不同区域的缺素特性。
利用高光谱图像数据既包含样品的光谱信息又包含样品的图像信息[13-15]的特点,本课题组实现了黄瓜叶片、枇杷叶、银杏叶等的品质指标分布检测[16-19]。在此基础上,本文采用高光谱图像技术检测N、K元素亏缺的黄瓜叶片叶绿素含量(质量比)分布,重点分析N、K元素亏缺导致的叶绿素分布差异,提取叶绿素分布特征作为N、K元素亏缺诊断依据,并建立N、K元素亏缺诊断方法。
1 材料与方法
1.1 缺素样本培育及验证
以水果黄瓜缺N植株、缺K植株以及对照植株的新鲜叶片为研究样本。将水果黄瓜种子(碧玉3号,上海富农种业有限公司)置于穴盘中育苗,待幼苗2片子叶完全长出后移栽至含有珍珠岩(使用前消毒,镇江培蕾有机肥有限公司)的花盆或枕袋。按照山崎配方配置对照组营养液(包含植株所需的全部营养元素),在温室大棚内用配置的营养液浇灌黄瓜植株。待黄瓜植株长出3片叶子时,将所有黄瓜植株分为缺N组、缺K组和对照组。缺N组植株使用的营养液为对照组营养液中完全去除N元素,缺K组植株使用的营养液为对照组营养液中完全去除K元素。为了保证试验结果的可靠性,分3批次培育缺N组植株40株、缺K组植株40株以及对照组植株50株。利用凯氏定氮法分别检测缺N组植株、对照组植株叶片的N元素含量[20],利用原子吸收法分别检测缺K组植株、对照组植株叶片的K元素含量[6],从而进一步验证缺N组植株、缺K组植株的缺素状态。
1.2 高光谱图像采集
采用可见光/近红外高光谱成像系统获取缺素样本的高光谱图像数据。高光谱成像系统硬件由线扫描高光谱仪(V10E型,Spectral Imaging Ltd.,芬兰)、线光源(DC-950A型,Dolan-Jenner Ltd.,美国)、电控平移台(TSA200-A型,北京卓立汉光有限公司,中国)、光箱和计算机组成[16]。高光谱成像系统软件为SpectralCube(Spectral Imaging Ltd.,芬兰)。高光谱图像采集参数设定如下:曝光时间为45 ms,图像分辨率为600像素×1 280像素,采样间隔为0.67 nm,电控位移平台速度为1.25 mm/s,电控位移平台行程为100 mm。样本采集过程中,整个系统均处于封闭状态以避免外界光线的干扰。采集得到的黄瓜叶片高光谱图像数据块如图1a所示,该数据块不仅包含单波段下黄瓜叶片的二维图像(图1b),而且包含单像素点下的光谱信息(图1c、1d)。

图1 黄瓜叶片高光谱图像数据块Fig.1 Cucumber leaf hyperspectral image data cube
1.3 叶绿素含量检测
采用高效液相色谱法检测黄瓜叶片样本对应的叶绿素含量,采用的主要仪器有高效液相色谱仪(LC-20A型,岛津,日本)、C18反相色谱柱(Agilent,Eclipse Plus C18,5 μm,4.6 mm×250 mm)、紫外可见光检测器(Prominence SPD-20A,岛津,日本)、梯度系统(LC-20AT型),涉及的主要试剂有叶绿素a标准品(#C5753,Sigma公司,美国)、叶绿素b标准品(# C5758,Sigma公司,美国)、甲醇、乙酸乙酯、丙酮、三乙胺、二丁基羟基甲苯。首先利用外标法建立叶绿素含量标准曲线,然后定量称取黄瓜叶片30~40 mg于丁酮水溶液中提取叶绿素后,将提取液送入高效液相色谱仪于440 nm波长下获取检测信号,并利用叶绿素含量标准曲线计算黄瓜叶片样本对应的叶绿素含量[19]。
1.4 基于叶面叶绿素分布特征的N/K缺素诊断

图2 叶面叶绿素分布特征无损表征及N、K元素亏缺诊断流程图Fig.2 Flow chart for nondestructive diagnostics of nitrogen and potassium deficiencies based on chlorophyll distribution features
叶面叶绿素分布特征无损表征及N、K元素亏缺诊断对应的流程如图2所示。首先,从校正集/预测集对应的高光谱数据块中提取感兴趣区域对应的光谱信息,构建校正集/预测集光谱数据集,结合校正集/预测集样本对应的叶绿素含量参考值,建立区间偏最小二乘(Interval partial least squares,IPLS)、联合区间偏最小二乘(Synergy interval partial least squares,SIPLS)、遗传偏最小二乘(Genetic algorithm-partial least squares,GA-IPLS)叶绿素含量校正模型[21]。其次,提取测试集样本高光谱数据块对应的光谱信息,构建测试集对应的光谱数据集,将其代入已建立的叶绿素含量校正模型计算叶绿素含量预测值,通过比较叶绿素含量预测值对叶绿素含量参考值的接近程度来验证叶绿素含量校正模型[22]。然后,利用待测黄瓜叶片高光谱数据块中各个像素点对应的光谱信息,结合验证后的叶绿素含量校正模型,得到各个像素点对应的叶绿素含量值,根据像素点坐标将其进行二维显示得到叶绿素含量分布图。最后,采集缺素叶片及对照组叶片的高光谱图像,检测缺素叶片及对照组叶片的叶绿素含量分布图,从中提取叶绿素的分布特征并建立N、K元素亏缺诊断模型。
2 结果与讨论
2.1 缺素样本验证结果
在3个批次样本培养试验后期,分别从每个批次取3株缺N植株、3株缺K植株、3株对照组植株共27株黄瓜植株进行N、K元素分析。缺N植株、缺K植株、对照组植株最低3节点(第1~3节点)、中间节点(第4~6节点)、最高3节点(第7~9节点)的N、K元素含量(质量比)分析结果如图3所示。N元素含量检测结果显示植株最低3节点处N元素含量差异明显(图3a),其中缺N组、缺K组和对照组对应的N素含量分别为6.91、12.53、13.55 mg/g,表明缺N组植株的最低3节点处叶片进入了N元素亏缺状态。K元素含量检测结果显示植株最低3节点处K元素含量差异明显(图3b),其中缺N组、缺K组和对照组老叶对应的K元素含量分别为0.53、0.81、0.85 mg/g,表明缺K组植株的最低3个节点处叶片进入了K元素亏缺状态。

图3 缺N、缺K以及对照组植株不同节点处叶片对应的N、K元素含量检测结果Fig.3 Detection results of N deficiency, K deficiency and control group corresponding N and K nutrient contents at different nodes
2.2 黄瓜叶片叶绿素分布检测
2.2.1叶绿素含量校正模型构建及验证
如图2所示,分别采集60片黄瓜叶片(缺N、缺K及对照组各20片)组成校正集和预测集,经高光谱图像采集和高效液相色谱法分析叶绿素含量后,分别利用IPLS、SIPLS、GA-IPLS结合提取的校正集/预测集光谱信息、叶绿素参考值建立IPLS、SIPLS、GA-IPLS叶绿素含量校正模型。其次,利用独立于校正集样本的30片黄瓜叶片构成测试集,将测试集光谱数据代入已建立的IPLS、SIPLS、GA-IPLS叶绿素含量校正模型得到叶绿素含量预测值,并将叶绿素含量预测值与叶绿素含量参考值进行比较。IPLS、SIPLS、GA-IPLS叶绿素含量校正模型及其对应的验证结果如表1所示,GA-IPLS模型效果最优,对应的校正集相关系数为0.938 5、校正集均方根误差为1.85 mg/g,对应的预测集相关系数为0.910 3、预测集均方根误差为1.90 mg/g,对应的验证集相关系数为0.903 9、验证集均方根误差为1.98 mg/g。

表1 基于叶片高光谱图像信息构建的叶绿素含量校正模型验证结果Tab.1 Chlorophyll content correction model based on hyperspectral image information of leaves
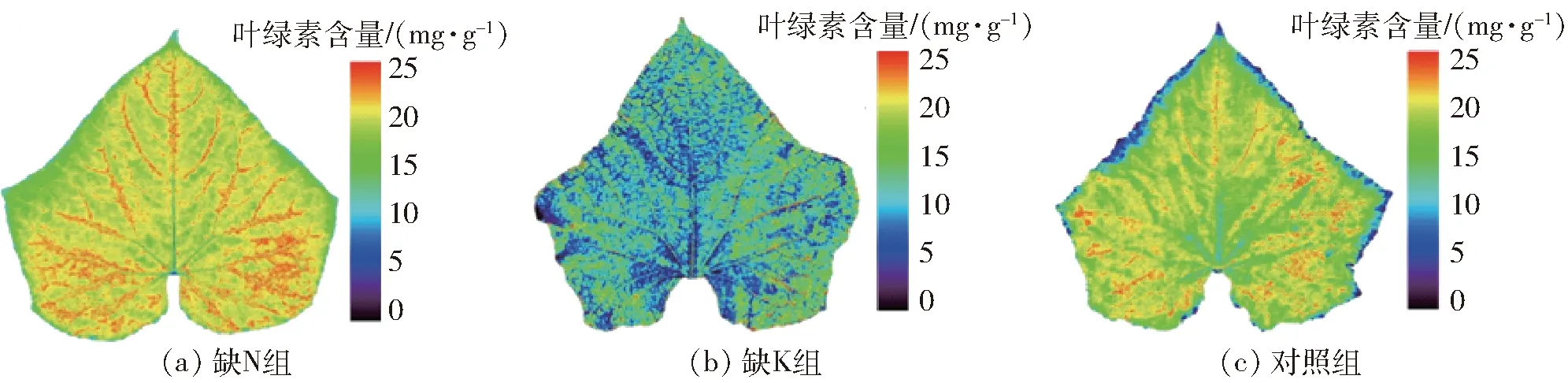
图4 不同组叶片对应的叶绿素含量分布图Fig.4 Distribution maps of chlorophyll in different leaf groups
2.2.2叶绿素含量分布检测
黄瓜叶片叶绿素含量分布图检测方法如图2所示。通过逐点提取黄瓜叶片高光谱图像数据块中各像素点对应的光谱信息,将其代入验证后的GA-IPLS叶绿素校正模型,借助叶绿素含量校正模型内部定义的叶片高光谱信号与叶绿素含量的对应关系,计算出各个像素点对应的叶绿素含量值,并将各个像素点对应的叶绿素含量值根据其坐标位置进行二维显示,从而实现黄瓜叶片叶绿素分布图的检测。据此分别采集缺N组、缺K组及对照组黄瓜叶片进行叶面叶绿素分布检测,结果如图4所示。
与对照组叶片的叶绿素含量分布(图4c)相比,缺N组叶片叶绿素分布(图4a)的特征为叶片中心区域大部分像素点对应的叶绿素含量低于对照组叶片;而缺K组叶片叶绿素分布的特征为叶绿素含量在叶片边缘的局部区域明显下降(图4b所示边缘蓝色区域)。图4表明,叶绿素含量在叶片中心区域及边缘区域的分布特征可作为诊断N、K元素亏缺的依据。
2.3 叶绿素分布特征提取及N、K缺素诊断
从培育的40株缺N植株、40株缺K植株以及50株对照组植株中分别选取缺N植株、缺K植株以及对照组植株各20株,从植株的前3个节点处采集缺N植株老叶50片、缺K植株老叶50片以及对照组植株老叶50片,按照3∶2的比例分为校正集和测试集,分别提取叶绿素在叶片中心区域和叶片边缘区域分布特征。叶片中心区域和叶片边缘区域的划分如图5所示,其中叶片中心区域被定义为叶面中心的矩形区域,叶片边缘区域被定义为随叶片轮廓变化的不规则环状区域。

图5 黄瓜叶片中心区域与边缘区域划分示意图Fig.5 Diagram of dividing central region and marginal region of cucumber leaves
首先,检测缺N组叶片和对照组叶片的叶绿素含量分布,并提取上述叶面叶绿素分布图中心区域所有像素点对应的叶绿素含量均值,如图6a所示。大部分对照组样本中心区域对应的叶绿素含量均值高于12.00 mg/g,而大部分缺N组样本中心区域对应的叶绿素含量均值低于11.00 mg/g。当设定N元素亏缺诊断阈值为11.50 mg/g,仅1个第3节点的缺N叶片误诊断为对照组叶片(图6a箭头所指样本),该阈值对应的校正集正确诊断率为98.33%。利用该阈值对预测集的N元素亏缺样本进行诊断,对应的正确诊断率为95.00%。
为了对K亏缺叶片及对照组叶片进行区分,统计缺K及对照组叶片叶绿素分布图中边缘区域叶绿素含量低于11.00 mg/g的特征像素点数量,结果如图6b所示。大多数缺K叶片边缘区域的特征像素点数量高于40个,而大多数对照组叶片边缘区域的特征像素点数量低于30个。当设定K元素亏缺诊断阈值为35个特征像素时,仅有1个第1节点的对照组样本和第3节点的缺K组样本诊断错误(图6b箭头所指样本),对应的校正集正确诊断率为96.67%。利用该阈值对预测集的K元素亏缺样本进行诊断,对应的正确诊断率为95.00%。

图6 基于叶片叶绿素分布特征的N、K元素亏缺诊断结果Fig.6 Diagnosing result of nitrogen and potassium deficiencies based on chlorophyll distribution features of cucumber leaf
3 结论
(1)利用GA-IPLS建立了基于黄瓜叶片高光谱信号的叶绿素含量校正模型(Rt=0.903 9),结合黄瓜高光谱图像包含的单个像素点对应的光谱信号实现了叶绿素含量的快速、无损检测。
(2)通过比较对照组、缺N组、缺K组叶片的叶绿素含量分布图,从中提取了中心区域所有像素点的均值、边缘区域叶绿素含量低于均值的像素点数量,并将其作为诊断作物N、K元素亏缺的特征,同时建立了基于叶绿素分布特征的N、K元素亏缺诊断方法,对N、K元素亏缺的正确诊断率均为95.00%。
(3)研究结果表明,叶面叶绿素分布特征可有效实现黄瓜叶片N、K元素的亏缺诊断。
