RDX和HMX的二氟氨基衍生物结构与性能的密度泛函理论研究
2019-09-10张英杰张路遥郑文芳潘仁明
刘 卉,张英杰,张路遥,2,郑文芳,潘仁明
(1.南京理工大学化工学院,江苏 南京 210094;2.甘肃银光化学工业集团有限公司,甘肃 白银 730900;3.上海航天化工应用研究所,上海 313002)
引 言
二氟氨基化合物适合在固体推进剂中作为氧化剂使用,有着高密度和高爆轰性能[1]。2009年,Chapman等[2-3]成功合成了HMX的二氟氨基取代物HNFX,研究得到HNFX、BeH2和NF基黏合剂配方的推进剂的比冲高达3038 N·s/kg。推进剂含氟高能组分如果与燃料硼配合使用,会产生更多低分子质量气体(BeF2、HF和H2),燃烧充分,放热量大,据估算硼氟化放热量是硼氧化的1.8倍[4]。氟化物即使与燃料铝配合使用,其放热量也远远高于氧化物[4]。
国内外虽已合成了一些二氟氨基衍生物,但因结构不稳定、合成困难等原因均未能实现大规模生产,故积极开发新的性能优良的含能二氟氨基化合物显得尤为必要。因此本研究在已合成的二氟氨基化合物结构基础上设计了一系列RDX和HMX的二氟氨基衍生物,并采用量子化学计算方法研究了其结构、能量特性及其规律性联系,为该类化合物的合成及应用提供参考。
1 计算方法
1.1 分子结构式
RDX和HMX的二氟氨基衍生物的分子结构式如图1所示。
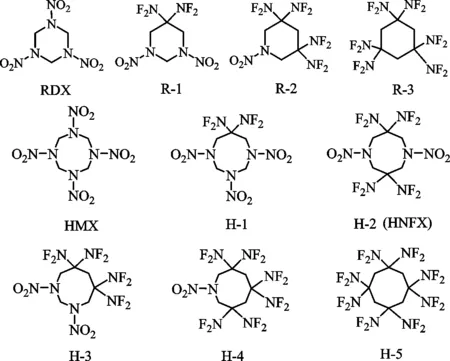
图1 RDX和HMX的二氟氨基衍生物的分子结构Fig.1 The molecular structures of the —NF2 derivatives of RDX and HMX
1.2 爆速、爆压和密度计算方法
爆速和爆压的计算应用简易经验K-J公式[5]:
(1)
(2)
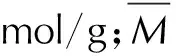
密度校正采用Politzer校正方法[6],可以更好地考虑到晶体中分子间相互作用的影响。方程如下[6]:
(3)

1.3 生成焓的计算方法
气态生成焓通过设计下列等键反应计算得到:

等键反应在298K的焓变(ΔH298)可由方程(4)计算,CH4、NH3、R-1′、R-2′和R-3′的生成焓取实验值[8];对没有实验生成焓的化合物NF2CH2NF2、NO2NH2、H-1′、H-2′、H-3′、H-4′和H-5′,应用G2理论[9]由原子化反应计算得到其精确的ΔfH(g)。
由气态生成焓(ΔfH(g))和升华焓(ΔHSub)根据Hess定律[10]求得其固态生成焓(ΔfH(s))(方程5),而升华焓由方程(6)[11-12]计算,此方法已成功应用于许多含能材料[13-16]。
ΔH298=∑ΔfH(g,P)-∑ΔfH(g,R)=
∑H(P)-∑H(R)
(4)
式中:ΔfH(g,R)和ΔfH(g,P)为反应物和产物在298K的生成焓;H(R)和H(P)为反应物和产物在298K的焓值。
ΔfH(s)=ΔfH(g)-ΔfHsub
(5)
式中:ΔHsub为升华焓,由Rice和Politzer等[11]提出的方程(6)[12]预测得到:
(6)
式中:AS代表分子的0.001e/Bohr3等电子密度曲面的表面积,由自编程序计算得到[7]。系数α1、β1和γ1取自文献[17]。
1.4 分子稳定性的计算方法
分子稳定性可用化学键断裂所需要的键离解能(BDE)大小来估算(方程(8));落锤高度(H50)也可以反映化合物稳定性的大小(Pospisil等建议的方程(9)[12]):

(7)
BDE(A-B)=[EA·+EB·]-E(A-B)
(8)
式中:A·和B·表示均裂A—B键所得产物(自由基);BDE(A-B)A—B表示键的键解离能;E(A-B)、EA·和EB·分别表示化合物及其均裂产生的自由基的能量。
(9)
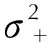
2 结果与讨论
2.1 生成焓
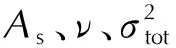
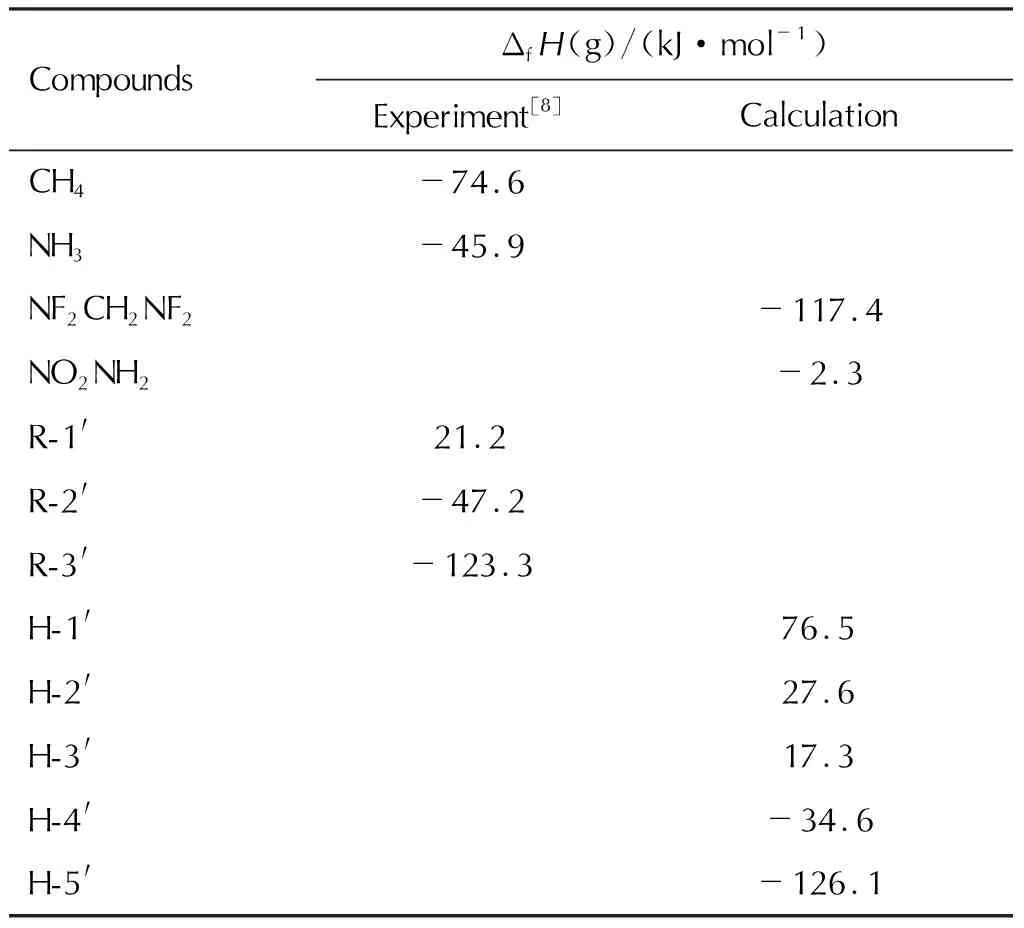
表1 相关化合物的气态生成焓Table 1 The gas-phase heats of formation for the reference compounds
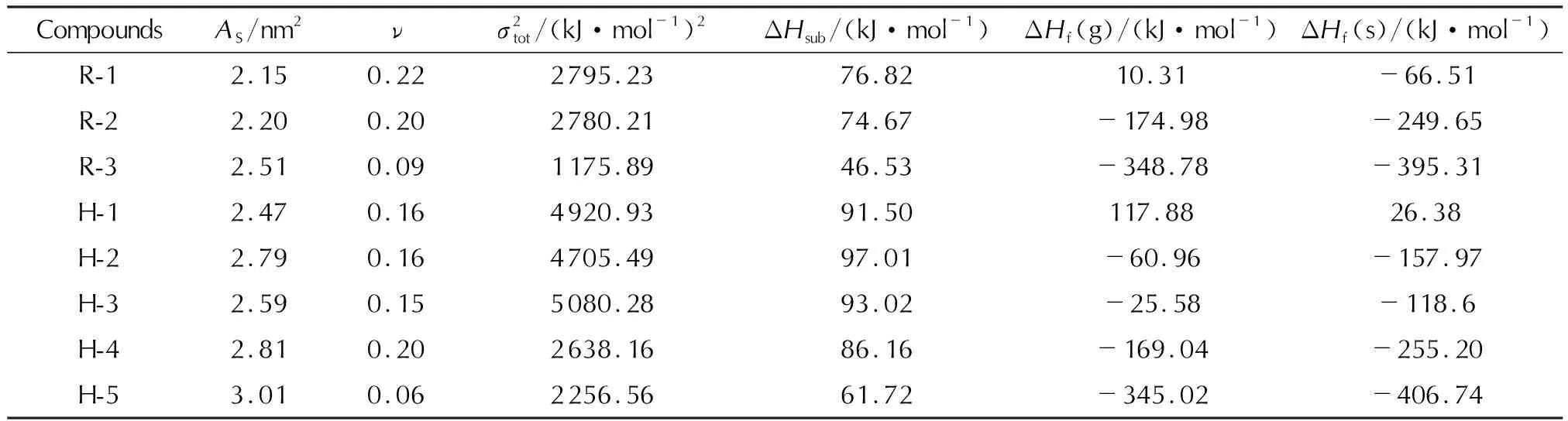
表2 RDX和HMX的二氟氨基衍生物的气态和固态生成焓以及相关参数Table 2 Calculated heats of formation and related parameters of difluoramino derivatives of RDX and HMX
从表2可以看出,除了化合物(H-1),其他化合物的ΔHf(g)和ΔHf(s)均为负值。RDX系列衍生物中从R-1到R-3,HMX系列衍生物中从H-1到H-5,随着—NF2取代基数目的增加,生成焓均呈下降趋势,表明—NF2取代可降低生成焓。在二取代偕二氟氨基的取代物中,对位二取代比邻位二取代的生成焓更低一些。
2.2 晶体密度和爆轰性能
由Politer校正方法计算了化合物的晶体密度。计算所得化合物的ρ、Q、D和p相关数据见表3。
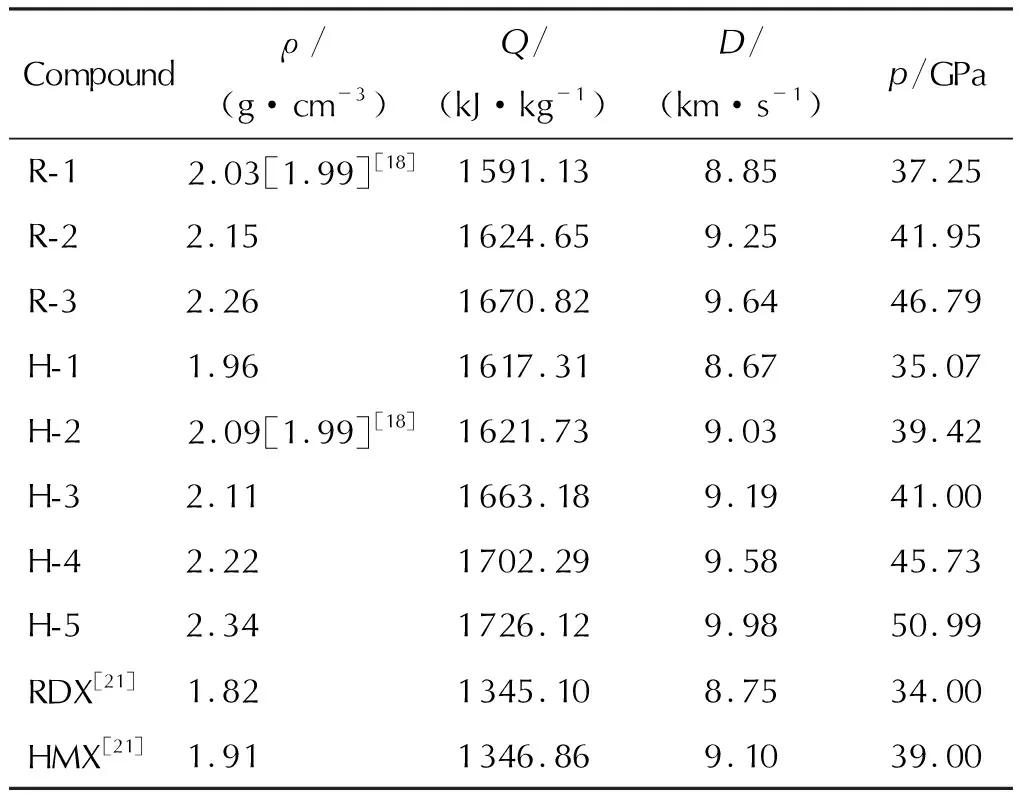
表3 计算所得化合物的密度、爆热、爆速和爆压Table 3 Calculated densities and detonation properties of the compounds
由表3可知,所有RDX和HMX的二氟氨基衍生物的密度(1.96~2.34g/cm3)均高于RDX和HMX的密度,且随着—NF2取代基数目的增加,化合物密度呈现上升趋势,表明—NF2是提高化合物密度非常显著的基团。
化合物的结构与爆轰性能的关系如图2所示。RDX和HMX化合物中引入—NF2会明显提高Q值。本方法预测所得R-1和HNFX(H-2)的密度(2.03g/cm3和2.09g/cm3)与其文献值(1.99g/cm3)[18]均符合得较好。由D和p的曲线形状与ρ的很相似可以看出,含能材料的爆轰性能主要取决于密度这一因素。
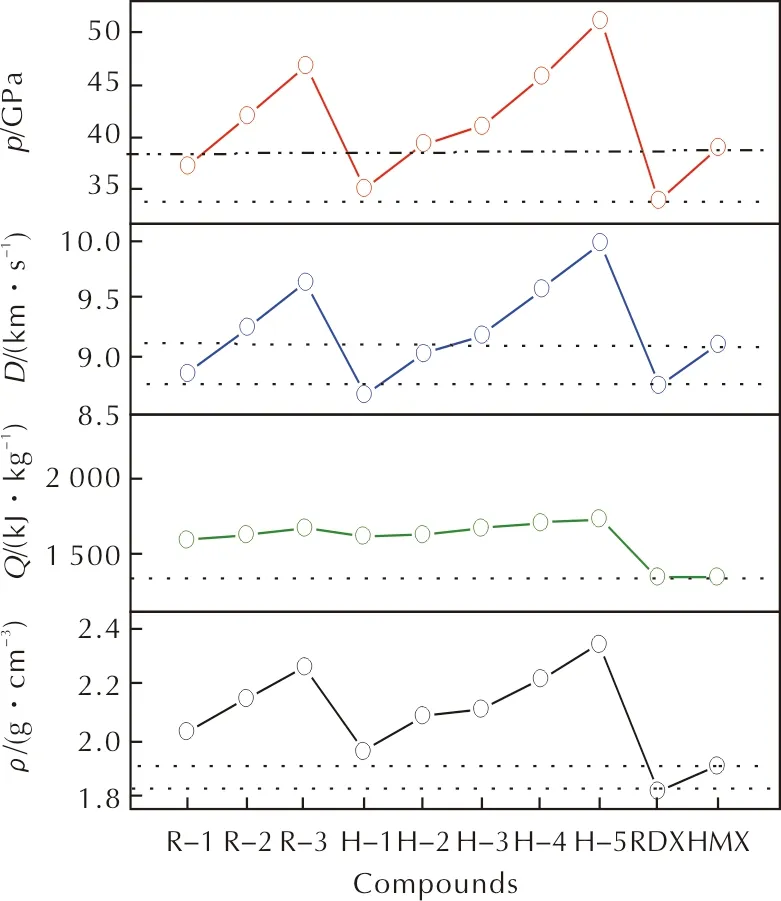
图2 化合物的密度、爆热、爆速和爆压对比Fig.2 Comparison of densities, heats of detonation, detonation velocities and detonation pressures of the compounds
所有衍生物的D值范围为8.85~9.98km/s,p值范围为35.07~50.99GPa,除H-1外的所有化合物的D值均高于RDX,R-1、H-1和H-2除外的化合物的D值高于HMX。所有化合物的p值均高于RDX,除R-1和H-1的p值低于HMX外,其余化合物的p值均高于HMX的。很明显,尽管引入—NF2会略微降低HOF,但是可以大大提高ρ值,因此—NF2对D和p的贡献很大。
2.3 分解机理和热力学稳定性
一般来说,化学键的BDE越小,该化学键越弱,分子越不稳定。本研究计算了较弱的键N—NO2和C—NF2的BDE,结果列于表4中。
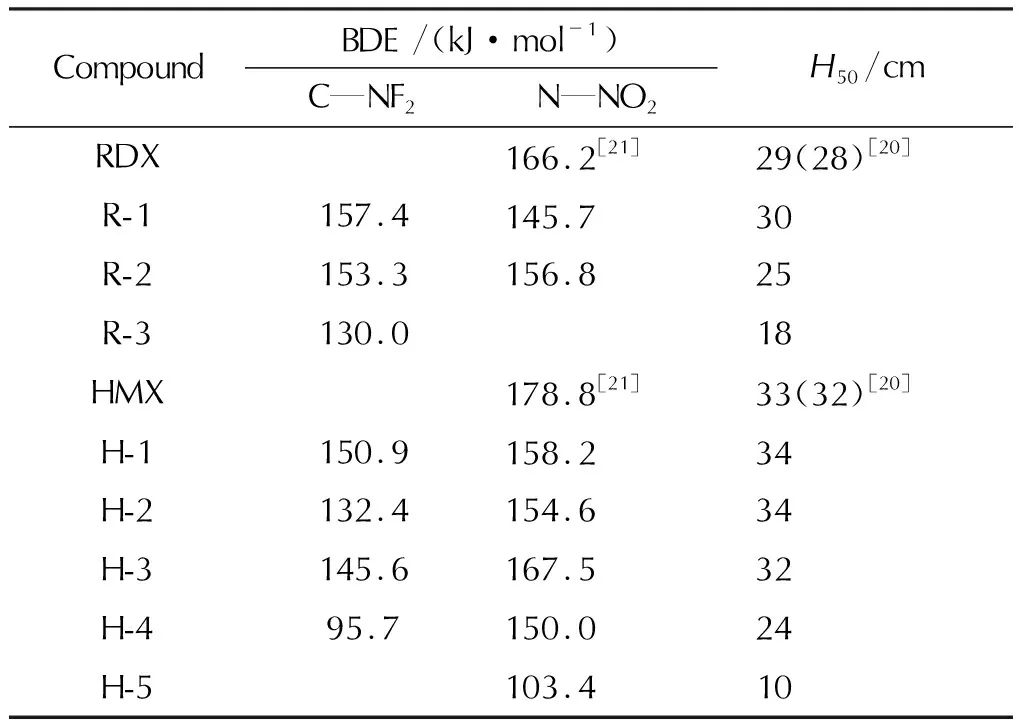
表4 化学键的键解离能(BDE)和撞击感度(H50)Table 4 Calculated bond dissociation energies (BDE) and impact sensitivities (H50)
由表4可见,化合物R-2、H-1、H-2、H-3、H-4中的C—NF2键的BDE均小于N—NO2键,表明这些化合物中C—NF2键可能是分解过程中的引发键。R-1的N—NO2键的BDE小于键C—NF2,表明此化合物中N—NO2键可能是分解过程中的引发键。R-3中C—NF2键可能是分解过程中的引发键,H-5中N—NO2键可能是分解过程中的引发键。所有化合物的BDE范围均在90~160kJ/mol,均满足高能材料稳定性的要求(BDE≈80~120kJ/mol)[19]。
本研究还通过估算撞击感度H50来评价化合物的稳定性,结果也列于表4中。RDX和HMX的H50理论计算值分别为29和33cm,文献值分别为28和32cm[20],理论计算值均与其文献值很接近。预测化合物的H50值大小顺序为:R-1>R-2>R-3;H-1≈H-2>H-3>H-4>H-5,基本上与BDE计算结果一致。可知化合物中引入更多的—NF2通常会降低稳定性,由H50判断的结果也比较合理。化合物中除R-1、H-1和H-2外其他化合物的H50值均小于相应的RDX和HMX,因此它们的稳定性均略低于RDX和HMX。
3 结 论
(1) 化合物的生成焓大部分为负值,分子中随着—NF2取代基数目的增加、生成焓呈下降趋势,表明—NF2取代可降低生成焓。
(2) 化合物均具有比RDX和HMX更高的密度,随着—NF2取代基数目的增加、化合物密度呈上升趋势。RDX和HMX化合物中引入—NF2会提高Q值。所有衍生物的D均在8.85~9.98km/s,p均在35.07~50.99GPa范围,绝大部分化合物的D优于RDX和HMX。所有化合物的p优于RDX,大部分化合物的p优于HMX。—NF2对D和p的贡献很大。
(3) C—NF2键或N—NO2键是分解过程中可能的引发键。所有化合物的BDE均在90~160kJ/mol,均满足高能材料稳定性的要求。预测的H50值的顺序基本上与BDE计算结果相一致。化合物中引入更多的—NF2通常会降低稳定性,由H50判断的结果也比较合理。大部分化合物的稳定性略低于RDX和HMX。
(4) 综合考虑爆轰性能和稳定性两方面的因素,大部分RDX和HMX的—NF2衍生物是潜在的高能量密度化合物。
