鹰嘴豆中植物甾醇的鉴定及生物接近度研究
2019-09-10王晓丽袁宜霖李非凡杨瑞楠张良晓梅晓宏
王晓丽 袁宜霖 李非凡 杨瑞楠 张良晓 梅晓宏
摘 要:为考察鹰嘴豆中植物甾醇的含量,研究建立体外模拟消化模型来测定鹰嘴豆经不同加工方式处理后植物甾醇的生物接近度。以鹰嘴豆为原料,采用气相色谱-质谱联用法对其植物甾醇种类、含量及存在形式进行鉴定分析。同时通过体外模拟消化实验,分别研究热处理、微波处理和超高压处理对鹰嘴豆中植物甾醇生物接近度的影响。结果表明:鹰嘴豆中主要含有β-谷甾醇(1 003.87±6.27mg/kg)、菜油甾醇(164.00±2.86mg/kg)、Δ5-燕麦甾烯醇(100.46±0.93mg/kg)、豆甾醇(58.02±0.14mg/kg)、豆甾烷醇(20.26±0.16mg/kg)、Δ7-燕麦甾烯醇(14.78±0.16mg/kg),此外,还含有微量的胆固醇(0.81±0.01mg/kg)和菜油甾烷醇(0.73±0.01mg/kg),上述各类甾醇主要以游离形式存在。热处理、微波处理与超高压处理均导致鹰嘴豆中植物甾醇生物接近度不同程度的降低。研究表明,食用鹰嘴豆时采用较短时间的热加工或微波处理有利于减少植物甾醇的生物接近度的下降。
关键词:鹰嘴豆;植物甾醇;体外模拟消化;生物接近度
鹰嘴豆(Cicer arietinum)是一种豆科属的草本类植物,广泛分布在亚洲南部和西部、非洲的东部和北部、欧洲南部和北美洲等地,其中印度和巴基斯坦的种植面积占世界种植面积的80%。在我国,鹰嘴豆主要分布在新疆、甘肃、内蒙等地,特别是在新疆的木垒县,是鹰嘴豆的主要产区,已有2 500年的种植历史[1]。鹰嘴豆中富含多种对人体有益的营养成分,如蛋白质、氨基酸、矿物质、维生素、不饱和脂肪酸、不溶性膳食纤维、异黄酮、植物甾醇等[2-4],这些营养成分赋予鹰嘴豆具有降血糖、降血脂和降低胆固醇等多种保健功效,在食品、药品领域具有极高的应用价值。
植物甾醇是以环戊烷多氢菲为骨架的三萜类化合物,是一种天然生物活性物质,通常以谷甾醇、豆甾醇、菜油甾醇、菜籽甾醇等游离甾醇及其结合甾醇的形式存在于自然界中[5]。植物油料种子中甾醇含量很高,玉米油中甾醇含量高达1 032.07mg/100g,其次是芝麻油、菜籽油等[6]。临床研究表明,每日膳食中摄入2~3g植物甾醇可以使人体血液中胆固醇含量降低8%~15%[7-9]。此外,植物甾醇还具有抗癌、抗增殖、抗炎和抗菌等作用。但是,植物甾醇在水相和油相中溶解度差,导致其在人体内的生物利用率很低[11],限制了其在食品工业中的广泛应用。李晓静等[10]采用多种色谱技术对鹰嘴豆中植物甾醇进行分离精制,通过理化性质和波谱分析进行结构鉴定,从鹰嘴豆中鉴定出β-谷甾醇。邢江浩[12]采用高效液相色谱法从鹰嘴豆中鉴定出豆甾醇。Ziaulhaq M等[4]采用气相色谱法从鹰嘴豆油中检测出β-谷甾醇、豆甾醇和菜油甾醇等,且不同品种鹰嘴豆中的甾醇含量略有差异。而目前对于鹰嘴豆中所含植物甾醇存在形式的研究鲜有文献报道。
许多研究结果表明,食物的加工方式(如加热、微波处理、超高压处理等)会不同程度影响营养物质的生物接近度[13]。生物接近度是指营养物质从食品基质中释放到胃肠道或包被在脂质微粒中的程度,在体外模拟消化实验中通常用来描述营养物质被吸收利用的程度,一般用胶束化率来表示。研究发现,对鹰嘴豆进行烹饪处理,导致其脂肪、总灰分、碳水化合物、抗营养因子、矿物质和B族维生素含量显著降低,其中,微波加热对鹰嘴豆中B族维生素和矿物质的损失小于传统加热和高压处理所造成的损失,而上述加工方式均能提高蛋白质体外消化率和必需氨基酸指数[14]。不同加工方式对鹰嘴豆中植物甾醇生物接近度的影响却未见研究。
本研究以鹰嘴豆为原料,分别提取游离甾醇和总甾醇,采用气相色谱-质谱联用法(GC-MS)分析鹰嘴豆中植物甾醇种类、含量及存在形态,并选取对豆类食品常用的3种加工方式即热处理、微波处理和超高压处理的鹰嘴豆进行体外模拟消化实验,以评估上述3种处理方式对植物甾醇生物接近度的影响,为鹰嘴豆的科学、合理膳食提供理论指导,同时为鹰嘴豆用于食品加工领域提供科学依据。
1 材料与方法
1.1 材料与试剂
鹰嘴豆,大漠盛宴旗舰店;甾醇标准品(胆固醇、胆甾烷醇、菜籽甾醇、麦角甾醇、菜油甾醇、菜油甾烷醇、豆甾醇、β-谷甾醇、Δ7-燕麦甾烯醇、豆甾烷醇、Δ5-燕麦甾烯醇),美国Sigma公司;衍生剂N-甲基-N-三甲基硅烷基七氟丁酰胺∶1-甲基咪唑(95∶5,v/v),美国Sigma公司;胃蛋白酶、胰蛋白酶、脂肪酶、猪胆盐,美国Sigma公司;正己烷、二氯甲烷、丙酮为色谱纯;盐酸、乙醚、石油醚、乙醇均为分析纯,北京蓝弋公司。
1.2 仪器与设备
FreeZone冷冻干燥机,美国LABCONCO公司;JYL-B063九阳料理机,山东九阳股份有限公司;SER148全自动脂肪测定仪,北京盈盛恒泰科技有限公司;MDF-382E(N)超低温冰箱,日本SANYO公司;FW100高速万能粉碎机,天津市泰斯特仪器有限公司;FA1004电子天平,上海越平科学仪器有限公司;全波长酶标仪,美国Thermo公司;Vortex-QL-901涡旋振荡器,江苏其林贝尔仪器制造有限公司;NK200-18可视孔氮吹仪,杭州米欧仪器有限公司;TGL-16台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;HH-8電热恒温水浴锅,上海棱光技术有限公司;气相色谱-质谱联用仪(GCMS-TQ8040),日本岛津公司;硅胶固相萃取小柱silica 0.5 g/6mL(SPE),北京迪马公司;HH-8电热恒温水浴锅,上海棱光技术有限公司;P70D20TL-D4微波炉,广东格兰仕微波生活电器制造有限公司;Hiperbaric-135超高压非热杀菌设备,东莞市莱曼五金机械有限公司。
1.3 试验方法
1.3.1 鹰嘴豆预处理 将鹰嘴豆粉碎,置于-80℃超低温冰箱中进行预冻处理,之后冷冻干燥48 h以除去粉末中剩余水分,于-20℃低温冻藏备用。B0D68CF5-9604-4A1B-A44A-F795F3CCB89B
1.3.2 鹰嘴豆中油脂的提取 取1~3 g经1.3.1预处理并冻存的鹰嘴豆粉末放于滤纸筒,滤纸筒放入提取筒中,加入30mL石油醚。将提取筒放入自动脂肪提取仪,65℃加热1 h,提起提取筒,65℃继续抽提1.5 h,差量法获得油脂数据。将油脂于-20℃保存备用。
1.3.3 鹰嘴豆中游离甾醇的提取 取50 mg1.3.2所制备的油脂样品,加入20 μg胆甾烷醇内标,用5mL正己烷溶液溶解,涡旋振荡均匀,备用。称取1.0 g无水硫酸钠加到固相萃取小柱的上方,然后用10mL正己烷溶液活化,流速1.5mL/min,弃去流出液。将5mL样品液注入到固相萃取小柱中,控制流速1.2mL/min,弃去流出液。用10mL体积分数5%乙醚-正己烷溶液进行淋洗,除去甘油三酯和甾醇酯类化合物,流速控制在1.2mL/min,弃去流出液。用10mL体积分数为20%乙醚-正己烷溶液洗脱游离甾醇并收集于洁净干燥的试管中,流速控制在1.5mL/min。氮吹吹干有机相,4℃贮藏备用。
1.3.4 鹰嘴豆中总甾醇的皂化和提取 取50 mg1.3.2所制备的油脂样品,加入20 μg胆甾烷醇作为内标,加入2mol/L氢氧化钾-乙醇溶液4mL,二氯甲烷0.5mL,涡旋振荡1min混匀。25℃水浴振摇18 h。加入二氯甲烷5mL,超纯水3mL,轻轻混合均匀以免产生泡沫,去除上清后,再用5mL超纯水清洗3次,弃上清,氮吹吹干有机相,4℃贮存备用。由总甾醇和游离甾醇相减得到结合甾醇含量。
1.3.5 鹰嘴豆中结合态甾醇含量的测定 由总甾醇含量减去游离甾醇含量得到每种结合态甾醇的含量。
1.3.6 鹰嘴豆中植物甾醇的分析鉴定 (1)色谱条件:载气:氦气(纯度99.999%);色谱柱:DB-5MS色谱柱(30m×0.25mm×0.25μm);进样口温度:290℃;分流进样:20∶1;进样量:1μL;流速:1.2mL/min;程序升温:初始温度100℃(保持1min),以40℃/min升至290℃(保持15min)。(2)质谱条件:电离方式:EI;电离能量:70 eV;离子源温度:250℃;传输线温度:290℃;监测方式:SIM模式。(3)GC-MS 检测:称取各甾醇标准品 5mg(β-谷甾醇 10mg),分别用丙酮配置浓度梯度为 0.1、0.2、0.3、0.4、0.5mg/mL的甾醇混合标准溶液,氮吹吹干。将上述制备的甾醇混合标准溶液、1.3.3和1.3.4提取的甾醇样品中均加入 100 μL衍生剂于 75℃衍生 20min,正己烷定容到 1mL,进样 1 μL 用 GC-MS检测。样品中所含有的植物甾醇定性鉴定采用与甾醇标准物质保留时间的比对及质谱库检索的方法进行。样品中植物甾醇定量分析采用内标法,依据总离子流色谱图峰面积计算每种甾醇的含量。
1.3.7 鹰嘴豆热处理 按1∶1(m/v,g/mL)比例加入鹰嘴豆和超纯水,于4℃下泡豆6 h。取适量浸泡好的鹰嘴豆倒入烧杯中,按上述比例加入超纯水。80℃水浴加热,期间不断搅动,使鹰嘴豆受热均匀,分别在2、6、10、30、50min等5个时间点对鹰嘴豆取样。匀浆后,4℃贮藏备用。
1.3.8 鹰嘴豆微波处理 取适量按1.3.7方法所浸泡好的鹰嘴豆倒入烧杯中,按1∶1(m/v,g/mL)比例加入超纯水。微波加热处理,额定功率350 W,分别在1、2、6、10、15min等5个时间点对鹰嘴豆取样。匀浆后,4℃贮藏备用。
1.3.9 鹰嘴豆超高压处理 取适量按1.3.7方法所浸泡好的鹰嘴豆,按1∶1(m/v,g/mL)比例加入超纯水,匀浆处理。将鹰嘴豆匀浆分装于耐高压包装袋中,分装完成后用真空封口机封口,尽量避免样品与热封机封口条接触。将分装好的样品放入高压反应釜中,浸没于传压介质(本试验为水)中,在20℃、压力400MPa下进行处理,分别在1、2、6、10、15min等5个时间点对鹰嘴豆取样。压力升至设定压力时开始计时,到达处理时间后设备自动泄压,超高压处理结束后,将样品立即放入冰浴中冷却,于4℃贮藏备用。
1.3.10 鹰嘴豆中植物甾醇生物接近度的测定 参考Versantvoort等[14]的方法,分别配置模拟唾液、胃液、肠液和胆汁,其中唾液用于模拟口腔消化、胃液用于模拟胃消化、肠液和胆汁用于模拟小肠消化。体外模拟消化过程根据文献方法[15]稍有改动。分别取10 g经上述不同加工处理后的鹰嘴豆匀浆置于50mL棕色离心管中,加入30mL模拟唾液,搅拌均匀后37℃下振荡5min。取出样品,用0.1mol/L盐酸溶液调节体系pH 至2.0,加入30mL模拟胃液,37℃下振摇1 h。反应结束后用0.1mol/L碳酸氢钠溶液调节体系pH至7.0,加入30mL肠液胆汁复合液,37℃下水浴振摇2 h,以模拟肠道消化。反应结束后,将混合体系于10 610g离心15min,取上清液并用0.22μm滤膜过滤,收集滤液。用硫磷铁法[16]在548 nm处测定上述滤液中植物甾醇含量(记为W1)。同样的方法测定未消化鹰嘴豆匀浆中植物甾醇含量(记为W0)。计算鹰嘴豆中植物甾醇经模拟消化后的胶束化率,從而用来衡量其生物接近度,计算公式如式(1):
生物接近度(%)=WIW0×100(1)
式(1)中,W1为消化后滤液中植物甾醇的含量;W0为未消化的鹰嘴豆匀浆中植物甾醇的含量。
1.3.11 统计分析 每次试验重复3次,取平均值,并计算标准偏差。利用Excel 2010进行数据统计与处理。不同加工方式对鹰嘴豆植物甾醇生物接近度的影响采用SPSS 17.0进行单因素方差分析(One-way ANOVA),同时使用Duncan法进行多重比较(P<0.05)。使用Origin 8.06绘制甾醇标准物质和样品的总离子流气相色谱图。B0D68CF5-9604-4A1B-A44A-F795F3CCB89B
2 结果与分析
2.1 鹰嘴豆中植物甾醇的种类、含量及存在形态分析
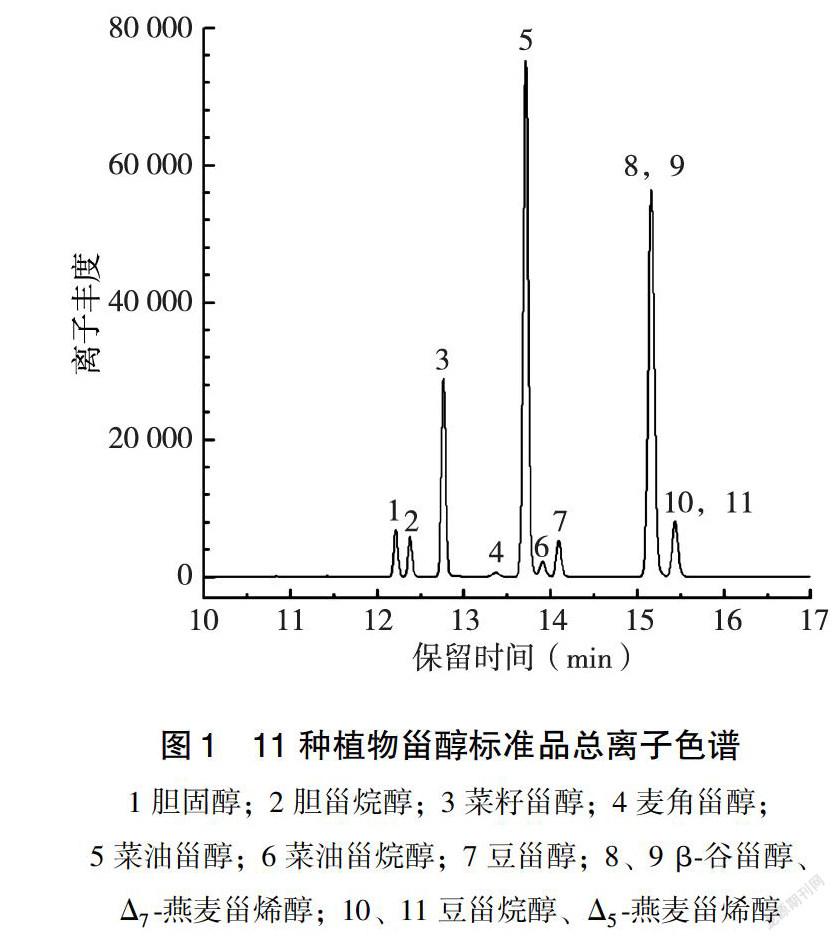
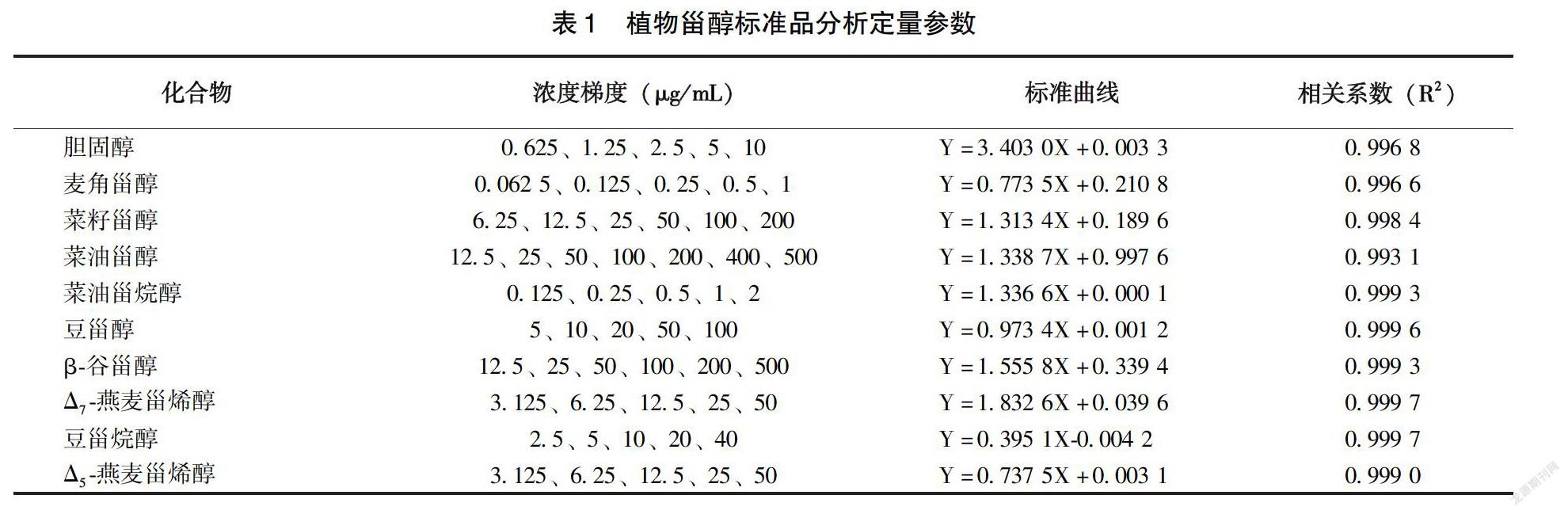
如图1所示,混合标准品中各植物甾醇化合物在1.3.6气相色谱条件下得到较好的分离。各植物甾醇在其浓度范圍内标准曲线的相关系数均大于 0.99(表1)。
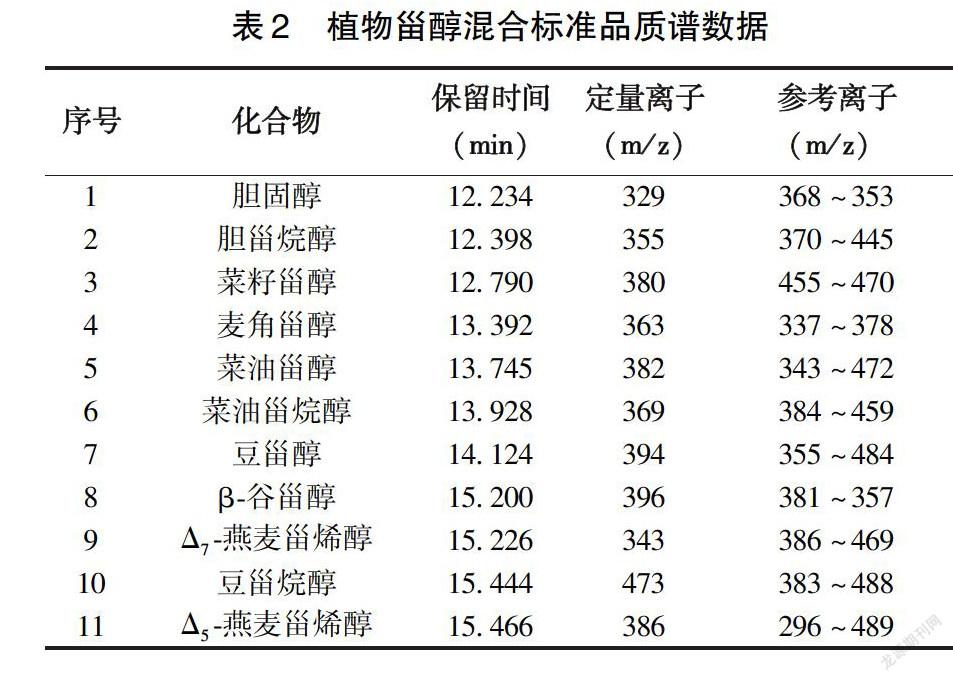
根据各标准品保留时间和 GC-MS中的离子碎片(表 2)对鹰嘴豆油中植物甾醇进行定性、定量分析。如图2~3所示,经 GC-MS 鉴定出鹰嘴豆油中含有β-谷甾醇、菜油甾醇、Δ5-燕麦甾烯醇、豆甾醇、豆甾烷醇、Δ7-燕麦甾烯醇、胆固醇、菜油甾烷醇8种甾醇,其中β-谷甾醇含量最高,占鹰嘴豆中甾醇总量的73.65%,而菜油甾醇、Δ5-燕麦甾烯醇、豆甾醇含量也较高(表3)。所鉴定出的上述8种植物甾醇中均主要以游离甾醇形式存在,结合甾醇所占比例较小。与其他研究结果相比,本研究利用固相微萃取方法提取分离出鹰嘴豆中总游离甾醇,并对其种类和含量进行分析鉴定,所获得的研究结果对鹰嘴豆中植物甾醇的存在形态给出了明确的结果,这对鹰嘴豆中所含有的营养成分进行了有力的补充,从而促进鹰嘴豆在药食同源中的广泛应用。而具体的结合态甾醇存在形式还需做进一步分析验证。与其他豆类相比,鹰嘴豆中植物甾醇总量和红豆相似,低于大豆、绿豆、黑豆等植物甾醇总量[17]。韩军花[18]在对不同豆类中总甾醇含量进行分析时,发现植物甾醇含量可能与豆类中碳水化合物的含量有关,碳水化物含量高的豆类中植物甾醇含量相对较低。
2.2 加热处理对鹰嘴豆中植物甾醇生物接近度的影响
如图4所示,与对照组相比,对鹰嘴豆匀浆热处理2min时,植物甾醇的生物接近度略微升高,但升高幅度不显著,之后随加热时间的延长,植物甾醇生物接近度持续显著地下降。当处理时间达30min后,生物接近度不再发生显著变化。许多研究表明,食物在经过热加工后,由于食物基质和颗粒遭到一定的破坏,会促进营养素的释放,从而增加营养素的生物接近度。不过也有一些研究表明,热加工过程对某些营养素生物接近度增加不明显,甚至还会降低[19],比如Rock等[20]研究发现,热加工处理降低了胡萝卜和菠菜中β-胡萝卜素的生物接近度。试验结果表明,对鹰嘴豆短时间的热处理会一定程度提升甾醇的生物接近度,但是随着热处理时间的延长,植物甾醇的生物接近度将显著下降,这可能是因为轻微的加热促进甾醇从食物基质中释放出来,有助于甾醇胶束化结构的生成。而过度长时间加热可能导致鹰嘴豆细胞结构被破坏,使甾醇在胃肠液中被迅速消化降解。也可能是因为破坏了甾醇胶束化结构的稳定性,导致胶束化率降低,从而影响其在人体内的吸收。研究结果表明,在鹰嘴豆食用过程中,进行较短时间的热处理有利于保持其中植物甾醇的生物接近度。
2.3 微波处理对鹰嘴豆中植物甾醇生物接近度的影响
如图5所示,与对照组相比,不同时间下的微波处理均导致鹰嘴豆匀浆中植物甾醇体外生物接近度降低,且显著低于对照组,当微波处理15min时,植物甾醇生物接近度降至2.2%左右,达最低值。与传统的加热方式相比,微波加热是一种“冷热源”,它在产生和接触到物体时,不是直接的热传导,而是电磁能,具有一系列传统加热所不具备的独特优点[21]。微波的波长短、频率高,通过增加分子间作用力,会导致一些不饱和键的破坏甚至降解,从而促进食物中营养物质在人体内的消化吸收[22]。一般情况下,微波加热对食物营养素的损失相对较小,通常会提高营养物质的生物接近度[23-25]。本研究结果揭示,与加热处理相比,微波处理对鹰嘴豆中植物甾醇生物接近度的影响较为显著,这可能与样品本身的属性有关,微波加热可能破坏了植物甾醇的结构,阻碍了植物甾醇从食物基质中的释放。研究结果表明,在鹰嘴豆食用过程中,进行较短时间的微波有利于保持其中植物甾醇的生物接近度。
2.4 超高压处理对鹰嘴豆中植物甾醇生物接近度的影响
如图6所示,与对照组相比,对鹰嘴豆高压处理1min后,植物甾醇生物接近度显著下降,之后随着处理时间的延长,鹰嘴豆中植物甾醇生物接近度有所回升,并始终处于波动状态。与传统的热处理相比,超高压技术只作用于食物基质中化学物质的非共价键,不会使食物基质的色、香、味等物理特性发生变化,因而在食品加工领域很受关注。近年来,国内外广泛开展了超高压技术对相关营养素生物接近度影响的研究[26-28]。刘兴辰等[29]研究发现,胡萝卜汁经超高压(600MPa/10min)处理后,α-和β-胡萝卜素的生物接近度均显著降低。Jennifer K等[30]研究发现,四季豆经超高压600MPa处理2min后,叶黄素生物接近度显著提高,但是超高压对胡萝卜和花椰菜中类胡萝卜素生物接近度的影响不大。本研究表明,短时间超高压处理会显著降低鹰嘴豆中植物甾醇的生物接近度,这可能是由于超高压导致鹰嘴豆中植物甾醇结构发生明显变化,从而限制了植物甾醇与消化酶和胆汁盐的接近,降低了植物甾醇的胶束化程度。研究结果表明,对鹰嘴豆进行超高压处理,不利于其中植物甾醇的生物接近度。
3 结论
本研究利用GC-MS方法分析了鹰嘴豆油脂中植物甾醇的种类、含量及存在形态,并对经加热、微波及超高压处理的鹰嘴豆中植物甾醇生物接近度变化情况进行了研究。结果表明,鹰嘴豆中主要含有β-谷甾醇、菜油甾醇、Δ5-燕麦甾烯醇、豆甾醇、豆甾烷醇、Δ7-燕麦甾烯醇,此外还含有微量的胆固醇和菜油甾烷醇。所鉴定出的上述8种植物甾醇中均主要以游离甾醇形式存在,结合甾醇所占比例较小。体外模拟消化实验表明,鹰嘴豆中植物甾醇的生物接近度较低。加热、微波及超高压处理均会导致鹰嘴豆中植物甾醇生物接近度不同程度的下降,食用过程中可以采用较短时间的热处理或者微波处理来最大程度降低植物甾醇生物接近度的下降。
参考文献
[1]海力前木·卡地尔,艾拜都拉·阿布都拉.新疆迪西型鹰嘴豆中脂肪和蛋白质组分的研究(摘要)[J].安徽农业科学,2011,39(17):165-167.B0D68CF5-9604-4A1B-A44A-F795F3CCB89B
[2]冯婷.鹰嘴豆营养保健价值及其应用[J].中国食物与营养,2011(1):67-69.
[3]肖俊松,吴华,张亚歌.鹰嘴豆萌发过程中营养成分和抗营养因子的变化规律[J].食品科学,2011,32(23):134-138.
[4]Ziaulhaq M,Ahmad S,Ahmad M,et al.Effects of cultivar and row spacing on tocopherol and sterol composition of chickpea(Cicer arietinum L)seed oil[J].Tarim Bilimleri Dergisi,2009,15(1):25-30.
[5]郭咪咪,王瑛瑤,栾霞,等.植物甾醇的提取、生理功能及在食品中的应用综述[J].食品安全质量检测学报,2014(9):2771-2775.
[6]韩军花,杨月欣,冯妹元,等.中国常见植物食物中植物甾醇的含量和居民摄入量初估[J].卫生研究,2007(3):301-305.
[7]Rideout T C,Chan Y M,Harding S V,et al.Low and moderate-fat plant sterol fortified soymilk in modulation of plasma lipids and cholesterol kinetics in subjects with normal to high cholesterol concentrations:report on two randomized crossover studies[J].Lipids in Health and Disease,2009,8(1):45.
[8]Jones P J,Demonty I,Chan Y M,et al.Fish-oil esters of plant sterols differ from vegetable-oil sterol esters in triglycerides lowering,carotenoid bioavailability and impact on plasminogen activator inhibitor-1(PAI-1)concentrations in hypercholesterolemic subjects[J].Lipids in Health and Disease,2007,6(1):28.
[9]Egbert Hovenkamp,et al.Biological effects of oxidized phytosterols:review of the current knowledge[J].Progress in Lipid Research,2008,47(1):37-49.
[10]李晓静,等.维药鹰嘴豆的化学成分研究[J].现代药物与临床,2010,25(3):188-190.
[11]徐祎冰,杨爽,刘红兵.植物甾醇肠道吸收研究进展[J].中国海洋药物,2016,35(6):93-98.
[12]邢江浩.鹰嘴豆总异黄酮的提取工艺及其化学成分研究[D].西安:第四军医大学,2008.
[13]Cilla A,et al.Effect of processing on the bioaccessibility of bioactive compounds-a review focusing on carotenoids,minerals,ascorbic acid,tocopherols and polyphenols[J].Journal of Food Composition & Analysis,2018,68:3-15.
[14]Alajaji S A,El-Adawy T A.Nutritional composition of chickpea(Cicer arietinum,L.)as affected by microwave cooking and other traditional cooking methods[J].Journal of Food Composition & Analysis,2006,19(8):806-812.
[15]Versantvoort C H,et al. Applicability of an in vitro digestion model in assessing the bioaccessibility of mycotoxins from food[J].Food & Chemical Toxicology,2005,43(1):31-40.
[16]刘蕾,陈星,李晓丽,等.分光光度法测定大豆总甾醇含量的研究[J].中国油脂,2005(4):45-47.
[17]王东晖,张玥,范蓓,等.气相色谱-质谱联用法分析不同产地豆类中植物甾醇形态及含量[J].农产品质量与安全,2017(3):21-27、37.
[18]韩军花,冯妹元,王国栋,等.常见谷类、豆类食物中植物甾醇含量分析[J].营养学报,2006(5):375-378.
[19]代蕾,孙翠霞,刘夫国,等.油脂添加及加工模式对果蔬中类胡萝卜素生物接近度影响[J].中国食品添加剂,2016(1):59-64.
[20]Rock C L,et al.Bioavailability of beta-carotene is lower in raw than in processed carrots and spinach in women[J].Journal of Nutrition,1998,128(5):913.B0D68CF5-9604-4A1B-A44A-F795F3CCB89B
[21]牟群英,李贤军.微波加热技术的应用与研究进展[J].物理学和高新技术,2004,33(6):438-442.
[22]庞敏,姜绍通,潘丽军,等.不同加热方式对脂质基质中甾醇稳定性及其抗氧化性能的影响[J].食品科学,2012,33(21):39-42.
[23]常丽新,韩近,王换霞.不同烹调方法对野生蔬菜营养成分的影响[J].食品工业科技,2005,26(4):163-168.
[24]Anna A B,et al.Phenolic constituentslevels in cv.Agria potato under microwave processing[J].LWT-Food Science and Technology,2008,41(10):1919-1926.
[25]Carmen L B,et al.Effects of microwave cooking conditionson bioactive compounds present inbroccoli inflorescences[J].J Food Chem,2007,55(24):10001-10007.
[26]潘芳.超高压处理对糙米感官特性与营养特性的影响研究[D].杭洲:浙江大学,2017.
[27]刘坚.超高压对鹰嘴豆分离蛋白功能性质的影响[D].江苏无锡:江南大学,2007.
[28]李汴生.超高压处理蛋白质和多糖胶体特性的变化及其机理研究[D].广州:华南理工大学,1997.
[29]刘兴辰,等.超高压和高温短时处理对胡萝卜汁品质的影响[J].中国食品学报,2015,15(1):108-114.
[30]Jennifer K.McInerney,et al.Effects of high pressure processing on antioxidant activity,and total carotenoid content and availability,in vegetables[J].Innovative Food Science & Emerging Technologies,2007,8(4):543-548.
Identification of Plant Sterols in Chickpeas and Study on Biological Proximity
WANG Xiao-li 1,YUAN Yi-lin 1,LI Fei-fan 1,YANG Rui-nan 2,ZHANG Liang-xiao 2,MEI Xiao-hong 1
( 1 College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China; 2 Oil Crop Research Institute,Chinese Academy of Agricultural Sciences,Wuhan 430062,China)
Abstract:In order to investigate the content of phytosterols in chickpeas,an in vitro simulated digestion model was established to determine the biological proximity of phytosterols in chickpeas treated by different processing methods.The species,contents and existing forms were characterized by gas chromatography-mass chromatography(GC-MS).The effects of heat treatment,microwave treatment and ultra-high pressure treatment on phytosterol bioavailability in chickpea were studied by performing in vitro simulated digestion experiments.The results showed that chickpea mainly contained β-sitosterol(1 003.87±6.27mg/kg)、campesterol(164.00±2.86mg/kg)、Δ5-avenasterol(100.46±0.93mg/kg)、stigmasterol(58.02±0.14mg/kg)、stigmastanol(20.26±0.16mg/kg)、Δ7-avenasterol(14.78±0.16mg/kg).Small amount of cholesterol(0.81±0.01mg/kg)and rapeseed sterol(0.73±0.01mg/kg)were also found in chickpea.The above phytosterols existed in free form.While heat treatment,microwave treatment and ultra-high pressure treatment led to the decrease of phytosterol bioavailability in chickpea at different levels.Studies have shown that the use of shorter time processing when eating chickpeas is beneficial to the biological proximity of plant sterols.
Keywords:chickpea;phytosterols;in vitro simulated digestion;bioavailability
(責任编辑 唐建敏)B0D68CF5-9604-4A1B-A44A-F795F3CCB89B
