广东沿海地区凡纳滨对虾EHP、VPAHPND和SHIV感染情况调查与分析
2019-09-10孙卫芳黄小帅胡晓娟文国樑曹煜成张建设
孙卫芳 黄小帅 胡晓娟 文国樑 曹煜成 张建设




摘要:【目的】掌握廣东沿海对虾主养区虾肝肠胞虫(EHP)、急性肝胰腺坏死病致病性副溶血弧菌(VPAHPND)和虾血细胞虹彩病毒(SHIV)3种病原的流行趋势及特点,为广东省对虾养殖业的病害防控提供参考依据。【方法】建立针对EHP、VPAHPND和SHIV的PCR检测方法,在广东茂名和汕尾两地区采集凡纳滨对虾样品检测EHP、VPAHPND和SHIV 3种病原,并针对生长缓慢或个体规格差异明显的部分养殖凡纳滨对虾进行病原感染情况调查。【结果】广东茂名地区凡纳滨对虾幼虾的EHP、VPAHPND和SHIV携带率分别为20.24%、2.38%和9.52%,汕尾地区凡纳滨对虾幼虾的EHP、VPAHPND和SHIV携带率分别为26.98%、4.76%和42.86%。根据养殖模式划分,土塘养殖凡纳滨对虾幼虾以携带EHP为主,携带率高达40.48%;高位池养殖凡纳滨对虾幼虾主要感染SHIV,携带率为29.27%;工厂化池塘中,凡纳滨对虾幼虾的EHP和SHIV携带率较高,分别为21.88%和23.44%。池塘水、水源水、虾苗及丰年虫等养殖要素均能检出病原,其中池塘水和水源水中EHP和SHIV的检出率较高。对个体规格差异明显的患病凡纳滨对虾群体进行检测,结果发现大、小规格样品的EHP感染率分别为30.00%和80.00%;在表现生长缓慢的患病凡纳滨对虾群体中,大、小规格幼虾样品的EHP携带率分别为95.00%和100.00%。【结论】广东沿海地区养殖凡纳滨对虾的EHP和SHIV携带率较高、流行趋势明显,而VPAHPND检出率较低、流行趋势不明显。养殖水体是EHP、VPAHPND和SHIV的重要传播媒介,生物饵料也是养殖过程中病原传播的源头。因此,在实际生产中应根据养殖凡纳滨对虾的病原流行特点,尤其针对EHP和SHIV高携带率的现象,从病原、宿主和环境三方面同时着手进行防控,采取综合防控措施减少病害发生。
关键词: 凡纳滨对虾;虾肝肠胞虫(EHP);AHPND致病性副溶血弧菌(VPAHPND);虹彩病毒(SHIV);携带率
中图分类号: S945.46 文献标志码: A 文章编号:2095-1191(2019)10-2343-07
Detection and analysis of Enterocytozoon hepatopenaei(EHP), Vibrio parahaemolyticus acute hepatopancreatic necrosis disease(VPAHPND) and shrimp hemocyte iridescent virus(SHIV) from Litopenaeus vannamei in coastal areas of Guangdong Province
SUN Wei-fang1,2, HUANG Xiao-shuai2, HU Xiao-juan2, WEN Guo-liang1,2*,
CAO Yu-cheng2*, ZHANG Jian-she1
(1Zhejiang Ocean University/National Engineering Research Center for Facilitated Marine Aquaculture, Zhoushan, Zhejiang 316022, China; 2South China Sea Fisheries Research Institute, Chinese Academy Fishery Sciences/Guangdong Provincial Key Laboratory of Fishery Ecology and Environment/Key Laboratory for Exploitation & Utilization of Marine Fisheries Resource in South China Sea,Ministry of Agriculture and Rural Affairs, Guangzhou 510300, China)
Abstract:【Objective】The aims of the study were to detect and analyze the infections of Enterocytozoon hepatopenaei(EHP), Vibrio parahaemolyticus acute hepatopancreatic necrosis disease(VPAHPND) and shrimp hemocyte iridescent virus(SHIV) from Litopenaeus vannamei in coastal areas of Guangdong Province and to provide data reference for prevention and control for diseases in shrimp aquaculture in Guangdong. 【Method】The PCR amplification methods were established to estimate the distribution of EHP, VPAHPND and SHIV. The samples from L. vannameiculture areas in Maoming and Shanwei, Guangdong were collected for EHP, VPAHPND and SHIV infection investigation. Pathogen infection was investigated on L. vannamei with slow growth or obvious individual body size difference. 【Result】The positive ratios of EHP, VPAHPND and SHIV of juvenile L. vannameiin Maoming were 20.24%, 2.38% and 9.52%, respectively,while that were 26.98%, 4.76% and 42.86% for EHP, VPAHPND and SHIV in Shanwei, respectively. Different aquaculture modes had varying pathogen distributions. EHP was the main pathogen in earthen pond, with a positive ratio of 40.48%. While SHIV was the main pathogen in pond above sea level, with a positive ratio of 29.27%. In industrial aquaculture pond, both EHP and SHIV showed high levels of positive ratio, which were 21.88% and 23.44%, respectively. Inaddition, aquaculture elements, such as pond water, source water, post-larvae and Artemia, could carry the pathogen. Furthermore, both the pond and source water showed high positive ratios of EHP and SHIV. In the L. vannamei population showing irregular size, EHP positive ratios were 30.00% and 80.00% in big size group and small size group, respectively. For L. vannamei population with stagnation problem, both big size and small size group showed high levels of EHP positive ratios(95.00% and 100%, respectively). 【Conclusion】In coastal areas of Guangdong,both EHP and SHIV show high positive ratios in L. vannamei, which indicates high risk of disease outbreaks. While the positive ratio of VPAHPND is relatively low. Aquaculture water may serve as the important vehicle for pathogen transmission for EHP, VPAHPND and SHIV.In addition, live baits are also potential vehicle for pathogen transmission in aquaculture pond. Therefore, the breeding of L. vannamei should be based on the prevalence of pathogens in the aquaculture, especially for the high positive ratios of EHP and SHIV.A comprehensive strategy involving pathogen, host and environment should be used for disease prevention and control.
Key words: Litopenaeus vannamei; Enterocytozoon hepatopenaei(EHP); Vibrio parahaemolyticus acute hepatopancreatic necrosis disease(VPAHPND); Shrimp hemocyte iridescent virus(SHIV); positive ratios
0 引言
【研究意义】凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,原产于中南美洲太平洋沿岸水域,因具有抗逆性强、易养殖及生长快等特点,自1988年引入我国后迅速遍及全国,现已成为我国水产养殖的主导品种之一(王兴强等,2004)。随着水产养殖规模的不断扩大,凡纳滨对虾养殖环境恶化及养殖模式不规范等问题日益突出,导致其病害频发,给我国的对虾养殖业带来巨大损失(王丽花等,2012;文国樑等,2015;Qiu et al.,2017)。因此,迫切需要对主产区养殖对虾进行病原检测,并监控病原流行趋势,以确保对虾病害得到有效防控及促进对虾产业健康发展。【前人研究进展】当前,我国养殖对虾病原感染呈多样化,多种病原体(病毒、细菌及其他微生物等)均能诱发疾病(童桂香,2013;张小明等,2017;曹煜成等,2018)。自20世纪90年代对虾白斑综合征病毒病(White spot syndrome,WSS)在亚洲暴发以来,给全球的对虾养殖业带来巨大经济损失,全球养殖对虾产量因此大幅削减近50%(曹煜成等,2014)。近年来,随着对虾生物防控技术的推广应用使对虾白斑综合征得到有效控制,但虾肝肠胞虫(Enterocytozoon hepatopenaei,EHP)、急性肝胰腺坏死(Acute hepatopancreatic necrosis disease,AHPND)、虾血细胞虹彩病毒(Shrimp hemocyte iridescent virus,SHIV)等多种病害的暴发给当前对虾养殖业带来新的严峻挑战(董小林等,2018;蒋葛等,2019)。其中,EHP是2009年在泰国生长缓慢的养殖斑节对虾中首次发现并命名,其主要寄生在肝胰腺组织,是导致对虾生长缓慢的重要因素之一(Prasertsri et al.,2009;Amornrat et al.,2013)。AHPND于2010年起在越南、马来西亚及我国南方对虾养殖地区出现,其病原菌主要为AHPND致病性副溶血弧菌(Vibrio parahaemolyticus AHPND,VPAHPND),能引起养殖对虾大批量死亡(唐小千等,2016;Aranguren et al.,2017;贾丹等,2018)。Qiu等(2017)从凡纳滨对虾中分离出一种新型虹彩病毒,命名为SHIV,并证实该病毒能引发对虾肝胰腺萎缩、褪色,以及空肠和空胃等现象,继而导致对虾死亡(Xu et al.,2016)。【本研究切入点】据养殖户反映及相关检测报道显示,EHP、VPAHPND和SHIV在我国养殖凡纳滨对虾中已呈流行趋势(施慧等,2017;陈晓玲等,2018;郑晓叶等,2018),但至今鲜见针对这3种病原进行系统调查分析的研究报道。【拟解决的关键问题】在广东茂名和汕尾两地采集凡纳滨对虾样品检测EHP、VPAHPND和SHIV,并针对生长缓慢或个体规格差异明显的部分养殖凡纳滨对虾进行病原感染情况调查,旨在掌握广东沿海对虾主养区这3种病原的流行趋势及特点,为广东省对虾养殖业的病害防控提供参考依据。
1 材料与方法
1. 1 试验材料
2017—2018年从广东省茂名市和汕尾市对虾养殖主产区的土塘、高位池及工厂化养殖池塘采集凡纳滨对虾幼虾样品进行特定病原感染情况调查,同时收集虾苗、池塘水、水源水和丰年虫饵料等养殖要素进行病原检测,了解病原的传播特点。此外,于2018年6月采样检测汕尾市陆丰德泰丰养殖场工厂化养殖车间表现滞长(生长缓慢)的患病幼虾(养殖周期41 d);于2018年8月采樣检测茂名市广东冠利海洋生物有限责任公司工厂化养殖车间个体规格差异明显的患病幼虾(养殖周期25 d)。幼虾、虾苗和丰年虫样品经冷冻后低温运输至实验室,-20 ℃保存备用;池塘水和水源水经低温运输至实验室后于4 ℃短期保存备用。
1. 2 DNA提取
1. 2. 1 基因组DNA提取 幼虾、虾苗和丰年虫样品参照E.Z.N.A. Tissue DNA Kit(OOMEGA Bio Tek)试剂盒说明提取基因组DNA。其中,幼虾样品经解剖后剪取约30 mg肝胰腺组织,虾苗样品取整个虾体,丰年虫称取约30 mg样品。各样品分别进行研磨及后续试验。采用1%琼脂糖凝胶电泳检测DNA完整性,以NanoDrop 2000紫外分光光度计(NanoDrop Technologies)测定DNA浓度,-80 ℃保存备用。
1. 2. 2 水样DNA提取 池塘水和水源水样品经0.2 μm滤膜(Millipore)过滤,取过滤膜参照E.Z.N.A. Water DNA Kit试剂盒说明提取水体DNA。采用NanoDrop 2000紫外分光光度计测定DNA浓度, -80 ℃保存备用。
1. 3 生长指标测量
随机采集广东汕尾和茂名工厂化池塘中出现生长相关问题的凡纳滨对虾幼虾样品,用电子天平(精确到0.01 g)测量虾体质量,测量时吸干虾体表面水分。每个池塘的凡纳滨对虾样品依据体质量大小选取最大的20尾和最小的20尾,分别组成大规格组和小规格组。每组个体的基因组DNA参照1.2.1的方法进行提取。
1. 4 病原检测
1. 4. 1 病原DNA片段扩增引物 根据相关文献报道,分别设计病原EHP、VPAHPND和SHIV的DNA片段扩增引物对EHP-F/EHP-R、VPAHPND-F/VPAHPND-R和SHIV-F/SHIV-R,引物序列详见表1。
1. 4. 2 标准品DNA制备 利用pEASY®-T1 Clo-ning Kit(Transgen)将目的产物连接至大肠杆菌Trans1-T1感受态细胞(TransGen公司),利用蓝白斑筛选并挑取阳性克隆送至生工生物工程(上海)股份有限公司进行测序验证。验证后的阳性菌落经扩大培养,用质粒提取试剂盒[生工生物工程(上海)股份有限公司]提取质粒DNA,以NanoDrop 2000紫外分光光度計测定DNA浓度,经拷贝数换算后稀释至1×106拷贝/μL作为标准品DNA,-80 ℃保存备用。
1. 4. 3 PCR扩增 分别以EHP、VPAHPND和SHIV 3种病原检测结果呈阳性的样品DNA为模板,用上述设计的引物对进行常规PCR扩增。PCR反应体系15.0 μL:基因组DNA模板(100 ng/μL)1.0 μL,Premix TaqTM Mix(TaKaRa公司)7.5 μL,上、下游引物(10 μmol/L)各0.5 μL,ddH2O 5.5 μL。扩增程序:95 ℃预变性3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 35 s,进行32个循环;72 ℃延伸6 min。4 ℃保存扩增产物。分别以各病原的标准品DNA和无菌水作为阳性对照和阴性对照,采用1%琼脂糖凝胶电泳进行检测,并选取部分阳性样品扩增产物送至生工生物工程(上海)股份有限公司进行测序验证。
2 结果与分析
2. 1 EHP、VPAHPND和SHIV的PCR检测结果
EHP、VPAHPND和SHIV的PCR检测结果如图1所示。阳性对照以制备的标准品DNA为模板进行PCR扩增,结果发现3种病原分别扩增得到185、700和457 bp的阳性克隆片段,而以无菌水为模板的阴性对照未获得对应的扩增条带。在部分检测样品中,出现与阳性对照克隆片段大小一致的阳性条带,表明此样品携带该特定病原。将阳性PCR扩增产物送至生工生物工程(上海)股份有限公司测序,得到的产物序列和对应的病原序列一致。
2. 2 不同地区养殖凡纳滨对虾的病原感染情况
2017—2018年,从茂名收集凡纳滨对虾幼虾样品共84份,从汕尾收集凡纳滨对虾幼虾样品63份,其病原检测结果如表2所示。茂名地区养殖凡纳滨对虾幼虾的EHP、VPAHPND和SHIV阳性数分别为17、2和8份,对应的携带率分别为20.24%、2.38%和9.52%;汕尾地区养殖凡纳滨对虾幼虾的EHP、VPAHPND和SHIV阳性数分别为17、3和27份,对应的携带率分别为26.98%、4.76%和42.86%。
2. 3 不同养殖模式下凡纳滨对虾的病原感染情况
根据养殖模式划分,共收集土塘养殖凡纳滨对虾幼虾样品42份、高位池养殖凡纳滨对虾幼虾样品41份和工厂化池塘养殖凡纳滨对虾幼虾样品64份。由表3可知,土塘幼虾样品以携带EHP为主,携带率为40.48%,其次为SHIV(携带率为19.05%),幼虾感染VPAHPND的比例较低,仅4.76%。相比之下,高位池养殖对虾感染EHP的比例较低,为7.32%,且未发现VPAHPND阳性幼虾样品。在工厂化池塘中,对虾的EHP和SHIV携带率接近,分别为21.88%和23.44%,VPAHPND的携带率较低,为4.69%。
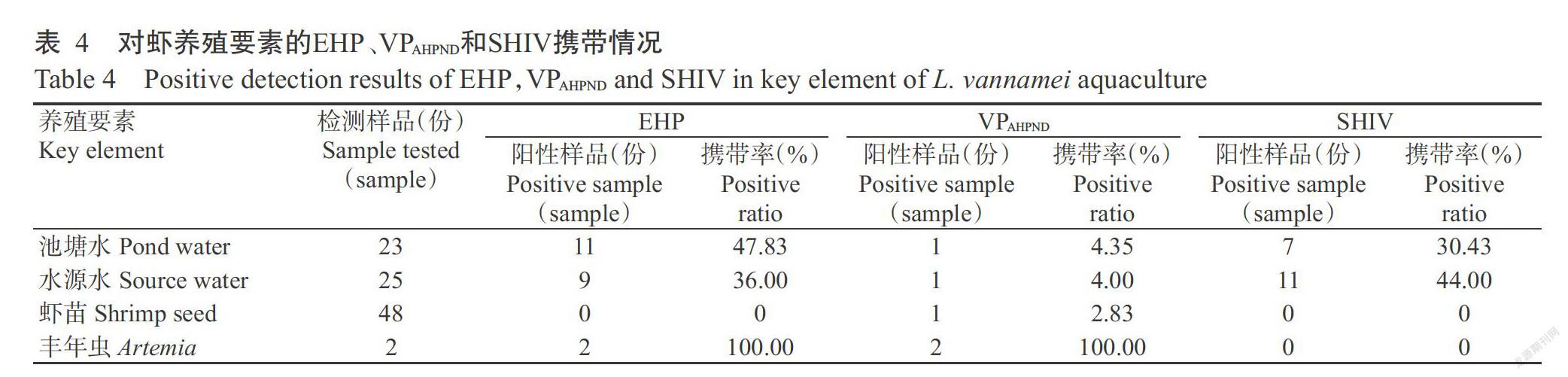
2. 4 各养殖要素的病原携带情况
由表4可看出,从池塘水、水源水、虾苗及丰年虫等养殖要素中均能检出病原。虾苗的病原检出率最低,仅检测到VPAHPND(携带率为2.83%)。池塘水和水源水中EHP和SHIV检出率较高,EHP携带率分别为47.83%和36.00%,SHIV携带率分别为30.43%和44.00%,且水源水的SHIV阳性样品均来自汕尾地区;但VPAHPND携带率较低,池塘水和水源水的对应携带率分别为4.35%和4.00%。丰年虫样品仅收集2份进行检测,结果显示,2份样品均携带EHP和VPAHPND,但未检出SHIV。
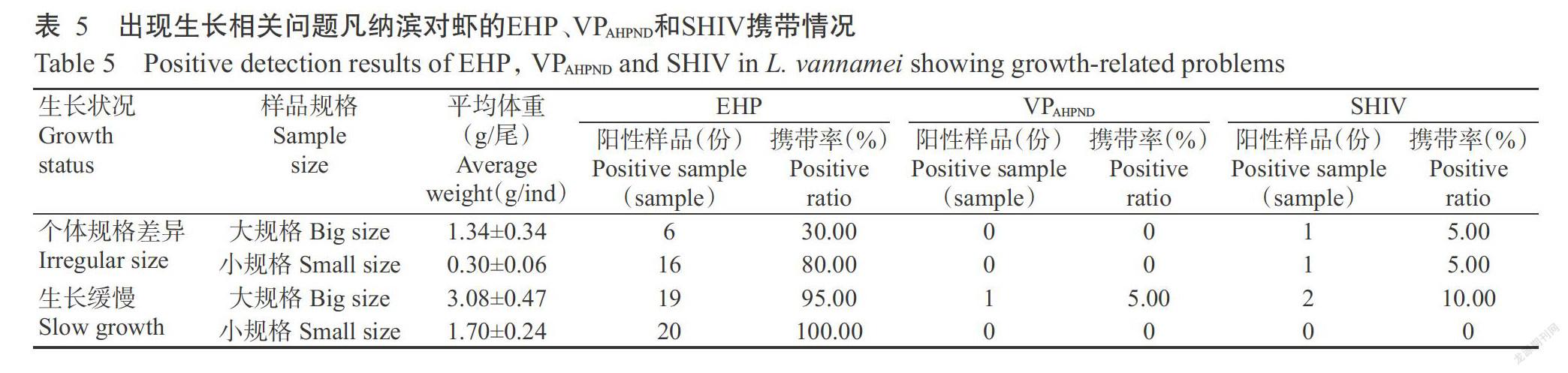
2. 5 出现生长相关问题养殖凡纳滨对虾的病原检测结果
采自茂名工厂化车间的凡纳滨对虾幼虾表现为个体规格差异明显,大、小规格幼虾样品的平均体重分别为1.34±0.34和0.30±0.06 g/尾,其病原检测结果(表5)显示,大、小规格幼虾样品中EHP携带率分别为30.00%和80.00%,SHIV携带率均为5.00%,但不携带VPAHPND。采自汕尾地区工厂化车间的凡纳滨对虾幼虾表现为生长缓慢,大、小规格幼虾样品中EHP携带率分别为95.00%和100.00%,大规格幼虾样品中携带VPAHPND和SHIV的阳性样品分别有1和2份,而小规格幼虾样品均不携带VPAHPND和SHIV。
3 讨论
3. 1 广东沿海地区凡纳滨对虾EHP、VPAHPND和SHIV的流行特点
本研究对2017—2018年广东沿海地区养殖凡纳滨对虾及部分养殖要素感染EHP、VPAHPND和SHIV的情况进行调查分析,结果发现以茂名和汕尾为代表的养殖主产区均发现有EHP、VPAHPND和SHIV分布,但流行程度因地区及养殖模式差异而有所不同。总体而言,两个地区及不同养殖模式下EHP和SHIV的携带率较高、流行趋势明显,而VPAHPND的检出率较低、流行趋势不明显。汕尾地区3种病原的阳性样本检出率高于茂名地区,尤其是养殖凡纳滨对虾SHIV携带率表现为汕尾地区远高于茂名地区;不同养殖模式下,高位池养殖凡纳滨对虾SHIV携带率最高,但EHP和VPAHPND的携带率低于土塘和工厂化池塘养殖凡纳滨对虾。本研究采集到的茂名地区凡纳滨对虾幼虾样本主要来源于土塘和工厂化池塘,而汕尾地区凡纳滨对虾幼虾样本主要来源于高位池和工厂化池塘,可能是影响两地区养殖对虾病原携带情况差异的主要因素。从养殖要素的病原检测结果来看,水源水中的SHIV携带率达44.00%,且检出的11份阳性样品均来自汕尾地区水源水,故推测汕尾地区及高位池模式下凡纳滨对虾幼虾流行感染SHIV与养殖水源水的SHIV污染存在关联。
3. 2 病原EHP、VPAHPND和SHIV的传播因素分析
养殖水体是EHP、VPAHPND和SHIV的主要传播媒介,养殖凡纳滨对虾EHP和SHIV的高携带率与水样中2种病原的高携带率可能存在关联。在虾苗样品中,3种病原的检测结果显示仅有1份VPAHPND阳性样品,但并不能完全排除虾苗不携带EHP和SHIV。由于单重PCR病原检测的灵敏度介于组织镜检方法与巢式PCR、LAMP等检测方法之间,当样品中病原核酸含量低于1000拷贝/mL时,病原不易被检出(刘珍等,2016)。丰年虫是水产养殖中常见的饵料生物,因其能携带病原,也是水产病害发生的重要传播媒介(邓灯等,2004)。本研究在丰年虫中检测到EHP和VPAHPND,表明生物饵料可能是养殖过程多种病原的传播媒介。
3. 3 养殖凡纳滨对虾出现生长相关问题的致病因素分析
EHP感染易引起对虾生长缓慢,为探究养殖凡纳滨对虾生长出现个体规格差异及生长缓慢等问题的致病因素,本研究分别对茂名和汕尾地区患病凡纳滨对虾的EHP、VPAHPND和SHIV携带情况进行检测,结果表明,在茂名地区个体规格差异明显的养殖凡纳滨对虾中,小规格对虾的EHP携带率(80.00%)远高于大规格对虾(30.00%);在汕尾地区生长缓慢的养殖凡纳滨对虾中,大、小规格对虾的EHP携带率接近100.00%。表明养殖凡纳滨对虾感染EHP可能是导致对虾生长缓慢及个体规格差异的重要因素,与Biju等(2016)、施慧等(2017)的研究结果一致。在大、小规格凡纳滨对虾中,VPAHPND和SHIV携带率均较低或未检出,且未发现养殖凡纳滨对虾出现VPAHPND、SHIV感染与EHP感染的显著相关性,但Aranguren等(2017)研究发现凡纳滨对虾感染EHP后易暴发AHPND,因此今后有必要针对不同病原的共感染情况进行深入调查分析。
3. 4 广东沿海地区养殖凡纳滨对虾病原感染的防控措施
本研究结果表明,EHP和SHIV在广东沿海地区养殖凡纳滨对虾中流行趋势明显,或有暴发大规模疫病的可能。SHIV能引发患病对虾的高死亡率(Xu et al.,2016),EHP虽不导致对虾死亡,但能致使对虾出现明显的生长变缓现象(Biju et al.,2016),二者暴发流行均会严重影响对虾养殖业的健康发展。目前引发EHP和SHIV感染的原因尚不明确,且应对病害发生尚无有效的治疗方法。因此,针对EHP和SHIV高携带率的现象,应从病原、宿主和环境三方面同时着手进行防控(耿小雪等,2016;王善龙等,2016)。此外,在养殖过程中应积极开展病原监测工作,掌握病原感染的分布特点及发生规律,采取综合防控措施减少病害发生,确保凡纳滨对虾养殖业的可持续发展。
4 结论
广东沿海地区养殖凡纳滨对虾EHP和SHIV携带率较高、流行趋势明显,而VPAHPND检出率较低、流行趋势不明显。养殖水体是EHP、VPAHPND和SHIV的重要传播媒介,生物饵料也是养殖过程中病原传播的源头。因此,在实际生产中应根据养殖凡纳滨对虾的病原流行特点,尤其针对EHP和SHIV高携带率的现象,从病原、宿主和环境三方面同时着手进行防控,采取综合防控措施减少病害发生。
参考文献:
曹煜成,文国樑,李卓佳. 2014. 南美白对虾高效养殖与疾病防治技术[M]. 北京:化学工业出版社. [Cao Y C,Wen G L,Li Z J. 2014. Efficient farming and disease control technology of Litopenaeus vannamei[M]. Beijing:Che-mical Industry Press.]
曹煜成,徐煜,黄小帅,胡晓娟,李卓佳,李凡,陈勇贵,文国樑. 2018. 铜绿微囊藻对WSSV潜伏感染对虾的致死效应[J]. 南方农业学报,49(8):1648-1653. [Cao Y C,Xu Y,Huang X S,Hu X J,Li Z J,Li F,Chen Y G,Wen G L. 2018. Lethal effects of Microcystis aeruginosa to Litopenaeus vannamei infected by WSSV[J]. Journal of Sou-thern Agriculture,49(8):1648-1653.]
陈晓玲,王君霞,邱亮,许拉,朱文博. 2018. 日照地区中国明对虾急性肝胰腺坏死病(AHPND)的调查与分析[J]. 科学养鱼,(1):62-64. [Chen X L,Wang J X,Qiu L,Xu L,Zhu W B. 2018. Investigation and analysis of acute hepatopancreatic necrosis disease(AHPND) in Fenneropenaeus chinensis in Rizhao area[J]. Scientific Fish Farming,(1):62-64.]
邓灯,刘萍,孔杰. 2004. 卤虫在WSSV病毒病传播中的媒介作用[J]. 海洋水产研究,25(5):35-41. [Deng D,Liu P,Kong J. 2004. Artemia sp. works as a possible vector in the transmission of WSSV[J]. Marine Fisheries Research,25(5):35-41.]
董小林,趙敏,陈家林,刘家寿,钱雪桥. 2018. 微生态制剂在对虾病害防控中的应用开发进展[J]. 水产科学,37(1):133-139. [Dong X L,Zhao M,Chen J L,Liu J S,Qian X Q. 2018. Application and development of probiotics in prevention and control of shrimp diseases[J]. Fisheries Science,37(1):133-139.]
耿小雪,周怡,徐玮,张文兵,麦康森. 2016. 饲料中添加Fortilin蛋白对凡纳滨对虾免疫反应和抗白斑综合征病毒感染的影响[J]. 中国海洋大学学报,46(10):32-38. [Geng X X,Zhou Y,Xu W,Zhang W B,Mai K S. 2016. Effect of dietary fortilin on immune response of white shrimp Litopenaeus vannamei and its resistance against white spot syndrome virus infection[J]. Periodical of Ocean University of China,46(10):32-38.]
賈丹,史成银,黄倢,张庆利,万晓媛,许华,刘冉阳,王海波,郭程程,谢国驷. 2018. 凡纳滨对虾急性肝胰腺坏死病(AHPND)病原分离鉴定及其致病性分析[J]. 渔业科学进展,39(3):103-111. [Jia D,Shi C Y,Huang J,Zhang Q L,Wan X Y,Xu H,Liu R Y,Wang H B,Guo C C,Xie G S. 2018. Identification and pathogenicity analysis of bacterial pathogen associated with acute hepatopancrea-tic necrosis disease(AHPND) in the Pacific shrimp Litopenaeus vannamei[J]. Progress in Fishery Sciences,39(3):103-111.]
蒋葛,沈辉,万夕和,乔毅,黎慧,王李宝,史文军. 2019. 凡纳滨对虾急性肝胰腺坏死综合症病虾与健康虾肠道优势菌群比较分析[J]. 江苏农业学报,35(1):142-148. [Jiang G,Shen H,Wan X H,Qiao Y,Li H,Wang L B,Shi W J. 2019. Difference analysis of intestinal flora between healthy Litopenaeus vannamei and acute hepatopancreatic necrosis syndrome L. vannamei[J]. Jiangsu Journal of Agricultural Sciences,35(1):142-148.]
刘珍,张庆利,万晓媛,马芳,黄倢. 2016. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测[J]. 渔业科学进展,37(2):119-126. [Liu Z,Zhang Q L,Wan X Y,Ma F,Huang J. 2016. Development of real-time PCR assay for detecting microsporidian Enterocytozoon hepatopenaei and the app-lication in shrimp samples with different growth rates[J]. Progress in Fishery Sciences,37(2):119-126.]
施慧,许文军,谢建军,王庚申. 2017. 舟山地区大棚凡纳滨对虾生长缓慢病因的调查分析[J]. 中国水产科学,24(2):387-394. [Shi H,Xu W J,Xie J J,Wang G S. 2017. Pathogenicity of Penaeus vannamei slow growth syndrome in intensively cultured penaeid shrimp in Zhoushan[J]. Journal of Fishery Sciences of China,24(2):387-394.]
唐小千,徐洪森,战文斌. 2016. 对虾急性肝胰腺坏死综合症研究进展[J]. 海洋湖沼通报,(2):90-93. [Tang X Q,Xu H S,Zhan W B. 2016. Advances in study of shrimp acute hepatopancreas necrosis syndrome[J]. Transactions of Oceanology and Limnology,(2):90-93.]
童桂香,韦信贤,吴伟军,吴祥庆,黄国秋,黄玉柳,叶欣宇,黎小正. 2013. 广西凡纳滨对虾IHHNV感染情况的调查与分析[J]. 南方农业学报,44(12):2089-2093. [Tong G X,Wei X X,Wu W J,Wu X Q,Huang G Q,Huang Y L,Ye X Y,Li X Z. 2013. Investigation and analysis of infectious hypodermal and hematopoietic necrosis virus infection in Penaeus vannamei in Guangxi[J]. Journal of Southern Agriculture,44(12):2089-2093.]
王丽花,曹煜成,李卓佳. 2012. 溶藻细菌控藻作用及其在对虾养殖池塘的应用前景[J]. 南方水产科学,8(4):76-82. [Wang L H,Cao Y C,Li Z J. 2012. Algae-constraining effect of algae-lysing bacteria and its application prospect in shrimp ponds[J]. South China Fisheries Science,8(4):76-82.]
王娜,王海亮,白楠,黄倢,谢达祥,谢起浪,於俊琦,万夕和. 2016. 副溶血弧菌(Vibrio parahaemolyticus)中溶源噬菌体与其宿主菌致病力的相关性[J]. 渔业科学进展,37(2):106-110. [Wang N,Wang H L,Bai N,Huang J,Xie D X,Xie Q L,Yu J Q,Wan X H. 2016. Isolation of lysogenic phage in Vibrio parahaemolyticus and its relationship with the pathogenicity of the host bacteria[J]. Pro-gress in Fishery Sciences,37(2):106-110.]
王善龙,曹煜成,胡晓娟,徐煜,李卓佳,吴垠. 2016. 蜡样芽孢杆菌对对虾养殖水体微藻群落的调控研究[J]. 南方水产科学,12(1):9-16. [Wang S L,Cao Y C,Hu X J,Xu Y,Li Z J,Wu Y. 2016. Regulation of Bacillus cereus to microalgae community in shrimp aquaculture water[J]. South China Fisheries Science,12(1):9-16.]
王兴强,马甡,董双林. 2004. 凡纳滨对虾生物学及养殖生态学研究进展[J]. 海洋湖沼通报,(4):94-100. [Wang X Q,Ma S,Dong S L. 2004. Studies on the biology and cultural ecology of Litopenaeus vannamei:A review[J]. Transactions of Oceanology and Limnology,(4):94-100.]
文国樑,曹煜成,徐煜,胡晓娟,徐武杰,李卓佳. 2015. 养殖对虾肝胰腺坏死综合症研究进展[J]. 广东农业科学,42(11):118-123. [Wen G L,Cao Y C,Xu Y,Hu X J,Xu W J,Li Z J. 2015. Review on hepatopancreas necrosis syndrome of shrimp[J]. Guangdong Agricultural Sciences,42(11):118-123.]
张小明,崔文耀,丁少青,李伟明,张庆华. 2017. 一株凡纳滨对虾源维氏气单胞菌的分离鉴定及药敏特性[J]. 微生物学通报,44(12):2795-2804. [Zhang X M,Cui W Y,Ding S Q,Li W M,Zhang Q H. 2017. Isolation,identification and antibiotic sensitivity of Aeromonas veronii from Litopenaeus vannamei[J]. Microbiology China,44(12):2795-2804.
郑晓叶,许俊榆,郑天伦,朱凝瑜,曹飞飞. 2018. 浙江省南美白对虾苗种五种流行病病原检测与分析[J]. 中国动物检疫,35(8):17-22. [Zheng X Y,Xu J Y,Zheng T L,Zhu N Y,Cao F F. 2018. Detection and analysis on five kinds of pathogens in white shrimp(Penaeus vannamei) in Zhejiang Province[J]. China Animal Health Inspection,35(8):17-22.]
Amornrat T,Srisala J,Chouwdee S,Somboon M,Chuchird N,Limsuwan C,Srisuvan T,Flegel T W,Sritunyalucksana K. 2013. The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus(Litopenaeus) vannamei[J]. BMC Veterinary Research,9(1):139. doi:10.1186/1746-6148-9-139.
Aranguren L F,Han J E,Tang K F J. 2017. Enterocytozoon hepatopenaei(EHP) is a risk factor for acute hepatopancreatic necrosis disease(AHPND) and septic hepatopanc-reatic necrosis(SHPN) in the Pacific white shrimp Penaeus vannamei[J]. Aquaculture,471:37-42.
Biju N,Sathiyaraj G,Raj M,Shanmugam V,Baskaran B,Go-vindan U,Kumaresan G,Kasthuriraju K K,Chellamma T S. 2016. High prevalence of Enterocytozoon hepatopenaei in shrimps Penaeus monodon and Litopenaeus vannamei sampled from slow growth ponds in India[J]. Di-seases of Aquatic Organisms,120(3):225-230.
Prasertsri S,Limsuwan C,Chuchird N. 2009. The effects of microsporidian(Thelohania) infection on the growth and histopathological changes in pond-reared Pacific white shrimp(Litopenaeus vannamei)[J]. Kasetsart Journal(Na-tural Science),43(4):680-688.
Qiu L,Chen M M,Wan X Y,Li C,Zhang Q L,Wang R Y,Cheng D Y,Dong X,Yang B,Wang X H,Xiang J H,Huang J. 2017. Characterization of a new member of Iridoviridae,Shrimp hemocyte iridescent virus(SHIV),found in white leg shrimp(Litopenaeus vannamei)[J]. Scienti-fic Reports,7:11834. doi: 10.1038/s41598-017-10738-8.
Xu L,Wang T,Li F,Yang F. 2016. Isolation and preliminary characterization of a new pathogenic iridovirus from redclaw crayfish Cherax quadricarinatus[J]. Diseases of Aquatic Organisms,120(1):17-26.
(責任编辑 兰宗宝)
