不同螯合剂强化青葙修复土壤镉污染的效应
2019-09-10蒋萍萍俞果姚诗音刘杰雷玲游少鸿陈喆程艳
蒋萍萍 俞果 姚诗音 刘杰 雷玲 游少鸿 陈喆 程艳

摘要:【目的】研究6種螯合剂对土壤可提取态镉(Cd)含量及青葙吸收富集Cd的影响,筛选出青葙富集Cd的最佳螯合剂及其最佳浓度,为提高青葙对Cd污染土壤的修复能力提供理论参考。【方法】采用盆栽试验,以青葙为Cd修复植物,在总Cd含量为5.72 mg/kg、可提取态Cd含量为2.62 mg/kg的土壤中,分别加入浓度梯度为0(对照)、1.0、2.5、5.0、8.0和10.0 mmol/kg的6种螯合剂(苹果酸、柠檬酸、酒石酸、草酸、腐殖酸和EDTA),分析不同处理的土壤可提取态Cd含量、青葙生物量及青葙各部位对Cd的富集量。【结果】除腐殖酸外,加入不同浓度的螯合剂后,土壤可提取态Cd含量均高于对照组,加入10.0 mmol/kg柠檬酸时土壤可提取态Cd含量(3.18±0.29 mg/kg)最高,比对照组增加22.8%。在土壤中添加不同浓度的EDTA后,青葙幼苗干枯死亡;加入不同浓度的酒石酸、苹果酸、柠檬酸和草酸后,青葙根、茎、叶的Cd含量均有所增加,其中以5.0 mmol/kg柠檬酸处理青葙叶片中的Cd含量(143.00±14.60 mg/kg)最高,为对照组的2.74倍。添加5.0 mmol/kg的酒石酸、苹果酸、柠檬酸和草酸后,青葙根、茎、叶的生物量均低于对照组,其中柠檬酸和草酸处理对青葙生长的抑制作用较小,生物量较高,且该浓度下柠檬酸处理青葙对Cd的提取总量(0.199±0.006 mg/株)最高。【结论】不同螯合剂种类及浓度强化青葙修复土壤Cd污染的效应存在差异,其中以添加5.0 mmol/kg柠檬酸的螯合效果最佳。
关键词: 青葙;Cd污染;螯合剂;富集
中图分类号: S19;X53 文献标志码: A 文章编号:2095-1191(2019)11-2443-07
Remediation effects on cadmium contaminated soil by different chelating agents enhanced Celosia argentea Linn.
JIANG Ping-ping1,2, YU Guo1,2, YAO Shi-yin1, LIU Jie1,2*, LEI Ling1,2,
YOU Shao-hong1,2, CHEN Zhe1,2, CHENG Yan1,2
(1Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology, Guilin University of Technology,Guilin, Guangxi 541004, China; 2Guangxi Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area,Guilin University of Technology, Guilin, Guangxi 541004, China)
Abstract:【Objective】To find out the best chelator and chelating agent concentration for cadmium(Cd) bioaccumulation in Celosia argentea Linn. and provide reference for improving remediation of Cd contaminated soil by C. argentea, the effects of six chalating agents on the contents of extractable Cd in soil and adsorption and enrichment of Cd in C. argentea were studied. 【Method】The C. argentea was chosen as the repair plants, a pot experiment was conducted. The total Cd concentration and extractable cadmium concentration of the soil used in this study were 5.72 and 2.62 mg/kg,respectively. Six chelates(malic acid,citric acid,tartaric acid,oxalic acid,humic acid and EDTA) were added to the soil with a concentration gradient of 0(CK), 1.0,2.5,5.0,8.0 and 10.0 mmol/kg,respectively. Under different treatment conditions, the soil extractable Cd concentration,biomass in C. argentea and the Cd accumulation in different parts of C. argentea was analyzed. 【Result】The soil extractable Cd concentrations of all chelates treatment groups except the humic acid treatment group were higher than that of the control group. The soil extractable Cd concentration was the highest(3.18±0.29 mg/kg) when adding 10.0 mmol/kg of citric acid to the soil,which increased by 22.8% compared to the control group. After adding different concentrations of EDTA,all the seedlings of C. argentea died. After adding different concentrations of tartaric acid, malic acid, citric acid and oxalic acid, the Cd contents in the roots, stems and leaves of C. argentea were increased. The Cd concentration in leaves of C. argentea reached the highest(143.00±14.60 mg/kg) when adding 5.0 mmol/kg of citric acid,which was as 2.74 times as that of the control group. After adding 5.0 mmol/kg tartaric acid, malic acid, citric acid and oxalic acid,the biomass of the roots,stems and leaves of the C.argentea was lower than the control group. Under this treatment, the plants treated by citric acid and oxalic acid had less inhibitory effects on the growth of C. argentea, but it had the higher biomass. Besides, the total amount of Cd extracted in citric acid treatment was the highest(0.199±0.006 mg/plant). 【Conclusion】It can be concluded that the different types and concentrations of chelating agents on repairing soil Cd pollution by C. argentea are different, adding 5.0 mmol/kg citric acid has the best chelating effect.
Key words: Celosia argentea Linn.; Cd contamination; chelate; accumulation
0 引言
【研究意义】镉(Cd)作为生物功能非必需微量金属元素,对植物和动物具有较强毒性作用(Zhang et al.,2010),在环境质量和健康方面已受到高度关注(姚诗音等,2017)。据环境保护部和国土资源部2014年发布的全国土壤污染状况调查公报显示,Cd的点位超标率达7.0%。Cd主要通过工业活动、人类活动和大气沉降等途径进入土壤环境中,降低土壤质量及农产品质量,最终影响人类健康(罗慧等,2018;赵青青等,2018)。因此,如何有效减少土壤中的Cd含量,对于提高农产品质量、改善环境质量及提高人类健康水平均具有重要意义。【前人研究进展】植物修复技术是一种可行的重金属修复方法,不会影响表层土壤性质,不仅可保存土壤的可利用性和肥力,还能通过输入有机质增加土壤肥力(Mench et al.,2009;Ali et al.,2013)。但植物修复技术具有植物生长缓慢、修复时间长等缺点(李玉宝等,2017),如何提高修复效率是技术重点。植物根系对重金属的可利用性是限制植物提取效率的关键因素(Evangelou et al.,2007),受许多土壤因素的影响,如阳离子交换能力、pH及有机质含量等(Schmidt,2003),通过提高土壤重金属的可利用性可提高植物对重金属的富集效果(Tahmasbian and Sinegani,2014)。一般而言,与固相重金属相比,水溶态重金属更易被植物根系吸收利用。有研究表明,螯合剂可活化溶出土壤中的重金属,增加植物对重金属的可利用性(Schmidt,2003;陈良华等,2016)。常用的螯合剂有人工合成螯合剂(EDTA和DTPA等)和天然低分子有机酸(苹果酸、草酸和柠檬酸等)(丁竹红等,2009)。张敬锁等(1999)研究表明,柠檬酸和苹果酸可与Cd在土壤中形成复合物,但该复合物不影响植物的吸收,因此增加了Cd在植物体内的运输及Cd在植物(小麦)地上部的含量。赵雨森等(2010)研究了土壤中添加不同浓度的草酸和柠檬酸对土壤活化Cd和铅(Pb)的影响,发现在添加浓度为5 mmol/kg时,草酸和柠檬酸对土壤Cd和Pb的活化效果最佳。EDTA是一种强螯合剂,尽管具有毒性,但由于其对重金属有较强的络合能力,因此仍是土壤修复优选的螯合剂之一(Chaturvedi et al.,2015)。Ebbs和Kochian(1998)发现在土壤中添加EDTA后,印度芥菜对锌(Zn)的吸收量可增加2~4倍。陈良华等(2016)研究发现,土壤中添加0.25 mmol/kg的EDTA可显著增加土壤Cd的生物有效性,促进Cd在香樟幼苗各器官中的积累。【本研究切入点】本课题组在前期研究中发现,苋科青葙属一年生草本植物青葙(Celosia argentea Linn)不但对锰(Mn)具有超富集能力(Liu et al.,2014),对Cd也具有较高的耐受和富集能力,是一种潜在的Cd超富集植物(姚诗音等,2017),但目前尚不清楚能否通过增加低分子有机酸和EDTA等螯合剂来提高青葙对Cd的富集能力。【拟解决的关键问题】采用盆栽试验,以青葙为Cd修复植物,研究6种螯合剂对土壤可提取态Cd含量及青葙吸收富集Cd的影响,以期筛选出适合青葙富集Cd的最佳螯合剂及其最佳浓度,为提高青葙对Cd污染土壤的修复能力提供理论参考。
1 材料与方法
1. 1 试验材料
将青葙种子播种于苗床中,置于温度为20~35 ℃的温室内培养。待3~7 d种子萌发后,每周用霍格兰营养液浇灌一次,使土壤水含量保持在田间持水量的80%左右。待幼苗长出4~6片真叶,高度为3~4 cm时,移栽进行盆栽试验。
供试土壤为广西某矿区尾砂污染的水稻田耕作层(0~20 cm)土壤。将采集的土壤样品放置阴凉处自然风干,磨碎后过2 mm筛,利用土壤检测仪(SL-3A)测定土壤的基本理化性质,结果详见表1。
1. 2 土壤Cd溶出试验
称取10 g过100目筛的土壤,在土壤中分别加入浓度为0(对照)、1.0、2.5、5.0、8.0和10.0 mmol/kg的柠檬酸、苹果酸、草酸、酒石酸、腐殖酸和EDTA(低分子有机酸和EDTA均购自西陇环境科学股份有限公司),平衡2周后将土壤置于100 mL塑料离心管中。
1. 3 盆栽试验
称取1 kg试验土壤装入2 L塑料盆内,分别向盆内添加浓度梯度为0(对照)、1.0、2.5、5.0、8.0和10.0 mmol/kg的柠檬酸、苹果酸、草酸、酒石酸、腐殖酸和EDTA。加水后晒干如此反复3次,平衡2周后备用。选取生长一致的青葙幼苗移栽至试验土壤中,每个浓度3个重复,每盆种植3棵青葙,生长期约50 d。
每个重复组选取一株青葙进行收割,收获后的青葙分成根、茎和叶3部分。根部先用5 mmol/L Ca(NO3)2(购自西陇环境科学股份有限公司)溶液浸泡15 min,用超声波清洗仪清洗10 min,再用去离子水冲洗3次。茎和叶直接用去离子水清洗3次。洗净的样品于105 ℃杀青18 min,60 ℃烘干至恒重,分别测定根、茎和叶的干重,粉碎,过5 mm筛备用。
1. 4 样品分析
土壤总Cd采用HNO3-HClO4(购自西陇环境科学股份有限公司)溶液消煮,可提取态Cd采用0.005 mol/L DTPA+0.01 mol/L CaCl2+0.1 mol/L TEA(购自上海晶纯生化科技股份有限公司)溶液浸提,并在25 ℃下振荡2 h;粉碎的植物樣品(约0.5 g)用HNO3+HF+HClO4(3∶1∶1,v/v/v)消化,冷却后用去离子水稀释至50 mL。土壤总Cd、可提取态Cd和植物中Cd含量采用火焰/石墨炉原子吸收光谱仪(PE-PinAAcle 900T,美国)进行测定。
植物样品消解及质量控制采用国家标准参比物质[GBW10015(GSB-6)]和平行全空白样进行,为保证结果的准确性,加标回收率控制在95%~105%。青葙对Cd的提取总量=生物量×地上部分Cd含量。
1. 5 统计分析
使用Excel 2016统计试验数据,利用SPSS 18.0进行单因素方差分析(One-way ANOVA),使用Origin 8.0制图。
2 结果与分析
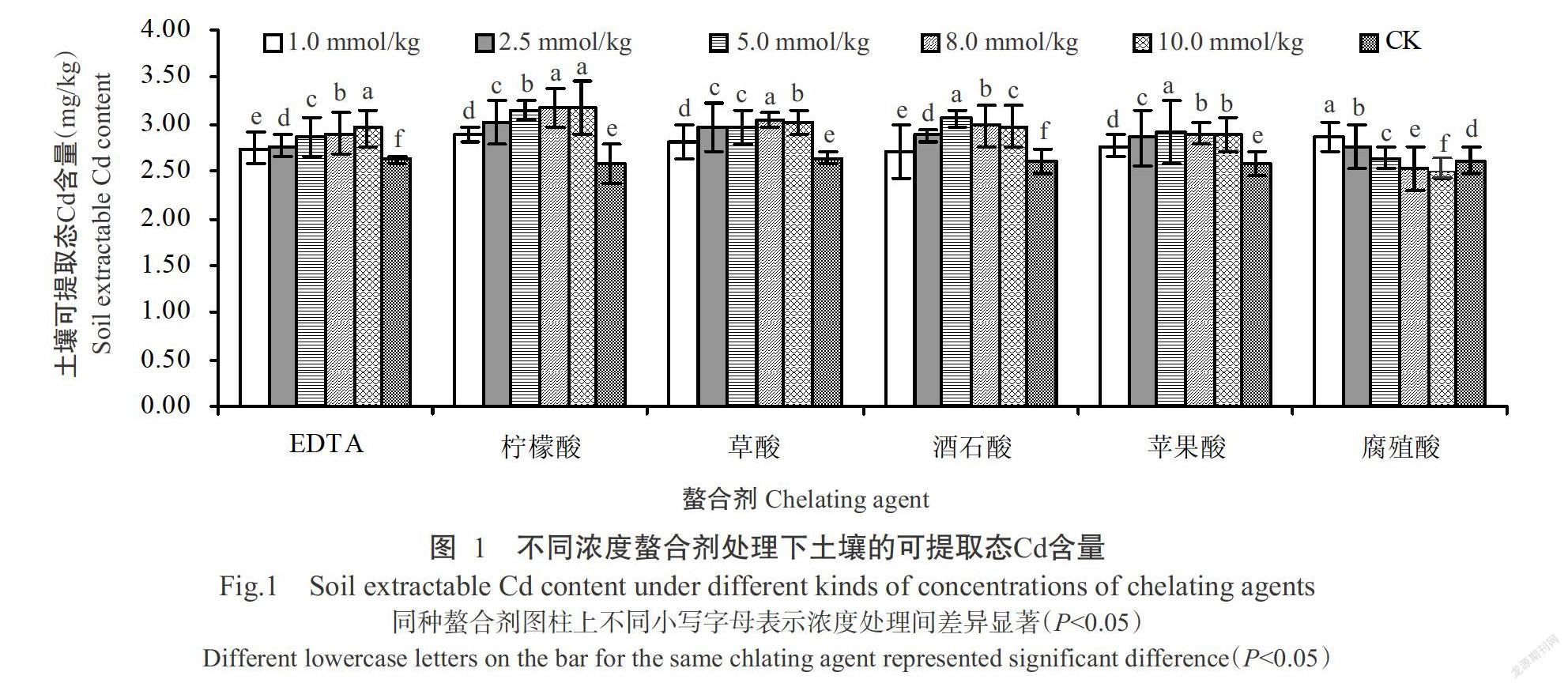
2. 1 不同螯合剂对土壤可提取态Cd含量的影响
由图1可看出,除腐殖酸外,添加螯合剂后可增加土壤的可提取态Cd含量。与对照组相比,在土壤中添加1.0、2.5、5.0,8.0和10.0 mmol/kg的柠檬酸和EDTA后,土壤可提取态Cd含量逐渐增加,在10.0 mmol/kg的浓度条件下分别达3.18±0.29和2.96±0.20 mg/kg,较对照组增加22.8%和14.3%。随酒石酸、苹果酸和草酸添加浓度的增大,土壤可提取态Cd含量均呈先升高后降低的变化趋势,酒石酸和苹果酸浓度为5.0 mmol/kg时,土壤可提取态Cd含量最高,分别较对照组增加15.9%和10.2%;草酸浓度为8.0 mmol/kg时,土壤可提取态Cd含量最高,较对照组增加17.3%。随着腐殖酸添加浓度的增大,土壤可提取态Cd含量逐渐降低,腐殖酸浓度大于5.0 mmol/kg时,土壤可提取态Cd含量显著低于对照组(P<0.05,下同)。
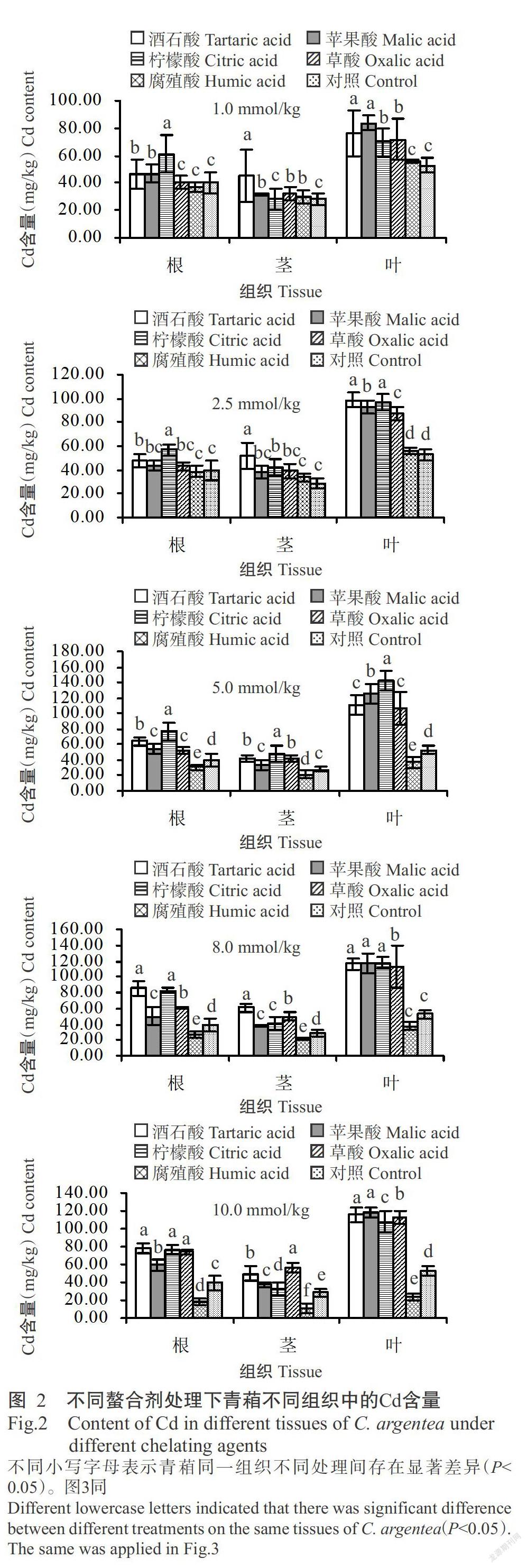
2. 2 不同螯合剂对青葙吸收富集Cd的影响
在土壤中加入不同浓度的EDTA后,青葙幼苗移栽3 d后即出现中毒症状并相继干枯死亡,因此无统计数据。由图2可看出,加入1.0和2.5 mmol/kg的腐殖酸,青葙茎和叶中的Cd含量稍高于对照组,当加入腐殖酸的浓度达5.0 mmol/kg及以上时,青葙各组织中的Cd含量均低于对照,且腐殖酸浓度越高,各组织中的Cd含量越低。在土壤中加入不同浓度的酒石酸、苹果酸、柠檬酸和草酸后,青葙根、茎、叶的Cd含量均有所增加,各组织吸收富集的Cd含量整体上表现为叶>根>茎。其中螯合剂浓度为1.0和10.0 mmol/kg时,苹果酸处理青葙叶片中的Cd含量最高,分别为83.60±5.21和118.00±4.94 mg/kg,为对照组的1.59和2.25倍;螯合剂浓度为2.5 mmol/kg时,酒石酸处理青葙叶片中的Cd含量(98.70±6.09 mg/kg)最高,为对照组的1.88倍;螯合剂浓度为5.0 mmol/kg时,柠檬酸处理青葙叶片中的Cd含量(143.00±14.60 mg/kg)最高,为对照组的2.74倍;螯合剂浓度为8.0 mmol/kg时,柠檬酸和苹果酸处理青葙叶片中的Cd含量分别为117.00±6.84和117.00±12.30 mg/kg,为对照组的2.23倍。对比可知,当螯合剂浓度为5.0 mmol/kg时,柠檬酸处理的青葙叶片中Cd含量最高,说明在5.0 mmol/kg的添加浓度下,柠檬酸处理青葙叶片吸收富集Cd的能力最强。
2. 3 不同螯合剂对青葙生物量的影响
当螯合剂浓度为5.0 mmol/kg时,土壤的可提取态Cd含量维持在较高水平(图1),且该浓度下添加柠檬酸处理的青葙叶片中Cd含量最高(图2),因此选取螯合剂浓度为5.0 mmol/kg进行后续试验;此外,随着腐殖酸浓度的增大,青葙不同组织中的Cd含量逐渐降低,故舍弃添加腐殖酸后青葙的生物量数据。由图3可看出,添加酒石酸、苹果酸、柠檬酸和草酸后,青葙根、茎、叶的生物量均低于对照组,其中酒石酸对青葙生长的抑制作用明显,其根、茎和叶的生物量较对照组分别显著降低54.1%、37.8%和51.6%。柠檬酸和草酸处理的青葙根、茎、叶干重均高于苹果酸和酒石酸处理,且柠檬酸和草酸处理的根、茎、叶干重间均无显著差异(P>0.05)。可见,在螯合剂浓度为5.0 mmol/kg时,加入柠檬酸和草酸后青葙生物量较高,说明这两种螯合剂对青葙生长的抑制作用较小。
2. 4 不同螯合剂处理下青葙对Cd的提取总量
对比添加5.0 mmol/kg螯合剂时青葙对Cd的提取总量(图4),结果发现添加酒石酸、草酸、柠檬酸和苹果酸后,青葙对Cd的提取总量均高于对照组(0.111±0.010 mg/株),其中添加柠檬酸时,青葙对Cd的提取总量最高,为0.199±0.006 mg/株;其次是草酸和苹果酸处理,青葙对Cd的提取总量分别为0.161±0.012和0.152±0.007 mg/株;经酒石酸处理后青葙对Cd的提取总量最低,为0.118±0.002 mg/株。
3 讨论
低分子有机酸是含有一种或多种羧基基团的化合物,是重要的金属配位体,可改变土壤溶液中重金属的形态,减少土壤有机质与重金属离子的固定作用,增加重金属在土壤中的移动性(赵雨森等,2010;胡群群等,2011)。本研究结果表明,添加酒石酸、苹果酸、柠檬酸、草酸和EDTA后,土壤的可提取态Cd含量与对照组相比均有所增加,说明选择的低分子有机酸和人工合成螯合剂(EDTA)可活化溶出土壤中的重金属,与Schmidt(2003)、陈良华等(2016)的研究结果一致。添加腐殖酸后,土壤可提取态Cd含量逐渐降低,腐殖酸浓度大于5.0 mmol/kg时,土壤可提取态Cd含量低于对照组,可能是因为腐殖酸表面存在羧基和苯基,Cd可与这些基团结合形成稳定的复合物(Krishnamurti et al.,1997),降低土壤Cd的可利用性(余贵芬等,2006),添加的腐殖酸浓度越高,羧基和苯基的基团越多,可与土壤Cd形成的稳定复合物越多,因此土壤Cd的可提取态含量降低。
大量研究表明,EDTA可活化溶出土壤中的Pb、Cd和Zn等金属元素,促进植物对金属的吸收和积累(Ebbs and Kochian,1998;蒋先军等,2003;Chen et al.,2004)。但也有研究表明,在溶液中添加EDTA后降低了植物对重金属的吸收(Chen and Cutright,2001),说明EDTA并不能促进所有植物对重金属的吸收。本研究中,在土壤中加入不同浓度的EDTA后,青葙移苗3 d后出现幼苗中毒症状并相继干枯死亡,表明在本研究条件下,青葙对EDTA耐受性极低;加入1.0和2.5 mmol/kg的腐殖酸,青葙茎、叶中的Cd含量稍有增加,当加入5.0 mmol/kg以上浓度的腐殖酸后,青葙根、茎、叶中的Cd含量均逐渐降低,可能是因为土壤中的腐殖酸浓度越高,与土壤Cd形成的稳定复合物越多,土壤可提取态Cd浓度降低,越不利于植物对Cd的吸收(Baker and Brooks,1989;余贵芬等,2006)。当添加不同浓度的酒石酸、苹果酸、柠檬酸和草酸后,青葙不同器官的Cd含量均有所增加,可能是这些低分子有机酸能与Cd2+强烈结合形成有机复合态Cd,而有机复合态Cd比离子态Cd更易于在植物体内转运和积累(Ehsan et al.,2014;姚诗音等,2017)。有研究表明,Cd主要富集在少花龙葵、长柔毛委陵菜和栾树的根部(胡鹏杰等,2007;张杏锋等,2014;杨岚鹏等,2017)。本研究中,Cd在青葙不同组织中的富集规律为叶>根>茎,说明青葙叶片对Cd的富集能力较强。当加入不同浓度的螯合剂时,青葙叶片对Cd表现出不同的富集效果,可能與低分子有机酸对重金属离子的活化能力存在浓度效应有关(丁竹红等,2009)。李华英(2014)研究表明,水培试验中1.5 mmol/L柠檬酸对Cd积累的促进作用强于草酸。本研究发现当添加5.0 mmol/kg的柠檬酸时,叶片中的Cd含量最高,说明在该浓度下柠檬酸对青葙叶片吸收富集Cd的促进作用最强。
超富集植物的生物量可反映逆境對植物生长的影响,也可表征植物的修复效率(韦朝阳和陈同斌,2001;杨勇等,2009)。已有研究表明,柠檬酸、苹果酸、酒石酸和草酸可活化土壤中的重金属,加剧重金属对植物的毒害作用,进而影响植物的生长(宋静等,2006;刘金等,2015)。本研究中,在螯合剂浓度为5.0 mmol/kg时,柠檬酸和草酸处理的青葙叶片干重最大,且二者无显著差异,但添加柠檬酸时,青葙对Cd的提取总量最大,表明添加浓度为5.0 mmol/kg的柠檬酸时,青葙对Cd的积累能力达最高值,螯合效果最佳,且对青葙生长的抑制作用最小。
4 结论
不同螯合剂种类及浓度强化青葙修复土壤Cd污染的效应存在差异。当添加5.0 mmol/kg的柠檬酸时,青葙叶片的生物量最大,且此时青葙对Cd的提取总量达最高值,表明在本研究浓度范围内,5.0 mmol/kg柠檬酸的螯合效果最佳。
参考文献:
陈良华,徐睿,张健,杨万勤,胡相伟,张明锦,高顺. 2016. 螯合剂对香樟生理特性和镉积累效率的影响[J]. 云南大学学报(自然科学版),38(1):150-161. [Chen L H,Xu R,Zhang J,Yang W Q,Hu X W,Zhang M J,Gao S. 2016. The effect of chelator on physiological traits and Cd accumulation efficiency of Cinnamomum camphora [J]. Jouranl of Yunnan University(Natural Sciences Edition),38(1):150-161.]
丁竹红,胡忻,尹大强. 2009. 螯合剂在重金属污染土壤修复中应用研究进展[J]. 生态环境学报,18(2):777-782. [Ding Z H,Hu X,Yin D Q. 2009. Application of chelants in remediation of heavy metals-contaminated soil[J]. Ecology and Environmental Sciences,18(2):777-782.]
胡鹏杰,周小勇,仇荣亮,汤叶涛,应蓉蓉. 2007. Zn超富集植物长柔毛委陵菜对Cd的耐性与富集特征[J]. 农业环境科学学报,26(6):2221-2224. [Hu P J,Zhou X Y,Qiu R L,Tang Y T,Ying R R. 2007. Cadmium tolerance and accumulation features of Zn-hyperaccumulator Potentilla griffithii var. velutina[J]. Journal of Agro-Environmental Science,26(6):2221-2224.]
胡群群,李志安,黄宏星,侯梅芳,张建霞,段俊. 2011. 柠檬酸促进土壤镉解吸的机理研究[J]. 生态环境学报,20(8-9):1338-1342. [Hu Q Q,Li Z A,Huang H X,Hou M F,Zhang J X,Duan J. 2011. Effects of citric acid on the desorption of Cd from soil[J]. Ecology and Environmental Sciences,20(8-9):1338-1342.]
蒋先军,骆永明,赵其国,葛元英. 2003. 镉污染土壤植物修复的EDTA调控机理[J]. 土壤学报,40(2):205-209. [Jiang X J,Luo Y M,Zhao Q G,Ge Y Y. 2003. The role of EDTA in Cd absorption and translocation by indian mustard[J]. Acta Pedologica Sinica,40(2):205-209.]
李华英. 2014. 外源柠檬酸和草酸对镉胁迫下苎麻生理响应的影响研究[D]. 长沙:湖南大学. [Li H Y. 2014. Effects of exogenous citric acid and oxalic acid on physiological response of ramie under cadmium stress[D]. Changsha:Hunan University.]
李玉宝,夏锦梦,论东东. 2017. 土壤重金属污染的4种植物修复技术[J]. 科技导报,35(11):47-51. [Li Y B,Xia J M,Lun D D. 2017. Review of four phytoremediation techniques for soil polluted by heavy metals[J]. Science and Technology Guide,35(11):47-51.]
刘金,殷宪强,孙慧敏,吕家珑,韦革宏. 2015. EDDS与EDTA强化苎麻修复镉铅污染土壤[J]. 农业环境科学学报,34(7):1293-1300. [Liu J,Yin X Q,Sun H M,Lü J L,Wei G H. 2015. EDTA and EDDS enhanced remediation of Cd and Pb contaminated soil by ramie(Boehmeria nivea)[J]. Journal of Agro-Environmental Science,34(7):1293-1300.]
罗慧,刘秀明,王世杰,刘方,李颖. 2018. 中国南方喀斯特集中分布区土壤Cd污染特征及来源[J]. 生态学杂志,37(5):1538-1544. [Luo H,Liu X M,Wang S J,Liu F,Li Y. 2018. Pollution characteristics and sources of cadmium in soils of the karst area in South China[J]. Chinese Journal of Ecology,37(5):1538-1544.]
宋静,钟继承,吴龙华,王国庆,李晨曦,骆永明,钱薇. 2006. EDTA与EDDS螯合诱导印度芥菜吸取修复重金属复合污染土壤研究[J]. 土壤,38(5):619-625. [Song J,Zhong J C,Wu L H,Wang G Q,Li C X,Luo Y M,Qian W. 2006. Chelate-induced extraction and remediation of Brassica juncea on heavy metals mix-polluted soils by EDTA and EDDS[J]. Soil,38(5):619-625.]
韦朝阳,陈同斌. 2001. 重金属超富集植物及植物修复技术研究进展[J]. 生态学报,21(7):1196-1203. [Wei C Y,Chen T B. 2001. Hyperaccumulators and phytoremediation of heavy metal contaminated soil a review of studies in China and abroad[J]. Acta Ecologica Sinica,21(7):1196-1203.]
杨岚鹏,朱健,王平,曾璟,谭蓉,杨雨中,朱烨林,章才建. 2017. 栾树对镉的耐性、富集及胁迫响应[J]. 植物生理学报,53(8):1419-1427. [Yang L P,Zhu J,Wang P,Zeng J,Tan R,Yang Y Z,Zhu Y L,Zhang C J. 2017. To-lerance,accumulation and stress respond of Koelreuteria paniculata to camium[J]. Plant Physiology Jouranl,53(8):1419-1427.]
杨勇,王巍,江荣风,李花粉. 2009. 超累积植物与高生物量植物提取镉效率的比较[J]. 生态学报,29(5):2732-2737. [Yang Y,Wang W,Jiang R F,Li H F. 2009. Comparison of phytoextraction efficiency of Cd with the hyperaccmulator Thlaspi caerulescens and three high biomass species[J].Acta Ecologica Sinica,29(5):2732-2737.]
姚诗音,刘杰,王怡璇,朱园芳,丰顺. 2017. 青葙对镉的超富集特征及累积动态研究[J]. 农业环境科学学报,36(8):1470-1476. [Yao S Y,Liu J,Wang Y X,Zhu Y F,Feng S. 2017. Cd hyperaccumulation and accumulative kine-tics of Celosia argentea Linn. for phytoremediation of Cd-contaminated soil[J]. Journal of Agro-Environment Science,36(8):1470-1476.]
余贵芬,蒋新,赵振华,卞永荣. 2006. 腐殖酸存在下镐和铅对土壤脱氢酶活性的影响[J]. 环境化学,25(2):168-170. [Yu G F,Jiang X,Zhao Z H,Bian Y R. 2006. Dehydrogenase activity of Cd and Pb-contaminated soil in the presence of humic substances[J]. Environmental Chemical,25(2):168-170.]
张敬锁,李花粉,衣纯真,张福锁. 1999. 有机酸对活化土壤中镐和小麦吸收镐的影响[J]. 土壤学报,36(1):61-65. [Zhang J S,Li H F,Yi C Z,Zhang F S. 1999. Effect of organic acids on mobilization of cadmium in soil and cadmium uptake by wheat plant[J]. Acta Pedologica Sinica,36(1):61-65.]
张杏锋,李丹,高波. 2014. 重金属在超富集植物少花龙葵和李氏禾体内的分布和移动特征[J]. 广东农业科学,(16):151-155. [Zhang X F,Li D,Gao B. 2014. Distribution and movement characteristics of heavy metals in hyperaccumulators:Solanum photeinocarpum and Leersiahexandra[J]. Guangdong Agricultural Sciences,(16):151-155.]
趙青青,王海波,史静. 2018. 生物质炭对Cd污染土壤根际微团聚体Cd形态转化的影响[J]. 环境科学研究,31(3):555-561. [Zhao Q Q,Wang H B,Shi J. 2018. Effects of biochar on the transformation of Cd forms in rhizosphere micro-aggregates of Cd-contaminated soil[J]. Research of Environmental Sciences,31(3):555-561.]
赵雨森,王文波,祁海云,宋金凤. 2010. 低分子有机酸/盐对复合污染土壤中Cd、Pb有效性的影响[J]. 东北林业大学学报,38(6):72-75. [Zhao Y S,Wang W B,Qi H Y,Song J F. 2010. Effects of low moleculr-weigh organic acids/salts on availability of cadmium and lead in mixed-pollu-ted soils[J]. Journal of Northeast Forestry University,38(6):72-75.]
Ali H,Khan E,Sajad M A. 2013. Phytoremediation of heavy metals—Concepts and applications[J]. Chemosphere,91(7):869-881.
Baker A J M,Brooks R R. 1989. Terrestrial higher plants which hyperaccumulate metallic elements—A review of their distribution,ecology and phytochemistry[J]. Biorecovery,1:81-126.
Chaturvedi N,Dhal N K,Patra H K. 2015. EDTA and citric acid-mediated phytoextraction of heavy metals from iron ore tailings using Andrographis paniculata:A comparative study[J]. International Journal of Mining,Reclamation and Environment,29(1):33-46.
Chen H,Cutright T. 2001. EDTA and HEDTA effects on Cd,Cr,and Ni uptake by Helianthus annuus[J]. Chemosphere,45:21-28.
Chen Y H,Li X D,Shen Z G. 2004. Leaching and uptake of heavy metals by ten different species of plants during an EDTA-assisted phytoextraction process[J]. Chemosphere,57(3):187-196.
Ebbs S D,Kochian L V. 1998. Phytoextraction of zinc by oat (Avena sativa),barley(Hordeum vulgare),and Indian mustard(Brassica juncea)[J]. Environmental Science & Technology,32(6):802-806.
Ehsan S,Ali S,Noureen S,Mahmood K,Farid M,Ishaque W,Shakoor M B,Rizwan M. 2014. Citric acid assisted phytoremediation of cadmium by Brassica napus L[J]. Ecotoxicology and Environmental Safety,106:164-172.
Evangelou M W H,Ebel M,Schaeffer A. 2007. Chelate assisted phytoextraction of heavy metals from soil. Effect,mechanism,toxicity,and fate of chelating agents[J]. Chemosphere,68:989-1003.
Krishnamurti G S R,Cieslinski G,Huang P M,Rees K C J V,Van R K C J. 1997. Kinetics of cadmium release from soils as influenced by organic acids:Implication in cad-mium availability[J]. Journal of Environmental Quality,26:271-277.
Liu J,Shang W W,Zhang X H,Zhu Y N,Yu K. 2014. Mn accumulation and tolerance in Celosia argentea Linn.:A new Mn-hyperaccumulating plant species[J]. Journal of Hazardous Materials,267:136-141.
Mench M,Schwitzguebel J P,Schroeder P,Bert V,Gawronski S,Gupta S. 2009. Assessment of successful experiments and limitations of phytotechnologies:Contaminant uptake,detoxification and sequestration,and consequences for food safety[J]. Environmental Science and Pollution Research International,16:876-900.
Schmidt U. 2003. Enhancing phytoextraction:The effect of chemical soil manipulation on mobility,plant accumulation,and leaching of heavy metals[J]. Journal of Environmental Quality,32(6):1939-1954.
Tahmasbian I,Sinegani S A A. 2014. Chelate-assisted phytoextraction of cadmium from a mine soil by negatively charged sunflower[J]. International Journal of Environmental Science and Technology,11:695-702.
Zhang S R,Chen M Y,Li T,Xu X X,Deng L J. 2010. A newly found cadmium accumulator—Malva sinensis Cavan[J]. Journal of Hazardous Materials,173:705-709.
(責任编辑 王 晖)
