广东主要水产养殖地区气单胞菌耐药状况的调查分析
2019-09-10邓玉婷谭爱萍张瑞泉赵飞姜兰
邓玉婷 谭爱萍 张瑞泉 赵飞 姜兰


摘要:【目的】了解廣东主要水产养殖地区气单胞菌的耐药状况,为评估水产养殖中的细菌耐药性风险提供科学依据。【方法】2014—2016年每年7—9月分别对广东佛山、肇庆、韶关和阳江等4市6区(县)16个养殖户共20个池塘(均为无发病史池塘)进行动物样品及环境样品采集,分离纯化气单胞菌,然后采用微量二倍稀释法测定分离菌株对14种抗菌药物的敏感性。【结果】从采集的590份样品中分离纯化获得1143株气单胞菌,鉴定为8个种,分别为维氏气单胞菌(Aeromonas veronii,占60.28%)、简达气单胞菌(A. jandaei,占18.11%)、温和气单胞菌(A. sobria,占7.96%)、嗜水气单胞菌(A. hydrophila,占7.09%)、豚鼠气单胞菌(A. caviae,占5.86%)、达卡气单胞菌(A. dhakensis,占0.35%)、A. simiae(占0.26%)和舒伯特气单胞菌(A. schubertii,占0.09%)。1143株分离菌株对14种抗菌药物的敏感性表现不一,其中,对氨苄西林的耐药率最高(97.81%),对磺胺间甲氧嘧啶和萘啶酸中度耐药(69.55%和46.72%),对其他11种抗菌药物相对敏感,耐药率均在20.00%以下。豚鼠气单胞菌的多重耐药率最高(25.37%),其次是嗜水气单胞菌(11.11%),温和气单胞菌、简达气单胞菌和维氏气单胞菌对各类抗菌药物相对敏感,多重耐药率分别为2.20%、1.93%和1.74%。畜禽粪便分离菌株的多重耐药率较高(10.53%),其次是鱼组织分离菌株(5.88%),而池塘水和底泥分离菌株相对敏感,多重耐药率分别为3.35%和1.95%。畜禽—鱼复合养殖模式和非复合养殖模式气单胞菌分离菌株均对新霉素完全敏感,但前者对其他13种药物的耐药率均高于后者;高密度养殖杂交鳢及复合养殖模式下团头鲂和麦鲮源分离菌株的耐药率较高,而一些经济价值相对较低的品种如罗非鱼和草鱼,其分离菌株多重耐药率较低。【结论】广东主要水产养殖地区气单胞菌耐药率总体水平不高,耐药程度与养殖水平、用药习惯及养殖模式等有关,磺胺类耐药性已成为水产养殖细菌病害防治过程中最突出的问题,因此,非常有必要开展水产养殖病原菌耐药性监测,了解其发展趋势及传播风险,为评估水产品质量安全及指导临床科学用药提供科学依据。
关键词: 气单胞菌;抗菌药物;耐药性;水产养殖地区;广东
中图分类号: S917.1 文献标志码: A 文章编号:2095-1191(2019)11-2375-09
Antimicrobial resistance of Aeromonas isolates from
aquaculture areas in Guangdong
DENG Yu-ting1,2, TAN Ai-ping1, ZHANG Rui-quan1, ZHAO Fei1, JIANG Lan1*
(1Key Laboratory of Aquatic Animal Immune Technology, Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences/Key Laboratory of Fishery Drug Development, Ministry of Agriculture and Rural Affairs/Guangdong Key Laboratory of Aquatic Animal Immune Technology, Guangzhou 510380, China; 2Key Laboratory of Control of Quality and Safety for Aquatic Products, Ministry of Agriculture and Rural Affairs, Beijing 100141, China)
Abstract:【Objective】Antimicrobial resistance of Aeromonas isolates from aquaculture areas in Guangdong was stu-died to provide reference for evaluating risks of antimicrobial resistance in aquaculture. 【Method】Aeromonas samples from animals and aquatic environment were collected at 20 ponds from 16 farmers in 6 districts(counties), 4 cities(Foshan, Zhaoqing, Shaoguan and Yanguan) in Guangzhou from July to September during 2014 to 2016. Aeromonaswere isolated and purified, all the isolates were tested for resistance to 14 antimicrobial agents by two-fold micro dilution method. 【Result】Five hundred and ninety samples were collected and a total of 1143 Aeromonas isolates were isolated and identified. Eight species were identified, they were A. veronii(60.28%), A. jandaei(18.11%), A. sobria(7.96%),A. hydrophila(7.09%),A. caviae(5.86%),A. dhakensis(0.35%),A. simiae(0.26%) and A. schubertii(0.09%). Diversity of susceptibilities of 1143 Aeromonas isolates to 14 antimicrobial agents was determined. Aeromonas isolates showed highest resistance to ampicillin(97.81%), and medium resistance to sulfanilamide and nalidixic acid, whose resistance rates were 69.55% and 46.72%, respectively. The isolated were susceptible to the other 11 drugs with resistance rate all being below 20.00%. Multi-drug resistance of A. caviae was the highest(25.37%), followed by A. hydrophila(11.11%), A. sobria, A. jandaei and A. veronii were sensitive to all the drugs, with multi-drug resistance rates being 2.20%, 1.93% and 1.74%. The isolates from livestock feces had high multi-drug resistance rate(10.53%), followed by isolates from fish tissue(5.88%). The isolates from pond water and sediment were susceptible with multi-drug resistance rates being 3.35% and 1.95%. Comparing different types of aquaculture systems, the isolates collected from the livestock-fish integrated breeding and non-integrated farming were all susceptible to neomycin, but the resistance to other 13 drugs of isolates from livestock-fish integrated breeding was higher than the non-integrated farming. The isolates from the hybrid snakehead cultured with high stocking density and the isolates from Megalobrama amblycephala and Cirrhina mrigala cultured in livestock-fish farm showed high resistance, but for the fishes with lower economic values such as tilapia and grass carp, their multi-resistance rates were low. 【Conclusion】These results indicate that the overall resistance rate of Aeromonas isolated from different origins in aquaculture areas in Guangdong is not very high, the resistance maybe related to the development of farming, the habits of drug prescribing and the types of aquaculture systems, etc. The resistance to sulfanilamide grous has become a serious problem in disease control during aquaculture. It is very urgent to monitor the antimicrobial resistance in aquaculture to understand its occurrence and transmission, and to provide reference for evaluating the quality safety of aquatic products and clinical rational use of medicine.
Key words: Aeromonas; antimicrobial agent; antimicrobial resistance; aquaculture areas; Guangdong
0 引言
【研究意义】广东是我国水产养殖业的主产区之一,养殖品种众多,除四大家鱼外还有产量较高的特色经济品种,包括鲈鱼、乌鳢、罗非鱼、鳜鱼和鳗鲡等(农业农村部渔业渔政管理局,2018)。随着水产养殖业的迅猛发展,养殖集约化程度、养殖密度和水产品总量不断攀升,随之出现的水质环境恶化、疾病暴发流行、病原微生物耐药性增强及水产品质量安全等问题日益突出。目前,在水产养殖过程中广泛使用的抗菌药物主要有磺胺类、氟喹诺酮类和四环素类等(汪建国,2013),而在水产品质量安全问题的诸多影响因素中,除药物残留外,细菌耐药性问题也是近年来全球关注的热点之一(孟思妤等,2012;Miller and Harbottle,2018)。因此,加强水产动物细菌耐药性研究,尤其是开展水产动物细菌耐药性监测工作,了解水产病原菌对常用抗菌药物的敏感性变化,对评估水产品质量安全及指导临床科学用药均具有重要意义。【前人研究进展】针对水产养殖使用抗菌药物所产生的耐药情况,国内外学者已开展了一系列调查研究工作(李国烈等,2012;王静波等,2012;朱芝秀等,2012)。丁正峰等(2011)研究發现,分离自患病水产动物的气单胞菌(Aeromonas spp.)、弗尼斯弧菌(Vibrio fluvialis)及类志贺邻单胞菌(Plesimonas shigelloides)等病原菌对喹诺酮类药物的总体耐药率高达62.50%,对β-内酰胺类的耐药率为50.50%,对氯霉素类和四环素类的耐药率较低,分别为11.85%和10.35%。吴雅丽等(2013)测定了1995—2012年112株来源于不同患病水产动物的气单胞菌对20种抗菌药物的敏感性,结果显示其对萘啶酸、磺胺类及四环素类的耐药率均在40.00%以上,而对诺氟沙星、环丙沙星、头孢喹肟、阿米卡星及多西环素等广谱药物较敏感,耐药率在15.00%以下。近年来,国内外学者大力开展水产病原菌耐药性研究工作,但国外的水产养殖环境、养殖品种及抗菌药物使用习惯等与国内存在明显差异,其耐药性调查的主要对象为海水鱼和海水环境(Miller and Harbottle,2018;Santos and Ramos,2018),而国内细菌耐药性研究尚处在起步阶段。一方面,主要集中在从患病淡水养殖水产动物分离的病原菌上(刘训猛等,2017;黄艳华等,2018;梁静真等,2018),调查菌种一般在100株左右,数据量较小;另一方面,水产病原菌药物敏感性检测主要采用纸片扩散法(K-B),虽然该方法操作简单,但只能用于判断菌株对某种抗菌药物是否耐药的定性分析(刘亚等,2018),无法测定菌株的最小抑菌浓度(Minimum inhibitory concentration,MIC)而进行定量分析,了解其在特定时段的药物敏感性变化规律;此外,与人医临床和动物源(畜禽)细菌耐药性监测相比,水产养殖源细菌耐药性监测尚未具备系统性、持续性和广泛性。【本研究切入点】气单胞菌是一种革兰氏阴性短杆菌,兼性厌氧,广泛存在于水环境和水生动物中,也可从动物和人类的肠道内分离获得(Janda and Abbott,2010),目前已鉴定的气单胞菌有36个种、12个亚种(Martin-Carnahan and Joseph,2015)。气单胞菌多为条件致病菌,可引起水生动物肠炎或败血症等,也可引起人类或其他动物肠炎等(Janda and Abbott,2010;肖艳翼等,2015;葛阳杨等,2017)。与从患病动物上分离获得的病原菌耐药情况不同,在未发病动物及其生长环境中分离得到的气单胞菌对大部分广谱抗菌药物敏感(冯永永等,2016),因此,气单胞菌可作为研究水产养殖细菌耐药性的指示菌,但至今鲜见针对无发病状态下水产养殖环境及水产动物源气单胞菌对抗菌药物敏感性的相关报道。【拟解决的关键问题】2014—2016年连续3年在广东主要水产养殖地区开展气单胞菌耐药性调查,从水产养殖动物及其养殖环境中分离气单胞菌,通过微量二倍稀释法测定分离菌株对常用抗菌药物的敏感性,分析不同养殖环境、养殖品种和养殖模式中气单胞菌的耐药情况,为评估水产养殖中的细菌耐药性风险提供科学依据。
1 材料与方法
1. 1 样品采集及细菌分离培养
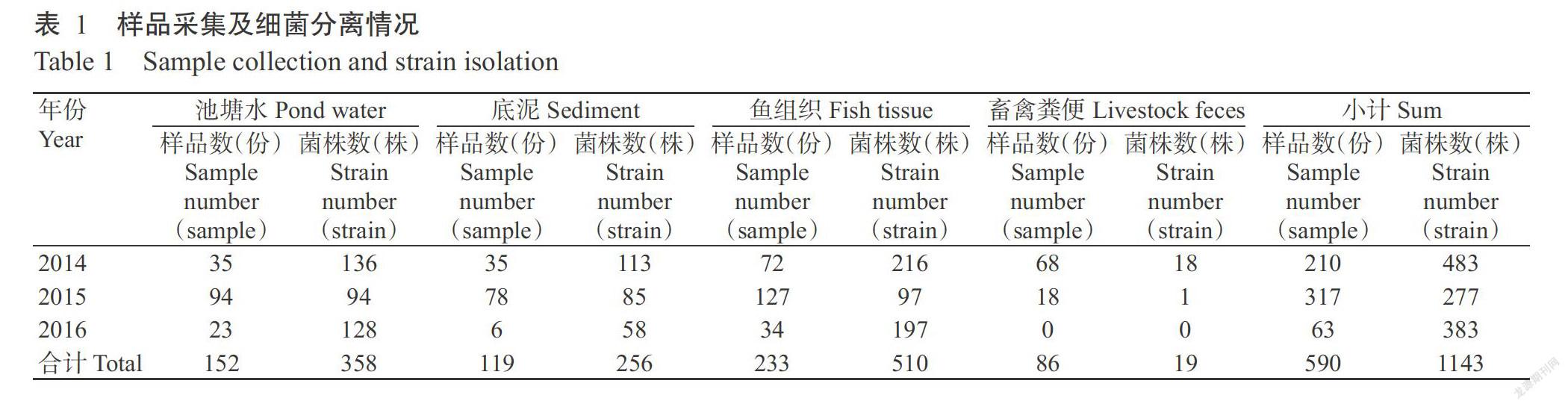
2014—2016年每年7—9月分别对广东佛山、肇庆、韶关和阳江等4市6区(县)16个养殖户共20个池塘(均为无发病史池塘)进行动物样品及环境样品采集。动物样品包括畜禽样品和鱼样品,畜禽样品用无菌棉签取肛门粪便,每个养殖场10份;鱼样品取其鳃、肝脏和肠道等脏器,每个养殖场5~10尾鱼。环境样品包括池塘水和池塘底泥,环绕池塘不同方向选取5个采样点,每个采样点以采水器采集池塘表面以下20~30 cm的池塘水500 mL;底泥采集则选择池塘水采集的同一采样点,用采泥管采集底泥约50 g。共采集各类样品590份,包括池塘水152份、池塘底泥119份、鱼组织233份及畜禽粪便86份(表1)。
处理过的样品滤液或组织液用生理盐水梯度稀释后,涂布于气单胞菌选择性RS琼脂培养基上,30 ℃恒温培养过夜,挑选3~5个特征单菌落接种至RS琼脂纯化培养基上培养,再经氧化酶鉴定,阳性菌株置于4 ℃保存,或经分子鉴定为气单胞菌的分离菌株采用真空冷冻干燥后-80 ℃保存备用。
1. 2 菌株鉴定
取过夜培养的分离菌株培养液,按细菌基因组试剂盒(美国OMEGA公司)说明提取并纯化细菌基因组DNA。根据Borrell等(1997)、Yá?ez等(2003)的方法分别合成扩增16S rRNA序列和gyrB基因的特异性引物,PCR扩增产物经琼脂糖凝胶电泳检测后送至广州艾基生物技术有限公司进行测序,并将测序结果上传到NCBI的BLAST检索系统进行同源性比对分析。
1. 3 药物敏感性测定
药物敏感性测定采用微量二倍稀释法,参照美国国家临床实验室标准化委员会(Clinical and laboratory standards institute,CLSI)的标准判断分离菌株的药物敏感性,并以大肠埃希菌(Escherichia coli) ATCC25922作为质控菌株。选取广谱抗菌药物七大类14种药物,包括磺胺类及其增效剂:磺胺间甲氧嘧啶(Sulfamonomethoxine,SMM)和磺胺甲噁唑/甲氧苄啶(Sulfamethoxazole/trimethoprim,SXT);四环素类:多西环素(Doxycycline,DOX);喹诺酮类:萘啶酸(Nalidixic acid,NAL)、恩诺沙星(Enrofloxacin,ENR)和环丙沙星(Ciprofloxacin,CIP);氨基糖苷类:新霉素(Neomycin,NEO)、庆大霉素(Gentamicin,GEN)和阿米卡星(Amikacin,AMK);β-内酰胺类:氨苄西林(Ampicillin,AMP)和头孢噻肟(Cefotaxime,CTX);酰胺醇类:氟苯尼考(Florfenicol,FFC)和氯霉素(Chloramphenicol,CHL);呋喃类:呋喃妥因(Nitrofurantoin,NIT)。同时设无药无菌的阴性对照和无药有菌的阳性对照。于每孔中加入上述稀释至1×106 CFU/mL的菌液100 μL,置于35 ℃培养箱中静置培养16~24 h,取出观察结果。对照组菌株生长良好时,以肉眼观察到能抑制菌株生长的最低药物浓度作为其对气单胞菌的MIC。根据MIC,统计各抗菌药物对分离菌株的MIC50和MIC90(分别指抑制50%和90%分离菌株生长所需要的MIC);同时根据Magiorakos等(2012)对多重耐药(Multiple drug resistance,MDR)的定义标准——对特定抗菌药物中的3类或3类以上(每类中1种或1种以上)抗菌药物不敏感,对分离菌株进行多重耐药分析,并统计其多重耐药率。
2 结果与分析
2. 1 细菌分离鉴定结果
从590份不同来源的样品中共分离纯化获得气单胞菌1143株(表1),通过分子鉴定为8个种,分别为维氏气单胞菌(A. veronii)(689株,占60.28%)、简达气单胞菌(A. jandaei)(207 株,占18.11%)、温和气单胞菌(A. sobria)(91株,占7.96%)、嗜水气单胞菌(A. hydrophila)(81株,占7.09%)、豚鼠气单胞菌(A. caviae)(67株,占5.86%)、达卡气单胞菌(A. dhakensis)(4株,占0.35%)、A. simiae(3株,占0.26%)和舒伯特气单胞菌(A. schubertii)(1株,占0.09%)(表2)。
2. 2 药敏试验结果
2. 2. 1 总体耐药情况 1143株分離菌株对14种抗菌药物的敏感性表现不一(表3),其中,对氨苄西林的耐药率最高,为97.81%,与气单胞菌对氨苄西林固有耐药有关;对磺胺间甲氧嘧啶和萘啶酸中度耐药,耐药率分别为69.55%和46.72%;对喹诺酮类、氨基糖苷类、四环素类、酰胺醇类、磺胺甲噁唑/甲氧苄啶和头孢噻肟相对敏感,耐药率均在20.00%以下。
比较不同年份气单胞菌对各抗菌药物的耐药情况(表3),发现2014年分离菌株主要对磺胺间甲氧嘧啶耐药,其次是萘啶酸;与2014年分离菌株相比,2015年分离菌株对除头孢噻肟外的其他13种抗菌药物的耐药率均略有增加;2016年分离菌株对磺胺间甲氧嘧啶耐药较严重,耐药率高达82.77%;所有分离菌株对氨基糖苷类、头孢菌素类和喹诺酮类药物较敏感,耐药率均低于10.00%。
比较各抗菌药物对分离菌株的MIC50和MIC90,发现磺胺间甲氧嘧啶的MIC50和MIC90均在耐药范围内,说明该药物的耐药性较严重;萘啶酸和磺胺甲噁唑/甲氧苄啶的MIC90也在耐药范围内,说明这两种药物的耐药性相对严重;虽然其他药物的MIC50和MIC90处在敏感值范围,但部分药物的MIC50和MIC90呈逐年增长趋势。不同年份分离菌株的耐药性存在差异,可能与采样区域、养殖类型及养殖品种等不同有关。
2. 2. 2 不同种属气单胞菌耐药率比较 除达卡气单胞菌(4株)、A. simiae(3株)及舒伯特气单胞菌(1株)外,对其余5个种(1135株分离菌株)进行不同种属气单胞菌的耐药率比较(图1),发现豚鼠气单胞菌对14种抗菌药物中的10种耐药率高于其他菌种,多重耐药率为25.37%;其次是嗜水气单胞菌,其多重耐药率为11.11%;而温和气单胞菌、简达气单胞菌和维氏气单胞菌对各种抗菌药物相对敏感,多重耐药率分别为2.20%、1.93%和1.74%。
2. 2. 3 不同来源气单胞菌耐药率比较 比较不同来源气单胞菌对各种抗菌药物的耐药情况(图2),发现动物来源样品(畜禽粪便和鱼组织)分离菌株的耐药性普遍高于环境来源(池塘水和底泥)的分离菌株。畜禽粪便分离菌株的多重耐药率较高,达10.53%;其次是鱼组织分离菌株,多重耐药率为5.88%;而池塘水和底泥分离菌株相对敏感,对应的多重耐药率分别为3.35%和1.95%。
2. 2. 4 不同养殖模式气单胞菌耐药率比较 比较不同养殖模式下气单胞菌的耐药性,一种模式为主养草鱼且池塘旁边同时圈养猪、鸭或鹅的复合养殖模式(6个池塘),一种为以主养草鱼、混养其他四大家鱼的非复合养殖模式(4个池塘)。两种养殖模式下的气单胞菌分离菌株均对新霉素完全敏感,但复合养殖模式分离菌株对其他13种药物的耐药率均高于非复合养殖模式分离菌株,多重耐药率为2.02%(图3),只养鱼的养殖池塘其分离菌株未出现多重耐药现象。
2. 2. 5 不同养殖鱼类气单胞菌耐药率比较 比较不同养殖鱼类分离菌株的耐药性(图4),发现高密度养殖杂交鳢(Channa maculate ♀×C. argus ♂)源分离菌株的耐药情况较严重,对萘啶酸、磺胺类及氟苯尼考的耐药率均超过80.00%,对多西环素中度耐药,其多重耐药率达55.00%;复合养殖模式下,与草鱼(Ctenopharyngodon idella)一起混养的团头鲂(Me-galobrama amblycephala)源分离菌株及作为喂养鳜(Siniperca chuatsi)饵料鱼麦鲮(Cirrhina mrigala)源分离菌株的耐药率也相对较高,主要对磺胺间甲氧嘧啶和萘啶酸中度耐药,多重耐药率分别为24.00%和10.53%;罗非鱼(Oreochromis niloticus)和草鱼源分离菌株最敏感,对氨基糖苷类的3种药物完全敏感,其多重耐药率分别为1.30%和0.46%;18株鳜源分离菌株中只有1株嗜水气单胞菌同时对酰胺醇类、磺胺类和庆大霉素耐药。
3 讨论
目前,使用抗菌药物仍是防控水产动物细菌性病害的主要措施之一,鉴于全球对细菌耐药性的关注与重视,近年来我国在水产养殖细菌耐药性方面也开展了大量研究工作。丁正峰等(2011)对2006—2009年分离自江苏省的480株病原菌进行耐药性分析,发现患病水产动物中气单胞菌的检出率达72.80%,且这些气单胞菌分离菌株对部分喹诺酮类、磺胺类和氯霉素类药物已产生不同程度的耐药性,耐药率呈逐年上升趋势。吴雅丽等(2013)对广东地区1995—2012年从患病水产动物上分离收集的112株气单胞菌进行耐药性分析,结果发现受试菌株对磺胺类和四环素等药物中度耐药,对氟喹诺酮类、氨基糖苷类和第三代头孢类药物相对敏感,且爬行两栖类和观赏鱼源菌株的多重耐药现象比较严重。此外,有学者对不同地区不同水产动物源气单胞菌进行耐药性分析,同样发现分离菌株主要对磺胺类耐药,部分分离菌株对氟苯尼考和四环素等耐药,对氟喹诺酮类和氨基糖苷类等药物的敏感性较高(王静波等,2012;朱芝秀等,2012)。
本研究的气单胞菌主要分离自无发病史的养殖动物及其养殖环境,与临床分离获得(患病动物)的气单胞菌相比,同样表现为对磺胺类药物,尤其是对单方的磺胺类药物耐药,耐药率高达80.00%以上;磺胺类是最早应用于水产动物细菌病防控的抗菌药物之一,在水产养殖上已有20多年的使用历史。本研究结果与前人的相关研究结果(丁正峰等,2011;王静波等,2012;吴雅丽等,2012;朱芝秀等,2012)均表明,长期使用该类药物已不可避免地产生了严重的耐药性,因此临床上应尽量减少使用。有研究报道,2010年以前的临床分离病原菌对酰胺醇类氯霉素和硝基呋喃类表现部分耐药,氯霉素耐药率在10%~15%,呋喃唑酮耐药率在5%~10%(李爱华等,2001;吴雅丽等,2013);而本研究中2014—2016年分离菌株对氯霉素的耐药率在10.00%左右,对呋喃妥因的耐药率在1.00%以下。氯霉素和硝基呋喃类药物曾广泛用于治疗水产动物疾病(李辉华和王广军,2001),但由于这两种药物毒性大,对人体产生危害,现已将其列为禁用兽药。本研究通过检测气单胞菌分离菌株对氯霉素和呋喃妥因的敏感性,发现这两种药物的耐药率均很低,对禁用兽药的耐药性检测可从侧面反映药物停止使用能有效恢复菌株的敏感性。因此,养殖生产上建议采用轮换用药的方式,以降低耐药性产生和传播风险。
以往我国水产动物病源菌耐药性调查的研究对象主要为从发病动物体内分离获得的菌株,从淡水水生动物分离出的气单胞菌以嗜水气单胞菌为主(李爱华等,2001;王静波等,2012;朱芝秀等,2012)。本研究的調查结果显示,正常养殖状况下不管是从鱼组织还是其养殖环境分离获得的气单胞菌种类主要为维氏气单胞菌(占60.28%),与近年报道的鱼类气单胞菌病原以维氏气单胞菌为主(王一娟,2010;张德锋等,2015)相符,说明维氏气单胞菌有可能成为另一种重要的致病菌。本研究还发现不同种属气单胞菌对各种抗菌药物的敏感性差异明显,以豚鼠气单胞菌的多重耐药率最高(25.37%),可能与其在畜禽粪便中的分离率较高有关;其次是嗜水气单胞菌,多重耐药率为11.11%;温和气单胞菌、简达气单胞菌和维氏气单胞菌的多重耐药率相对较低,均在2.00%左右。综合其他水产病原菌的耐药分析结果(李爱华等,2001;王静波等,2012;朱芝秀等,2012)可知,嗜水气单胞菌的耐药性比其他气单胞菌种类高很多,且作为一种致病性非常强的条件病原菌,一旦产生耐药性将给临床治疗带来极大困难。因此,气单胞菌作为养殖水体和水生动物体普遍存在的一种细菌,尤其是维氏气单胞菌和嗜水气单胞菌可作为水产养殖源细菌耐药性监测的指示菌,通过掌握其耐药相对水平,可为评估水产养殖细菌耐药性和指导水生动物细菌性病害防控提供参考依据。
抗菌药物在畜牧水产养殖业的长期使用极易诱导养殖动物体内产生耐药菌株,且这些耐药菌株及其携带的耐药基因可随粪尿排放,在水产环境中传播扩散(Heuer et al.,2011)。本研究对不同来源的气单胞菌进行耐药性分析,发现从畜禽粪便分离的气单胞菌对多种药物耐药,尤其对萘啶酸、氟苯尼考和磺胺甲噁唑/甲氧苄啶的耐药率均高于其他来源的气单胞菌,可能与畜禽养殖大量使用这些药物有关;分离自畜禽粪便和鱼组织的气单胞菌耐药率比环境源气单胞菌高,猪(禽)—四大家鱼复合养殖下气单胞菌分离菌株的耐药率比非复合养殖模式分离菌株的耐药率高很多,且后者未出现多重耐药现象。钟晓霞等(2017)检测了广东鸭—鱼立体养殖环境中耐药基因的污染情况,发现鸭粪中耐药基因的相对丰度较池塘水和底泥高一个数量级。Su等(2011)、Zhang等(2013)、冯永永等(2016)均研究发现在广东地区畜禽—鱼复合养殖模式下分离的耐药菌株多重耐药严重,且从分离菌株中检测出大量耐药基因,其中磺胺类和四环素类耐药基因污染最严重。表明养殖业使用抗菌药物已不可避免地产生耐药菌,尤其畜禽与鱼混养的方式可能会促使耐药菌由动物向水环境传播扩散。
在经济较发达的珠三角地区,传统水产养殖已逐渐向高密度精养和集约化养殖模式转变,高密度养殖已成常态。本研究对比分析不同养殖品种分离菌株的耐药率,发现高密度养殖品种如杂交鳢,其多重耐药现象比其他品种更严重,多重耐药率高达55.00%;其次是畜禽复合养殖模式下混养的团头鲂和作为喂养鳜的饵料鱼麦鲮,其分离菌株多重耐药率分别为24.00%和10.53%;而一些经济价值相对较低的品种如罗非鱼和草鱼,其分离菌株多重耐药率较低,只有1.30%和0.46%。也有研究报道,工厂化养殖、高密度养殖或一些经济价值较高的品种,如鳗鲡、龟鳖和观赏鱼,其分离菌株多重耐药率远高于四大家鱼和虾等养殖品种(Deng et al.,2014;谭爱萍等,2014;吴小梅等,2015)。尽管本研究调查结果显示,水产养殖源气单胞菌对各种抗菌药物的耐药率总体水平不高,但对部分水产养殖常用抗菌药物如磺胺甲噁唑/甲氧苄啶、恩诺沙星和氟苯尼考的耐药率呈逐年上升趋势,其他类药物也存在耐药性递增的隐患。
4 结论
广东主要水产养殖区气单胞菌耐药率总体水平不高,耐药程度与养殖水平、用药习惯及养殖模式等有关,磺胺类耐药性已成为水产养殖细菌病害防治过程中最突出的问题,因此,非常有必要开展水产养殖病原菌耐药性监测,了解其发展趋势及传播风险,为评估水产品质量安全及指导临床科学用药提供科学依据。
参考文献:
丁正峰,薛晖,王晓丰,杨林. 2011. 江苏主要水产病原菌耐药谱系监测[J]. 江苏农业科学,39(2):344-347. [Ding Z F,Xue H,Wang X F,Yang L. 2011. Surveillance of resistance phenotypes in aquaculture pathogens from Jiangsu Province[J]. Jiangsu Agricultural Sciences,39(2):344-347.]
冯永永,姜兰,邓玉婷,谭爱萍,张瑞泉,罗理. 2016. 猪—鱼复合养殖模式中气单胞菌I类整合子的流行情况及其耐药特征[J]. 水产学报,40(1):92-99. [Feng Y Y,Jiang L,Deng Y T,Tan A P,Zhang R Q,Luo L. 2016. Prevalence and characterization of classⅠintegron in Aeromonas from pig-fish integrated farm[J]. Journal of Fisheries of China,40(1):92-99.]
葛阳杨,朱军莉,刘丽,任奕婧. 2017. 大黄鱼源气单胞菌的分离鉴定及致腐表型[J]. 水产学报,41(6):861-869. [Ge Y Y,Zhu J L,Liu L,Ren Y J. 2017. Spoilage phenotypic characterization and identification of Aeromonas isolated from spoiled Larimichthys crocea[J]. Journal of Fisheries of China,41(6):861-869.]
黄艳华,马沙,韩书煜,黄伟德,韦慕兰,蒙兰丽,吕小丽,覃惠明,李德壮,梁静真,黄钧. 2018. 2011—2016年广西罗非鱼源无乳链球菌的耐药谱型分析[J]. 南方农业学报,49(5):1023-1031. [Huang Y H,Ma S,Han S Y,Huang W D,Wei M L,Meng L L,Lü X L,Qin H M,Li D Z,Liang J Z,Huang J. 2018. Antibiogram types of Streptococcus agalactiae strains isolated from Oreochromis spp. in Guangxi during 2011-2016[J]. Journal of Southern A-griculture,49(5):1023-1031.]
李爱华,蔡桃珍,吴玉深,王伟俊. 2001. 我国鱼类病原——嗜水气单胞菌的耐药性研究[J]. 微生物学通报,28(1):58-63. [Li A H,Cai T Z,Wu Y S,Wang W J. 2001. Investigation on drug resistance of fish bacterial pathogen—Aeromonas hydrophila in China[J]. Microbiology China,28(1):58-63.]
李国烈,李林桂,房文红. 2012. 水产动物源细菌耐药性与预防控制[J]. 渔业信息与战略,27(4):316-321. [Li G L,Li L G,Fang W H. 2012. Antibiotic resistance of bacterial isolates from aquatic animals and its prevention and control[J]. Fishery Information and Strategy,27(4):316-321.]
李辉华,王广军. 2001. 常用渔药的种类、使用现状及规范化管理[J]. 河北渔业,(1):4-6. [Li H H,Wang G J. 2001. Classification,current application and standardized mana-gement of commonly used fishery drugs[J]. Hebei Fishe-ries,(1):4-6.]
梁静真,黄立春,韦慕兰,马沙,黎姗梅,文衍红,蒙兰丽,黄维,黄松,黄钧. 2018. 广西罗非鱼源无乳链球菌耐药性及其四环素耐药基因检测[J]. 南方农业学報,49(10):2077-2086. [Liang J Z,Huang L C,Wei M L,Ma S,Li S M,Wen Y H,Meng L L,Huang W,Huang S,Huang J. 2018. Detection of antibiotics resistance and tetracycline resistance genes in Streptococcus agalactiae from tilapia in Guangxi[J]. Journal of Southern Agriculture,49(10):2077-2086.]
刘训猛,方苹,陈静,袁锐,吴亚锋,习丙文. 2017. 江苏省渔源性嗜水气单胞菌耐药性分析[J]. 安徽农业科学,45(8):110-114. [Liu X M,Fang P,Chen J,Yuan R,Wu Y F,Xi B W. 2017. Analysis on drug resistance of fishery-source Aeromonas hydrophila in Jiangsu Province[J]. Journal of Anhui Agricultural Sciences,45(8):110-114.]
刘亚,杨锐,陈叶雨,宋明江,颜其贵,龚全,李强,杨焕超,赖见生. 2018. 达氏鲟维氏气单胞菌的分离鉴定及病理组织学观察[J]. 南方农业学报,49(6):1235-1241. [Liu Y,Yang R,Chen Y Y,Song M J,Yan Q G,Gong Q,Li Q,Yang H C,Lai J S. 2018. Isolation,identification of Aeromonas veronii in Acipenser dabryanus and its histological observations[J]. Journal of Southern Agriculture,49(6):1235-1241.]
孟思妤,孟长明,陈昌福. 2012. 水产养殖动物致病菌耐药性普查的意义(一)[J]. 科学养鱼,(3):86. [Meng S Y,Meng C M,Chen C F. 2012. Significance of surveillance on pathogenic antimicrobial resistance in aquatic animals (1)[J]. Scientific Fish Farming,(3):86.]
农业农村部渔业渔政管理局. 2018. 2018中国渔业统计年鉴[M]. 北京:中国农业出版社. [Fishery Administration of Ministry of Agriculture and Rural Affairs. 2018. China fishery statistical yearbook 2018[M]. Beijing:China Agriculture Press.]
谭爱萍,邓玉婷,姜兰,吴雅丽,冯永永,黄玉萍,罗理,王伟利. 2014. 养殖龟鳖源气单胞菌耐药性与质粒介导喹诺酮类耐药基因分析[J]. 水产学报,38(7):1018-1025. [Tan A P,Deng Y T,Jiang L,Wu Y L,Feng Y Y,Huang Y P,Luo L,Wang W L. 2014. Analysis of antimicrobial susceptibility and plasmid-mediated quinolone resistance genes in Aeromonas isolated from turtles[J]. Journal of Fisheries of China,38(7):1018-1025.]
汪建国. 2013. 我国渔药研究与应用综述(1)[J]. 渔业致富指,(1):78-80. [Wang J G. 2013. Research and application on fisheries drugs(1)[J]. Fishery Guide to be Rich,(1):78-80.]
王静波,徐立蒲,王小亮,曹欢,周增超,王姝. 2012. 北京地区养殖鱼类来源嗜水气单胞菌耐药性研究[J]. 北京农业,(30):77-80. [Wang J B,Xu L P,Wang X L,Cao H,Zhou Z C,Wang S. 2012. Study on the antibiotic resistance in Aeromonas hydrophila isolated from diseased fish in Beijing[J]. Beijing Agriculture,(30):77-80.]
王一娟. 2010. 江苏地区大宗淡水鱼养殖池塘气单胞菌分离、鉴定和遗传多样性研究[D]. 南京:南京农业大学. [Wang Y J. 2010. Studies on isolation,identification & genetic diversity of Aeromonas from conventional freshwater fish ponds in Jiangsu Province[D]. Nanjing:Nanjing Agriculture University.]
吴小梅,林茂,鄢庆枇,江兴龙,张娴. 2015. 美洲鳗鲡及其养殖水体分离耐药菌的多样性和耐药性分析[J]. 水产学报,39(7):1043-1053. [Wu X M,Lin M,Yan Q P,Jiang X L,Zhang X. 2015. Diversity and antimicrobial susceptibility of drug-resistant bacteria isolated from Anguilla rostrata and the farming water[J]. Journal of Fisheries of China,39(7):1043-1053.]
吴雅丽,邓玉婷,姜兰,谭爱萍,薛慧娟,王伟利,罗理,赵飞. 2013. 广东省水产动物源气单胞菌對抗菌药物的耐药分析[J]. 上海海洋大学学报,22(2):219-224. [Wu Y L,Deng Y T,Jiang L,Tan A P,Xue H J,Wang W L,Luo L,Zhao F. 2013. Antimicrobial susceptibilities of Aeromonas strains isolated from various aquatic animals in Guangdong Province[J]. Journal of Shanghai Ocean University,22(2):219-224.]
肖艳翼,王斌,夏永涛,胡利静,胡鲲,杨先乐. 2015. 鲟病原性温和气单胞菌的分离鉴定及药敏试验[J]. 南方农业学报,46(10):1909-1914. [Xiao Y Y,Wang B,Xia Y T,Hu L J,Hu K,Yang X L. 2015. Isolation,identification and drug sensitivity test of pathogenic Aeromonas sobria from sturgeon[J]. Journal of Southern Agriculture,46(10):1909-1914.]
张德锋,刘礼辉,李宁求,任燕,林强,石存斌,吴淑勤. 2015. 我国南方地区鱼源气单胞菌不同种类的流行特征[J]. 水产科学,34(11):673-682. [Zhang D F,Liu L H,Li N Q,Ren Y,Lin Q,Shi C B,Wu S Q. 2015. Epidemic cha-racteristic of different species of Aeromonas in diseased fish in Southern China[J]. Fisheries Sciences,34(11):673-682.]
钟晓霞,高上吉,孙静,王勉之,孙永学. 2017. 广东地区鸭—鱼混养场鸭粪中耐药基因的污染现状[J]. 中国兽医学报,37(11):2156-2162. [Zhong X X,Gao S J,Sun J,Wang M Z,Sun Y X. 2017. Pollution of antibiotic resistance genes of duck manure in duck-fish operation of Guangdong Province[J]. Chinese Journal of Veterinary Science,37(11):2156-2162.]
朱芝秀,何后军,邓舜洲,张文波,万根,邬向东,谢笑芳. 2012. 嗜水气单胞菌江西地区分离株耐药性及耐药质粒分析[J]. 江西农业大学学报,34(6):1262-1268. [Zhu Z X,He H J,Deng S Z,Zhang W B,Wan G,Wu X D,Xie X F. 2012. An analysis of the antibiotic resistance and plasmid profile Aeromonas hydrophila isolated from Jiangxi Province[J]. Acta Agriculturae Universitatis Jiang-xiensis,34(6):1262-1268.]
Borrell N,Acinas S G,Figueras M J,Martínez-Murcia A J. 1997. Identification of Aeromonas clinical isolates by restriction fragment length polymorphism of PCR-amplified 16S rRNA genes[J]. Journal of Clinical Microbiology,35(7):1671-1674.
Deng Y T,Wu Y L,Tan A P,Huang Y P,Jiang L,Xue H J,Wang W L,Luo L,Zhao F. 2014. Analysis of antimicrobial resistance genes in Aeromonas spp. isolated from cultured freshwater animals in China[J]. Microbial Drug Resistance,20(4):350-356.
Heuer H,Schmitt H,Smalla K. 2011. Antibiotic resistance gene spread due to manure application on agricultural fields[J]. Current Opinion in Microbiology,14(3):236-243.
Janda M J,Abbott S L. 2010. The genus Aeromonas:Taxonomy,pathogenicity and infection[J]. Clinical Microbiology Reviews,23(1):35-73.
Magiorakos A P,Srinivasan A,Carey R B,Carmeli Y,Falagas M E,Giske C G,Harbarth S,Hindler J F,Kahlmeter G,Olsson-Liljequist B,Paterson D L,Rice L B,Stelling J,Struelens M J,Vatopoulos A,Weber J T,Monnet D L. 2012. Multidrug-resistant,extensively drug-resistant and pandrug-resistant bacteria:An international expert propo-sal for interim standard definitions for acquired resistance[J]. Clinical Microbiology and Infection,18(3):268-281.
Martin-Carnahan A,Joseph S W. 2015. Aeromonas[M]//Kim S B, Goodfellow M. Bergeys Manual of Systematics of Archaea and Bacteria. doi:10.1002/9781118960608.
Miller R A,Harbottle H. 2018. Antimicrobial drug resistance in fish pathogens[J]. Microbiol Spectrum,6(1):1-20.
Santos L,Ramos F. 2018. Antimicrobial resistance in aquaculture:Current knowledge and alternatives to tackle the problem[J]. International Journal of Antimicrobial Agents,52(2):135-143.
Su H C,Ying G G,Tao R,Zhang R Q,Fogarty L R,Kolpin D W. 2011. Occurrence of antibiotic resistance and cha-racterization of resistance genes and integrons in Enterobacteriaceae isolated from integrated fish farms in South China[J]. Journal of Environmental Monitoring,13(11):3229-3236.
Yá?ez M A,Catalán V,Apráiz D,Figueras M J,Martínez-Murcia A J. 2003. Phylogenetic analysis of members of the genus Aeromonas based on gyrB gene sequences[J]. International Journal of Systematic and Evolutionary Microbiology,53(3):875-883.
Zhang R Q,Ying G G,Su H C,Zhou L J,Liu Y S. 2013. Antibiotic resistance and genetic diversity of Escherichia coli isolates from traditional and integrated aquaculture in South China[J]. Journal of Environmental Science and Health,48(11):999-1013.
(責任编辑 兰宗宝)
