牛黄对1型糖尿病小鼠主动脉僵硬度和内皮功能障碍的影响
2019-09-10刘锋马艳芳张静
刘锋 马艳芳 张静

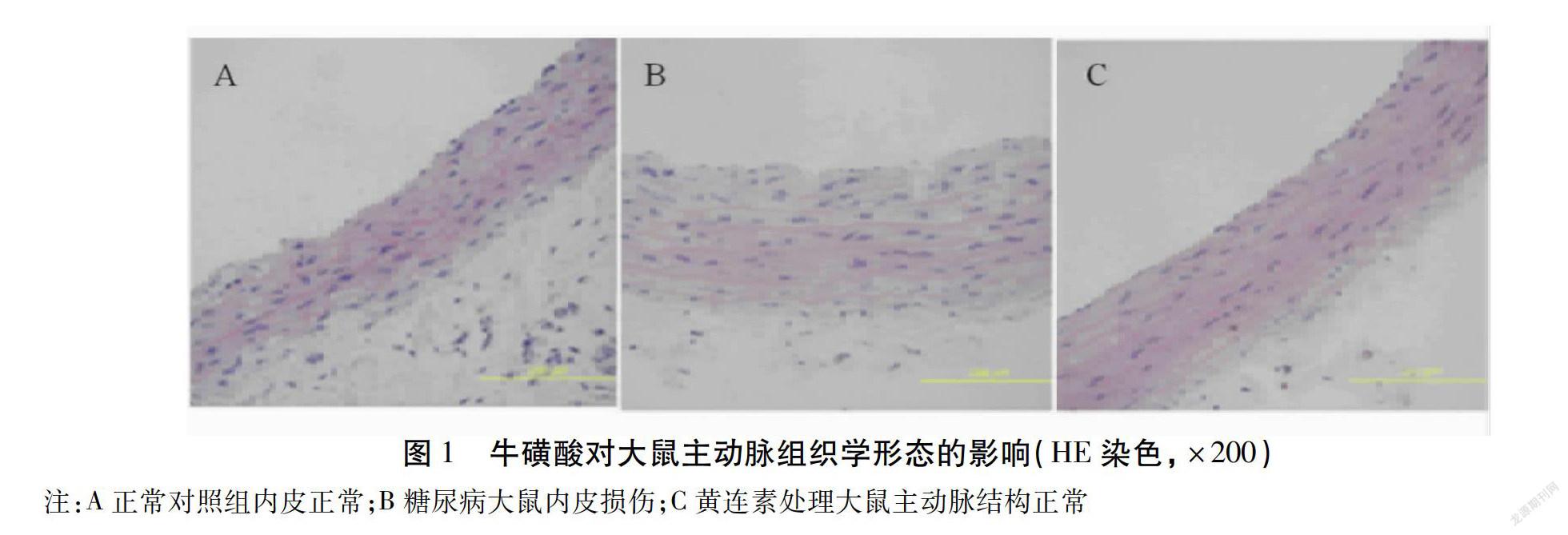
摘要 目的:研究牛黃的主要成分牛磺酸(Taurine)对1型糖尿病小鼠主动脉僵硬度和内皮功能障碍的影响。方法:健康的雄性C57BL/6J小鼠30只,随机分为CON组、MD组和MD+牛磺酸组,每组10只。采用SphygmoCor脉搏分析系统分析主动脉脉搏流速(APV)m/s、主动脉脉搏波增强指数(API)和主动脉脉搏波增强指数(AIX)等指标反映主动脉僵硬度;采用氧化酶法、放射免疫法分别检测血清葡萄糖水平和胰岛素含量;根据血管周围组织内皮依赖性扩张(EDD%)和内皮独立扩张(EID%)评价主动脉内皮功能;采用RT-PCR法、Western blot方法对胸主动脉组织细胞eNOS mRNA表达水平及eNOS在不同处理组细胞中蛋白表达情况进行测定。结果:MD组(MD组)与正常对照组(CON组)比较,其主动脉内膜破坏严重,内皮细胞的体积增大,甚至部分脱落和间隙增大,中膜平滑肌细胞排列紊乱。与MD组比较,MD+TUDCA组(MD+牛磺酸)组主动脉壁各层细胞的排列较整齐,病变减轻。MD+牛磺酸组小鼠体质量及空腹血清胰岛素水平差异无统计学意义(P>0.05),而空腹血糖升高至(22.4±4.6)mmol/L,ISI降低(P<0.05);且APV、API和AIX均减轻或降低,差异有统计学意义(P<0.05)。与MD比较,MD+牛磺酸组eNOS mRNA表达上调,牛磺酸可提高eNOS蛋白水平的表达(P<0.01)。结论:长期服用牛磺酸对1型糖尿病小鼠主动脉僵硬度有改善作用,还可以通过增加机体一氧化氮活性和提高机体抗氧化能力从而预防小鼠内皮功能障碍,其可能是治疗及预防糖尿病血管功能障碍的有效药物。
关键词 牛磺酸;1型糖尿病;内皮功能;主动脉硬化;脉搏波速度;血管周围组织
Effects of Taurine on Aortic Stiffness and Endothelial Dysfunction in Type 1 Diabetic Mice
Liu Feng, Ma Yanfang, Zhang Jing
(Department of Pediatrics, Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712083,China)
Abstract Objective:To study the effects of the main component of Calculus Bovis, Taurine on aortic stiffness and endothelial dysfunction in type 1 diabetic mice.Methods:A total of 30 healthy male C57BL/6J mice were randomly divided into a CON group(n=10), a MD group(n=10)and a MD+ Taurine group(n=10).Aortic pulse velocity(APV)m/s, aortic pulse wave enhancement index(API)and aortic pulse wave enhancement index(AIX)were analyzed by SphygmoCor pulse analysis system to reflect aortic stiffness.Oxidase and radioimmunoassay were used to measure serum glucose levels and insulin levels, respectively.According to the endothelial-dependent dilation(EDD%)and endothelial-independent dilation(EID%), the endothelial functionob in peripheral tissues was evaluated.The expression level of eNOS mRNA in aortic tissue and expression of eNOS protein in cells of different treatment groups were measured by RT-PCR and Western blot.Results:Compared with the normal control group(CON group), the model group(MD group)mice showed more serious aortic intima destruction, the volume of endothelial cells was significantly increased, even partial shedding, and the arrangement of mesangial smooth muscle cells was disordered.Compared with the MD group, cells in the aortic wall of the sulfonated deoxycholic acid intervention group(MD+Taurine)were arranged orderly and the lesions were significantly reduced.There was no significant difference in body weight and fasting serum insulin level(P>0.05).However, fasting blood glucose was significantly increased to (22.4±4.6)mmol/L, while ISI, APV, API and AIX were reduced or decreased, with statistically significant differences(P<0.05).Compared with MD group, eNOS mRNA expression in MD+Taurine group was significantly increased.The results indicated that the expression level of eNOS protein was significantly increased by sulphuric deoxycholic acid and the difference was statistically significant(P<0.01).Conclusion:Sulfonic deoxycholic acid has an effect on aortic stiffness in type 1 diabetic mice, and it can prevent endothelial dysfunction in mice by increasing nitric oxide activities and increasing antioxidant capacity.It may be an effective medicine for the prevention and treatment of diabetic vascular dysfunction.
Key Words Taurine; Diabetes mellitus type 1; Endothelial function; Arteriosclerosis; Aorta pulse wave velocity; Perivascular tissue
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.12.018
目前,1型糖尿病(Type 1 Diabetes Mellitus,T1DM)患者的数量有增无减,在美国2 500多万人患有T1DM,另外,还有5 000万人诊断属于糖尿病前期[1]。在众多与T1DM相关的疾病中,心血管疾病(Cardiovascular Disease,CVD)是最常见和最严重的。T1DM患者一生中发生CVD的可能性是非糖尿病患者的两倍多,CVD是糖尿病患者最常见的死亡原因,占糖尿病相关死亡的近70%[2-3]。连接T1DM和CVD的关键之一是血管功能障碍的发展,尤其是血管功能障碍的2个组成部分导致与糖尿病相关的CVD,包括动脉硬化和内皮功能障碍。动脉硬化和内皮功能障碍都是心血管疾病的临床表现,两者都是未来T1DM心血管事件的独立预测因子[4-6]。因此,许多专家学者为确定糖尿病动脉硬化和内皮功能障碍的潜在原因已经作出了相当大的努力。尽管付出很大的努力,但导致其发展的起始事件仍不清楚。
一氧化氮合成酶(Nitric Oxide Synthase,eNOS)首次由Forstermann和Poiiock在内皮细胞中发现,其广泛有于血管内皮细胞、血小板、肾小管上皮细胞和一些能产生少量一氧化氮的其他类型细胞,一种旨在恢复内质网稳态[7]的自适应通路。虽然eNOS是防御内质网应激的第一道防线,但eNOS的慢性激活会导致细胞功能障碍和死亡,它已被牵连到心包代谢疾病的病理生理学[8-9]。eNOS应激的治疗方法,如化学伴侣牛磺酸(牛磺酸),已被证明可以缓解与内质网应激相关的几种心血管代谢疾病[10-11]。
中医学理论认为动脉僵硬度的增加和痰浊与瘀血密不可分,心主血脉,肺朝百脉,肝藏血,肾藏精,精血同源,因此痰浊与瘀血的发生同肺脾肾三脏功能的失常具有重要关系,痰浊和瘀血是动脉粥样硬化引发的临床表现。牛黄(Calculus Bovis)有益气强心、温通化湿的功效。牛黄的主要成分牛磺酸可以增加心肌的缺氧耐受性,增强冠状动脉的血液流量减少冠脉痉挛的发生;能清除体内自由基,减少炎性反应性反应的发生,有效减少心肌的耗氧量;可提高心肌的收缩能力。因此,本研究旨在探讨牛磺酸(Taurine)对T1DM小鼠主动脉僵硬度和内皮功能障碍的影响。
1 材料与方法
1.1 材料
1.1.1 动物 健康的雄性C57BL/6J小鼠30只,体质量(200~250)g,饲养于屏障系统的动物房,光照周期12 h,温度(25±3)℃,相对湿度55%~60%。所有大鼠正常活动,每天自由饮水及进食。所有的实验动物程序都符合动物护理和使用委员会的审查和批准。
1.1.2 药物 牛磺酸注射液(重庆制药六厂,生产批号018254);生理盐水(上海信谊药厂,生产批号:019433)。
1.1.3 试剂与仪器 Trizol(Life Technologies,Grand Island,NY,USA);SphygmoCor脉搏分析系统;压力肌电室(DMT Inc.,亚特兰大,GA,美国);小动物监护仪(MouseMonitor S,Indus Instruments,美国);iScript(美国Bio-Rad大力神,CA);二辛可宁酸蛋白质测定试剂盒(Pierce Biotechnology,USA)。
1.2 方法
1.2.1 分组与模型制备 T1DM模型NOD小鼠(动物的来源:中国啮齿类实验动物中心上海分公司;体质量18~22 g;8周龄)。生物学特性:NOD小鼠自身免疫性胰岛炎最早发生于4周龄,于12周龄时出现明显糖尿病症状。发病后,在几周的时间内,血糖迅速升高,饮水量剧增,大量地排尿,体质量迅速下降,在这个过程中,患鼠血糖呈先迅速上升,后逐步下降,但仍维持高于正常值的状态,体质量直线下降,最后昏迷而死亡。判定指标:NOD糖尿病小鼠与同周龄正常NOD小鼠比较,体质量明显减轻,血糖明显升高。采尾血检测小鼠空腹血糖,空腹血糖≥16.7 mmol/L则模型成功。将制备成功的T1DM小鼠20只随机分为MD组(10只);经腹腔注射牛磺酸组(10只)于STZ用药1周后开始每日250 mg/kg,连续4周。在4周的干预后,所有小鼠大约6个月大时被处死。小鼠分为3组:1)CON组;2)MD组;3)MD+TUDCA组,每组小鼠10只。
1.2.2 干预方法 用异氟醚麻醉小鼠,心脏穿刺抽血处死小鼠。在冰冷生理盐水(PSS:0.288 g NaH2PO4,1.802 g葡萄糖,0.44 g丙酮酸钠,20.0 g BSA,21.48 g NaCl,0.875 g KCl,0.7195 g MgSO4·7H2O,13.9 g MOPS钠盐在pH值7.4下,每升溶液EDTA为0.185 g,并在液氮中闪冻,以供日后分析。简单地说,颈动脉和二级肠系膜动脉在冰冷的PSS中切除,放置在装有热PSS的压力肌电室(DMT Inc.,亚特兰大,GA,美国)中,置入玻璃微管,用縫合线固定。
1.2.3 检测指标与方法
1.2.3.1 血清生化指标测定 小鼠检测体质量/周和空腹血糖/周。小鼠于喂养4周后,采剪尾血检空腹血糖,以放射免疫法测定空腹血清胰岛素水平,并计算胰岛素敏感指数(Insulin Sensitivity In-dex,ISI)进而评价模型优劣,小鼠体质量、血糖、血清胰岛素水平和胰岛素抵抗指数的测定,计算公式:ISI=In[1/(空腹血糖×空腹血清胰岛素)]。
1.2.3.2 主动脉僵硬度分析 采用SphygmoCor脉搏分析系统分析主动脉脉搏流速(m/s)、主动脉脉搏波增强指数(API)和主动脉脉搏波增强指数(AIX)等指标反映主动脉僵硬度,比较2组患者治疗前后上述诸指标变化间差异。用2%异氟醚和氧在2 L/min时对小鼠进行麻醉,仰卧在加热板上,腿固定在心电图电极上,通过调整异氟醚浓度,维持目标心率约为450次/min。多普勒探針(20 mhz;鼠标多普勒数据采集系统;在横断主动脉弓和腹主动脉放置小动物监护仪(Indus Instruments,美国),用精密卡尺测量探针之间的距离。预射时间,即心电图的r波和多普勒信号的脚之间的时间,被确定为每个位点。主动脉脉搏波速度(aPWV)的计算方法是将探针之间的距离(cm)除以胸腔和腹腔区域的预射时间(s)差。
1.2.3.3 血管超声检测血管内皮功能 Accuson 128×P/10超声仪在肘关节上2~10 cm描记右肱动脉长轴二维图像,调节深度及增益得到最清晰的动脉壁与腔的分界面,所有的图像均录像在VHS录像带上,同时通过CVI acquirsion软件,每3 s输入计算机1幅舒张期图像。第1 min的扫描后,袖带充气至300 mm Hg(1 mm Hg=0.133 kPa),持续5 min后放气并诱发反应性高血流,再持续记录3 min的图像,休息10 min后,再描记1 min基础图像后,舌下给予0.4 mg硝酸甘油喷雾剂,再记录5 min。图像分析:用CVI分析软件,测量动脉内膜面至内膜面。内皮依赖性扩张(EDD%):内皮依赖的血流量介导的扩张反应[FMD(%)]=100×(D最大值-D基础值)/D基础值。内皮独立扩张(EID%):硝酸甘油介导的扩张反应[GTN-MD(%)]=100×(D最大值-D基础值)/D基础值。
1.2.3.4 总RNA分离提取,cDNA合成和实时荧光PCR 使用Trizol(Life Technologies,Grand Island,NY,USA)进行主动脉和PVAT RNA的分离。互补脱氧核糖核酸合成使用iScript(美国Bio-Rad大力神,CA)从0.25 μg/μL RNA 20 μL反应。引物序列见表1。样本运行在重复使用一个iCycler和智商SYBR绿色Supermix(Bio-Rad)两步放大(95 ℃ 10 min,其次是退火30 min 60 ℃)总共40循环。基因的表达模式是标准化的持续表达β2微球蛋白基因作为参考。数据归一化,计算每个样本的△Cq派生的减去Cq参考基因的基因的兴趣。相对定量(△△Cq)被减去派生的△Cq实验样本的平均△Cq对照组。计算2△△Cq褶皱变化差异。
1.2.3.5 eNOS蛋白表达水平的测定 秤取小鼠主动脉以提取总蛋白,使用二辛可宁酸蛋白质测定试剂盒(Pierce Biotechnology,USA)通过BCA方法定量蛋白质浓度。然后,将30 μg蛋白质加载到6%~10%聚丙烯酰胺凝胶上进行电泳,然后电转移到聚偏二氟乙烯(PVDF)膜上。在室温下用5%脱脂乳封闭印迹1 h,并在4 ℃下在以下(1∶200稀释)一抗中孵育过夜。用Tris-bu加入盐水冲洗后0.1%吐温-20,将印迹(1∶500稀释)与二抗在室温下孵育1 h。然后使免疫印迹与SuperSignal West Pico Substrate反应,使用成像系统检测化学发光,并使用Quantity One软件进行光密度分析,测定与β-肌动蛋白的各条带灰度比值,以反映目的蛋白表达水平。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析;计量资料采用“均数±标准差”(±s)表示,组间比较采用单因素方差分析或者重复测量的方差分析,组间两两比较采用LSD-t检验;计数资料采用百分率(%)表示,组间比较采用χ2分析;以P<0.05为差异有统计学意义。
2 结果
2.1 牛磺酸对小鼠胸主动脉形态学 HE染色后在放大200倍的光学显微镜下观察,结果如图1所示。CON组小鼠的主动脉内膜光滑,内皮细胞组织完整,无缺损和增厚现象;且中膜层的平滑肌细胞清晰可见,排列整齐,无增生。MD组(MD组)与正常对照组(CON组)比较,其主动脉内膜破坏严重,内皮细胞的体积增大,甚至部分脱落和间隙增大,中膜平滑肌细胞排列紊乱。与MD组比较,MD+TUDCA组(MD+牛磺酸)组主动脉壁各层细胞的排列较整齐,病变减轻。
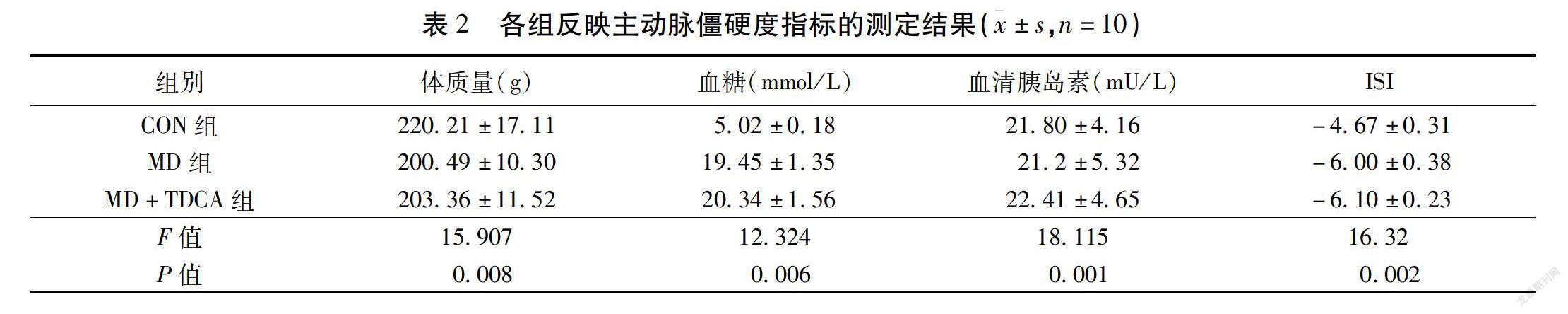
2.2 小鼠体质量、血糖、血清胰岛素水平和胰岛素抵抗指数的测定 与正常对照组比较,MD+TUDCA组(MD+TUDCA组)小鼠体质量及空腹血清胰岛素水平均差异无统计学意义(P>0.05),而空腹血糖升高至(22.4±4.6)mmol/L,ISI降低(P<0.05),差异有统计学意义(P<0.05)。见表2。
2.3 各组反映主动脉僵硬度指标的测定结果 结果比较分析表明,与MD组比较,MD+TUDCA组(MD+TUDCA组)主动脉脉波流速、主动脉脉搏波增强指数及主动脉膨胀度均减轻或降低(P<0.05),差异有统计学意义(P<0.05)。见表3。
2.4 各组血管内皮功能评估结果 为了检查动脉血管内皮功能的区域差异,我们评估了CON组和MD组小鼠的EDD。MD组小鼠动脉EDD受损,与ER应激抑制剂牛磺酸一起孵育1 h后,从同一小鼠分离出的其他肠系膜动脉EDD增加(35.12±6.13)%差异有统计学意义(P<0.05),MD和MD+牛磺酸组动脉EID差异无统计学意义(P>0.05)。见表4。
2.5 实时荧光定量PCR法测定mRNA相关基因表达 各组小鼠eNOS mRNA表达的水平。与CON组(CON组)比较,MD组中eNOS mRNA表达水平下降(P<0.01);与MD比较,MD+牛磺酸组eNOS mRNA表达上调,差异有统计学意义(P<0.01)。见表5,图2。
2.6 Western blot法检测蛋白水平表达 Western blot法检测eNOS蛋白水平表达结果显示,与CON组(CON组)比较,MD组中eNOS蛋白水平表达降低(P<0.05)。由此可知,牛磺酸可著提高eNOS蛋白水平的表达。见表6,图3。
3 讨论
糖尿病是一种严重影响人类健康的常見和多发病,具有致残和病死的危险。会快速发展的动脉粥样硬化(Athrosclero-sis,As)导致糖尿病[12]。以前的研究证实[13]急性动脉内注射5-甲基四氢叶酸(C-5-methyltetrahydrofolate,5-NTTHF)可提高T1DM患者的局部血管内皮功能。此外,长期口服叶酸对T1DM血管内皮功能的研究表明[14],其可预防和改善T1DM内功能的损伤。但是牛磺酸对T1DM主动脉僵硬度和内皮功能的影响未见报道。本文用T1DM小鼠模型研究牛磺酸对T1DM内皮功能影响及机制进行了探究。
“中焦受气取汁,变化而赤是为血”(《灵枢·决气》),血行脉中,“血载气,气行血”,“气为血之帅”,“血为气之母”。而“血气不和,百病乃变化而生”(《素问·调经论》)。络病学说讲络气郁滞或虚气留滞与神经内分泌免疫调节功能异常及血管内皮功能障碍机制相类似。牛黄是脊索动物门哺乳纲牛科动物牛胆囊的胆结石,牛磺酸是牛黄的主要活性成分。牛黄(Calculus Bovis)有益气强心、温通化湿的作用。牛磺酸具有内皮保护、抗氧化、抗内源性损伤、降低高胆固醇血症、抗平滑肌细胞增殖和凋亡等作用。牛磺酸调节多种细胞的功能,包括抗氧化作用、离子运动的调节、神经递质的调节及与胆汁酸的结合等。研究证实,牛磺酸对胰岛素依赖性、非胰岛素依赖性以及胰岛素耐受性的1型早发型糖尿病的有效性。牛磺酸有利于防治T1DM患儿的并发症,包括视网膜病变、肾病、神经病变、动脉粥样硬化和心肌病。
糖尿病患者由于基质发生退化并出现弹力层破碎与断裂,使得胶原与钙质发生沉积,主动脉与大动脉的扩张造成动脉僵硬度的增加,而对于病程较长的患者还会由于糖基化的终产物通过血管的内皮功能修复剂炎性反应性反应造成动脉僵硬度的增加。本研究首次证明牛磺酸对动脉硬化具有保护作用。结果显示,MD组(MD组)与正常对照组(CON组)比较,其主动脉内膜破坏严重,内皮细胞的体积增大,中膜平滑肌细胞排列紊乱。MD+牛磺酸组主动脉壁各层细胞的排列较整齐,病变减轻。MD+牛磺酸组小鼠空腹血糖升高,ISI降低;且APV、API和AIX减轻或降低。eNOS mRNA表达上调,表明牛磺酸提高eNOS蛋白水平的表达。MD小鼠肠系膜动脉EDD受损,而颈动脉未发现损伤。沿着动脉差异功能的这一发现证实肠系膜动脉比颈动脉更容易受到代谢紊乱的影响。Kozakova M[15]发现,牛磺酸给药可以逆转高脂饮食引起的内皮功能障碍和主动脉内质网应激。eNOS酶是二聚体结构,含有相同的2个亚基,每个亚基分为2个区,C-端为还原酶区,烟酰胺腺嘌呤二核苷酸(NADPH)及钙调蛋白(CaM)结合位点;N-端为氧化酶区,含四氢生物蝶呤(BH4)、血红素和L-精氨酸等结合位点。eNOS可催化黄素介导的电子从结合NADPH的C末端转移至N末端氧化酶区的血红素。最近,Fountoulakis N等[16]人报道牛磺酸恢复了转基因MD小鼠对乙酰胆碱的反应。除了Fountoulakis N等报道的牛磺酸对冠状动脉内皮功能的有益作用外,Camila M等[17]对牛磺酸改善了外周血管内的内皮功能(即血管内皮功能)。DB小鼠的EID被削弱,这些小鼠的内皮细胞和底层平滑肌细胞都有广泛的血管功能障碍。然而,牛磺酸对EID反应没有影响,说明牛磺酸的保护作用是针对EDD的。与之前的研究一致,Ikonomidis I等[18]研究发现慢性牛磺酸治疗降低了DB小鼠的动脉硬化。这与其他证明MD小鼠aPWV比CON小鼠升高的研究结果一致。
研究表明[18-20]急性牛磺酸治疗和慢性牛磺酸治疗均未完全逆转血管功能障碍。这可能是由于牛磺酸对ER应激的不完全抑制,而ER应激标志物在主动脉和PVAT中的部分减少支持了内质网应激。另外,它可能表明其他因素,独立于内质网应激,导致DB小鼠的血管损伤。研究表明[21-24]在被检测的4种UPR递质中,eNOS mRNA通常是在基因水平而不是蛋白水平上确定的,因为去除26个核苷酸内含子会导致eNO翻译。在剩余的UPR标记中缺乏蛋白质表达量有限制作用。MD/mb小鼠菌株是T1DM研究中经常使用的菌株;然而,动物模型在代谢紊乱的严重程度和对人类疾病的适用性方面并非没有一定的局限性。
总之,尽管仍有许多问题没有得到解答,但牛磺酸可以改善MD小鼠的EDD,降低动脉硬化,其可能是治疗及预防糖尿病血管功能障碍的新药物。
参考文献
[1]Lee DM,Battson ML,Jarrell DK,et al.SGLT2 inhibition via dapagliflozin improves generalized vascular dysfunction and alters the gut microbiota in type 2 diabetic mice[J].Cardiovasc Diabetol,2018,17(1):62.
[2]Oikonomou E,Antonopoulos A,Gouliopoulos N,et al.Arteriosclerosis and endothelial function are used to assess the risk of new diabetic retinopathy in type 2 diabetes[J].Journal of the American College of Cardiology,2018,71(11):A2085.
[3]Moreno B,de Faria AP,AMV R,et al.Glycated hemoglobin correlates with arterial stiffness and endothelial dysfunction in patients with resistant hypertension and uncontrolled diabetes mellitus[J].J Clin Hypertens(Greenwich),2018,20(5):910-917.
[4]CRL C,Leite NC,Salles GC,et al.Aortic stiffness and ambulatory blood pressure as predictors of diabetic kidney disease:a competing risks analysis from the Rio de Janeiro Type 2 Diabetes Cohort Study[J].Diabetologia,2018,61(2):455-465.
[5]Abdu F,Mai A.Effect of Conjugated Bile Salt Taurine on Mice Colonic Motor Activity[J].Periodicum Biologorum,2016,118(2):124-126.
[6]James L,Yan K,Pence L,et al.Comparison of Bile Acids and Acetaminophen Protein Adducts in Children and Adolescents with Acetaminophen Toxicity[J].PLoS One,2015,10(7):e0131010.
[7]Dos SKM,Vieira AD,Salles HO,et al.Safety,beneficial and technological properties of Enterococcus faecium isolated from Brazilian cheeses[J].Braz J Microbiol,2015,46(1):237-249.
[8]Gray DW,Welsh MD,Doherty S,et al.Identification of systemic immune response markers through metabolomic profiling of plasma from calves given an intra-nasally delivered respiratory vaccine[J].Vet Res,2015,46(14):7-8.
[9]Aguiari P,Iop L,Favaretto F,et al.In vitro comparative assessment of decellularized bovine pericardial patches and commercial bioprosthetic heart valves[J].Biomed Mater,2017,12(1):015021.
[10]Boncelj SM,Eren B,Kanc K,et al.Impaired endothelial function and arterial stiffness in patients with type 2 diabetes-The effect of a very low-dose combination of fluvastatin and valsartan[J].J Diabetes Complications,2017,31(3):544-550.
[11]Solini A,Giannini L,Seghieri M,et al.Dapagliflozin acutely improves endothelial dysfunction,reduces aortic stiffness and renal resistive index in type 2 diabetic patients:a pilot study[J].Cardiovasc Diabetol,2017,16(1):138.
[12]Tuttolomondo A,Casuccio A,Guercio G,et al.Arterial stiffness,endothelial and cognitive function in subjects with type 2 diabetes in accordance with absence or presence of diabetic foot syndrome[J].Cardiovasc Diabetol,2017,16(1):2.
[13]Hanis CL,Redline S,Cade BE,et al.Beyond type 2 diabetes,obesity and hypertension:an axis including sleep apnea,left ventricular hypertrophy,endothelial dysfunction,and aortic stiffness among Mexican Americans in Starr County,Texas[J].Cardiovasc Diabetol,2016,15(8):86.
[14]Ayta MB,Deveci M,Bek K,et al.Effect of cholecalciferol on local arterial stiffness and endothelial dysfunction in children with chronic kidney disease[J].Pediatr Nephrol,2016,31(2):267-77.
[15]Kozakova M,Morizzo C,Fraser AG,et al.Impact of glycemic control on aortic stiffness,left ventricular mass and diastolic longitudinal function in type 2 diabetes mellitus[J].Cardiovasc Diabetol,2017,16(1):78.
[16]Fountoulakis N,Thakrar C,Patel K,et al.Increased Arterial Stiffness is an Independent Predictor of Renal Function Decline in Patients With Type 2 Diabetes Mellitus Younger Than 60 Years[J].J Am Heart Assoc,2017,6(4).
[17]Manrique C,Habibi J,Aroor AR,et al.Dipeptidyl peptidase-4 inhibition with linagliptin prevents western diet-induced vascular abnormalities in female mice[J].Cardiovasc Diabetol,2016,15(8):94.
[18]Ikonomidis I,Pavlidis G,Lambadiari V,et al.P673Improvement of arterial stiffness and myocardial deformation in patients with poorly controlled diabetes mellitus type 2 after optimization of antidiabetic medication[J].Eur Heart J Cardiovasc Imaging,2016,17(2):ii136-ii143.
[19]Hegyi I,Szabo T,Szele E,et al.Association between increased arterial stiffness and HbA1c and LDL cholesterol level in type 2 diabetes patients[J].Artery Research,2016,16(6):60.
[20]Jennersj P,Ludvigsson J,Lnne T,et al.Pedometer-determined physical activity level and change in arterial stiffness in Type 2 diabetes over 4 years[J].Diabet Med,2016,33(7):992-997.
[21]Guo L I,Lan J W,Zheng W,et al.Synthesis and Characterization of Novel Copolyesters Poly(ethylene-2,5-thiophenedicarboxylate-co-terephthalate)[J].China Plastics Industry,2018,5(1):28-29.
[22]Chen J,Shi M,Wang N,et al.TSH inhibits eNOS expression in HMEC-1 cells through the TSHR/PI3K/AKT signaling pathway[J].Ann Endocrinol(Paris),2019,80(5):273-279.
[23]Shang W,Cai T,Zhang Y,et al.Facile one pot pyrolysis synthesis of carbon quantum dots and graphene oxide nanomaterials:All carbon hybrids as eco-environmental lubricants for low friction and remarkable wear-resistance[J].Tribology International,2017,118(2):56-58.
[24]Schadt HS,Wolf A,Mahl JA,et al.Bile Acid Sequestration by Cholestyramine Mitigates FGFR4 Inhibition-Induced ALT Elevation[J].Toxicol Sci,2018,163(1):265-278.
[25]Silva RO,Bingana RD,TMAL S,et al.Role of TRPV1 receptor in inflammation and impairment of esophageal mucosal integrity in a murine model of nonerosive reflux disease[J].Neurogastroenterol Motil,2018,3(23):13340-13341.
(2019-04-30收稿 責任编辑:王明)
