乌梅丸对免疫性结肠炎大鼠NF-κB、IL-10的影响
2019-09-10沈洋赵欢潘一鸣吕鹏曾志豪李亚侯丽
沈洋 赵欢 潘一鸣 吕鹏 曾志豪 李亚 侯丽

摘要 目的:探讨乌梅丸为对免疫性结肠炎大鼠核转录因子NF-κB及抑炎性因子IL-10表达的影响。方法:实验动物40只随机分为正常对照组、模型组、阳性对照组、乌梅丸低剂量组、乌梅丸高剂量组,半抗原2,4,6-三硝基苯磺酸(TNBS)加乙醇局部灌肠复制免疫性结肠炎模型,每天进行疾病活动指数(TDI)评分,ELISA测定大鼠血清IL-10水平,Western Blot法测定病变结肠组织NF-κB表达水平。结果:模型大鼠造模给药后出现便血、稀便、精神萎靡、解剖观察结肠黏膜组织有溃疡形成;与正常对照组比较,模型组大鼠血清IL10水平降低、结肠黏膜组织NF-kB表达升高(P<0.05);给药处理后,各组NF-kBp65表达较模型组均降低,其中乌梅丸低剂量组降低最为显著;阳性对照组血清IL-10表达升高,乌梅丸低剂量组、乌梅丸高剂量组降低(P<0.05)。结论:乌梅丸对免疫性结肠炎大鼠炎性活化过程中NF-kBp65激活有显著抑制作用,从而抑制其下游炎性因子表达,降低损伤,血清中IL-10的低表达可能与乌梅丸募集IL-10向结肠病变组织减少损伤相关。
关键词 乌梅丸;甲泼尼龙片;免疫治疗;不良反应;免疫性结肠炎;IL-10;NF-κB;TDI评分
Effect of Wumei Pills on NF-κB and IL-10 in Mice with Immunotherapy-Induced Colitis
Shen Yang,Zhao Huan,Pan Yiming,Lyu Peng,Zeng Zhihao,Li Ya,Hou Li
(Dongzhimen Hospital,Beijing University of Chinese Medicine,Beijing 100700,China)
Abstract Objective:To investigate the effect of Wumei Pills on the expression of NF-κB and IL-10 in rats with immune colitis.Methods:A total of 40 experimental animals were randomly divided into a normal control group,a model group,a positive control group,a Wumei Pills low-dose group,high-dose group.Colitis was induced in mice by intracolonic instillation of 2,4,6-trinitrobenzenesulfonic acid(TNBS).Disease activity index(DAI)score was recorded daily for colitis assessment.Serum IL-10 level was measured by ELISA and NF-κB expression was determined by Western blotting.Results:A model was considered a success when bloody and loose stool,sluggishness,and ulcerative lesions of the colonic mucosa were observed upon intracolonic instillation of TNBS.Compared with the normal control group,there was a decrease in serum IL-10 level and an increase in NF-κB expression in the model group(P<0.05).Upon herbal intervention,NF-κB p65 expression in each group was lower than that in the model group,with the Wumei Pills low-dose group showing the most significant difference.Serum IL-10 level increased in the positive control group and decreased in both the Wumei Pills low-dose and high-dose groups(P<0.05).Conclusion:Wumei Pills significantly inhibits the activation of NF-κBp65 during inflammatory activation in rats with immune colitis,thereby inhibiting the expression of downstream inflammatory factors and reducing damage.The reduction of tissue damage by Wumei Pills might be associated with low serum IL-10 level.
Key Words Wumei Pills; Methylprednisolone; Immunotherapy; Side effects; Immune colitis; IL-10; NF-κB; TDI
中圖分类号:R289文献标识码:Adoi:10.3969/j.issn.1673-7202.2019.12.019
以免疫检查点抑制剂为代表肿瘤免疫治疗是继靶向治疗后又一种新兴的治疗手段。免疫检查点抑制剂通过解除肿瘤局部微环境免疫抑制,进而促使效应T细胞恢复特异性识别功能进而杀伤肿瘤细胞。正常组织免疫抑制受到破坏可导致自身免疫耐受受到损害,进而导致免疫治疗相关不良反应(Immune-related Adverse Events,irAEs),常见受累部位包括皮肤、消化道、肝脏、甲状腺等,结肠炎是最常见的消化道不良反应之一,免疫治疗导致的免疫功能紊乱是免疫治疗相关性结肠炎的病因所在,发病与溃疡性结肠炎类似。本研究参考免疫性结肠炎模型,观察乌梅丸对结肠炎大鼠血清IL-10、病变结肠黏膜NF-κB影响,探讨乌梅丸是否可以从调节免疫角度改善免疫性结肠炎性反应状,为今后肿瘤免疫治疗不良反应的临床策略提供思路。
1 材料与方法
1.1 材料
1.1.1 动物 Sprague Dawley大鼠40只,雄性,体质量(25010)g,购于北京维通利华实验动物技术有限公司,SPF级。动物许可证号:SCXK-(京)2013-0035。动物饲养环境温度(24±2)℃,相对湿度(50±10)%,自由摄食饮水,12 h/12 h明暗交替。
1.1.2 药物 卓美乐(甲泼尼龙片,Pfizer Italia SrI公司产品,T96680),购于北京中医药大学东直门医院,乌梅丸颗粒剂(乌梅24 g、细辛9 g、干姜15 g、黄连24 g、当归6 g、黑附子9 g、蜀椒6 g、桂枝9 g、党参9 g、黄柏9 g)由北京康仁堂药业有限公司提供。
1.1.3 试剂与仪器 2,4,6-三硝基苯磺酸(TNBS,美国sigma公司,批号:P2297);白细胞介素-10(IL-10)ElISA试剂盒(abcam,批号:ab100764);NF-κB p65山羊抗小鼠一抗(MDL公司,批号:MD2142),β-actin山羊抗兔一抗(MDL公司,批号:MD2141),酶标仪(BIO-RAD,型号:550),电热恒温水浴槽(上海一恒恒温设备厂,型号:HWS-24);-80 ℃低温冰箱[日本SANYO,型号:MDF-C8V(N)]4 ℃低温冰箱(青岛海尔冰箱股份有限公司,型号:HXC-106);制冰机(美国SCOTSMAN,型号:AF10);PVDF膜(0.22 μm)(美国Millipore,型号:ISEQ00010);3MM滤纸(英国Whatman,型号:3030861);脱色摇床(海门其林贝尔仪器制造公司,型号:TS-100);旋涡混匀器(海门麒麟医用仪器厂,型号:XW-80A);电泳仪(北京百晶生物技术有限公司,型号:BG-subMIDI);低温离心机(Sigma,型号:3-30K);SDS-PAGE电泳系统(美国BIO-Rad,型号:1645056);凝胶成像系统(美国UVP,型号:GelDoc-It310);ChemiDoc MP化学发光成像系統(美国Bio-rad,型号:170-8280)。
1.2 方法
1.2.1 分组与模型制备 分组:造模32只大鼠随机分为模型组、阳性对照组、乌梅丸低剂量组、乌梅丸高剂量组,每组8只。模型制备:超净工作台下先配制50%乙醇溶液,然后和50 g/L的TNBS等体积混合制成免疫复合物,造模前现用现配。大鼠禁食(不禁水)24 h,10%水合氯醛腹腔麻醉(0.3 mL/100 g)后仰卧位固定于木板,食用油涂抹肛周,32只大鼠按照TNBS 100 mg/kg剂量用2 mm硅胶管(食用油润滑)连接注射器由肛门插入8 cm局部灌肠1次,再注入0.5 mL空气,注射完毕动物头部向下木板微微倾斜约30° 2 min,从木板取下大鼠归笼,自然苏醒,恢复饮食。其余8只大鼠同样方法给予等量0.9%氯化钠溶液。
1.2.2 给药方法 模型组按1 mL/100 g灌胃生理盐水,阳性对照组按2 mg/kg卓美乐水溶液,乌梅丸低剂量组按照生药量13.4 g/kg灌胃乌梅丸药液,乌梅丸高剂量组按照生药量26.8 g/kg灌胃乌梅丸药液,于造模3 d后开始灌胃给药,1次/d,连续给药14 d。
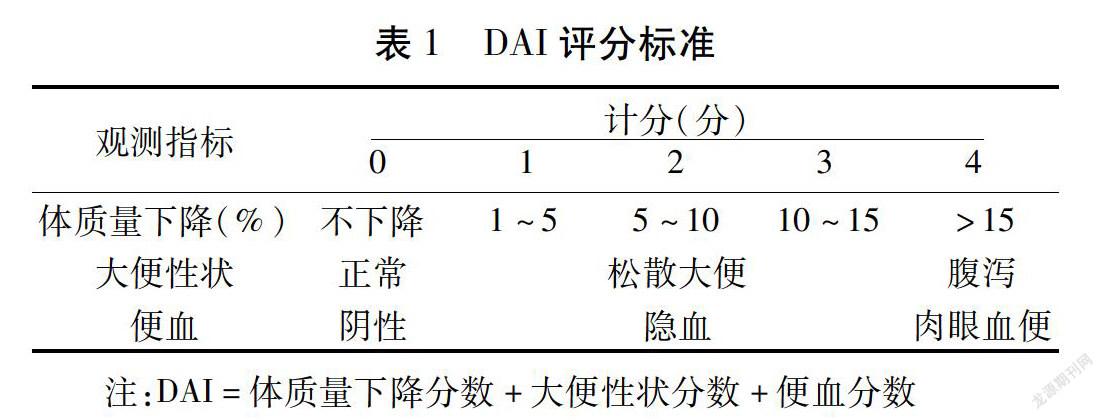
1.2.3 检测指标与方法 给药期间每天记录体质量,观察大鼠体征、大便性状、隐血情况,并进行疾病活动指数(Disease Activity Index,DAI)评分,见表1,评估疾病活动状态。给药14 d后禁食24 h,10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,股动脉取血,3 000 r/min离心10 min分离血清,剖腹取病变部位结肠组织。
1.3 统计学分析 采用SPSS 20.0统计软件分析,经正态检验后,计量资料数据以均数±标准差(±s)表示,正态数据组间比较以单因素方差分析,非正态数据组间比较用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般状态比较 除正常对照组外,各组大鼠造模后当天出现便血、稀便,便血由肉眼血便变为潜血共持续3~5 d,食量减少,体质量下降,肛周污浊,毛色暗淡粗糙沾染粪便,随时间推移,各组大鼠体质量先下降后持续增长,乌梅丸低剂量组症状好转最明显,饮食逐渐恢复、毛色润泽、行动积极活跃,大便性状由稀转干、逐渐成形;其次是阳性对照组,饮食一般,具有一定体力,大便始终未成形;高剂量组症状改善有限,形体消瘦,大便次数多、稀便,蜷卧懒动。取材时模型组大鼠结肠壁厚薄不均,肠壁纵向切开观察可见肠黏膜溃疡、糜烂,黏膜表面水肿,给药各组大鼠结肠黏膜表现为不同程度充血水肿,溃疡较模型组少见,乌梅丸高剂量组肠道内可见药物残渣。
2.2 TDI评分 给药后各组TDI评分随时间均逐渐降低,前期由于便血、体质量降低等因素DAI评分普遍偏高,各组间DAI差异无统计学意义(P>0.05);便血停止后体质量逐渐复,影响DAI的主要因素为大便性状,乌梅丸低剂量组大便性状改善最为明显,给药终点大便性状几乎恢复正常,从第5天开始与模型组比较,差异有统计学意义,P<0.05,阳性药组和乌梅丸高剂量组均无统计学意义(P>0.05)。与阳性药组比较,乌梅丸低剂量组从第6天开始差异有统计学意义(P<0.05),乌梅丸高剂量组无统计学意义(P>0.05)。乌梅丸低剂量组与乌梅丸高剂量组比较,从第5天开始差异有统计学意义(P<0.05)。见表2。
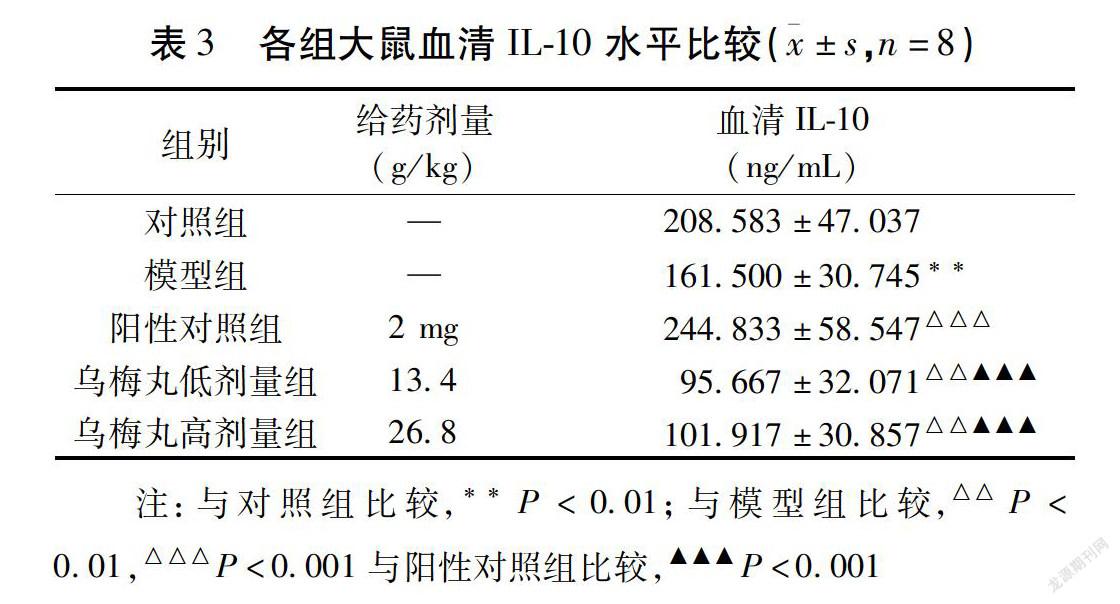
2.2 IL-10表达情况 与对照组比较,模型组大鼠血清IL-10表达降低,差异有统计学意义(P<0.05);与模型组比较,阳性对照组血清IL-10表达升高,乌梅丸低剂量组、乌梅丸高剂量组降低,差异有統计学意义(P<0.05);与阳性对照组比较,乌梅丸低剂量组、乌梅丸高剂量组血清IL-10表达降低,差异有统计学意义(P<0.05)。见表3。
2.3 各组大鼠肠黏膜NF-κB表达情况 与对照组比较,模型组大鼠NF-κB表达升高(P<0.05);与模型组比较,阳性对照组、乌梅丸低剂量组、乌梅丸高剂量组NF-κB表达降低(P<0.05);与阳性对照组比较乌梅丸低剂量组、乌梅丸高剂量组NF-κB表达降低(P<0.05)。见表4,图1。
3 讨论
腹泻是接受肿瘤免疫治疗患者最常见胃肠道不良反应,而该症状的发生与结肠炎密切相关(腹部疼痛、放射检查、内窥镜检查)[1]。CTLA-4和PD-1/PD-L1两类免疫检查点抑制剂比较,接受前者治疗发生腹泻的机率远远大于后者。接受了ipilimumab(CTLA-4)治疗的患者任何等级腹泻发生率约30%,严重(3级以上)腹泻的发生率大约为10%[2],结肠炎发生时间集中在3次治疗之后,持续34 d左右,与给药量无明显相关性[3]。约5%的患者发生了严重(3级以上)结肠炎[4],而迟发型结肠炎发生率更高,有研究显示接受CTLA-4免疫治疗的肿瘤患者发生迟发性结肠炎的机率高达12%,伴发的出血、肠穿孔和难治性腹泻等棘手症状甚至需要手术来解决[5]。相对CTLA-4免疫检查点抑制剂而言,PD-1免疫检查点抑制剂胃肠道相关irAEs轻缓许多[6],黑色素瘤患者接受nivolumab单抗治疗后,17%患者被观察到腹泻、结肠炎,只有1.2%患者发生3级以上严重胃肠道相关irAEs,接受另外一个PD-1免疫检查点抑制剂pembrolizumab的患者,结肠炎发生率为2.8%,与用药量呈正相关,2种PD-1免疫检查点抑制剂比较,pembrolizumab胃肠道相关irAEs平均持续时间(大约18周)远大于nivolumab(大约6周)[7]。肿瘤治疗相关免疫性结肠炎临床处理以静脉输注糖皮质激素为主,同时停止免疫治疗,糖皮质激素治疗无效者需考虑加用英夫利昔(Infliximab)等免疫抑制剂[8-10],停药再加糖皮质激素的免疫抑制作用,会大大降低免疫治疗的有效性,免疫抑制剂的加入,还可能增加机会性感染的风险。随着肿瘤免疫治疗临床推进,将来我国会出现大量接受免疫治疗患者,免疫治疗相关性结肠炎患者的数量届时也会激增,因此提早研究解决办法具有前瞻性、可行性、必要性。
白细胞介素-10(IL-10)是一种具有抗炎及免疫抑制作用的细胞因子,由CD4+的T细胞、抗原呈递细胞等分泌,具有抑制巨噬细胞活性,抑制IL-1、IL-6、TNF-α等炎性反应细胞因子分泌的功能,在免疫应答和炎性反应的负反馈调节中具有不可替代的作用[11-13]。IL-10主要通过JAK-STAT途径发挥作用,当IL-10与IL-10受体1结合后发生结构变化,暴露IL-10受体2的结合位点,在2个受体彼此靠近后引起细胞中JAK1和TyK2的激活,引起JAK1的磷酸化,进而激活STAT3从而选择性地抑制或激活转录基因发挥作用[14]。研究显示IL-10在克罗恩病、系统性红斑狼疮、干燥综合征等自身免疫性疾病的发生和发展过程中都有着十分重要的作用[15-17]。正常肠道内定植有细菌菌群,不断地和食物抗原和潜在的病原体接触,却不至于发生慢性肠道炎性反应,保持了肠道免疫上的稳态,这是多种免疫调节机制相互作用的结果,而在诸多机制之中,IL-10和转化生长因子-β的作用尤为关键[18]。核转录因子κB(Nuclear Factor Kappa B,NF-κB)广泛存在于各种组织细胞中,是一类具有多向转录调节作用的核蛋白因子,在收到炎性反应递质刺激后激活,调控多种基因的转录表达,在炎性反应、免疫、细胞的增殖以及凋亡等中发挥重要作用[19-20]。NF-κB未被激活时,与核因子κB抑制蛋白相结合并以无活性的三聚体形式存在,在细胞收到刺激后,核因子κB抑制蛋白磷酸化后降解,而NF-κB则和蛋白结合移位至细胞核,和靶序列相结合,激活下游转录基因[21]。NF-κB对炎性反应递质的刺激敏感,是炎性反应的敏感核转录因子,通过促进炎性细胞因子基因的转录使得IL-1、IL-6、TNF-α等炎性反应细胞因子表达增加导致炎性反应的强化[22]。在炎性反应性肠病的肠道上皮细胞中NF-κB明显激活,而在正常的肠道的上皮中则无激活[23]。对溃疡性结肠炎的小鼠使用NF-κB反义寡核苷酸灌肠,可以降低其IL-1、IL-6、TNF-α的水平,改善其症状和组织损伤[24]。
本研究显示乌梅丸可降低免疫性结肠炎大鼠病变结肠组织NF-κB水平,进而抑制IL-1等炎性因子分泌,从而达到减轻炎性损伤的目的;既往研究显示,乌梅丸可显著抑制结肠炎大鼠结肠组织IL-1表达,促进IL-10表达,维持细胞因子中促炎因子和抗炎因子间的平衡,从而对溃疡性结肠炎发挥治疗作用[25]。本次研究发现乌梅丸干预后,结肠炎大鼠血清中IL-10表达降低,血清IL-1表达升高,出现与结肠组织中相反的趋势,提示乌梅丸对结肠炎大鼠的治疗作用远不止调节局部细胞因子中促炎因子和抗炎因子间的产生平衡,还可能具有抑制IL-1等相关炎性因子迁移至病变部位、募集IL-10等抑炎因子至病变结肠部位的作用,进一步减轻炎性损伤作用。随着我国肿瘤免疫治疗临床工作的大量开展,免疫治疗胃肠道不良反应患者数量将会激增,本研究具有一定的前瞻性并为治疗肿瘤免疫治疗不良反应提供一定的治疗思路,但本次研究借用动物模型为免疫性结肠炎模型,并非肿瘤免疫治疗药物诱发,具有一定局限性。
參考文献
[1]Postow MA.Managing immune checkpoint-blocking antibody side effects[J].Am Soc Clin Oncol Educ Book,2015,35:76-83.
[2]Hodi FS,O′Day SJ,McDermott DF,et al.Improved survival with ipilimumab in patients with metastatic melanoma[J].N Engl J Med,2010,363(8):711-723.
[3]Marthey L,Mateus C,Mussini C,et al.Cancer Immunotherapy with Anti-CTLA-4 Monoclonal Antibodies Induces an Inflammatory Bowel Disease[J].J Crohns Colitis,2016,10(4):395-401.
[4]Wolchok JD,Neyns B,Linette G,et al.Ipilimumab monotherapy in patients with pretreated advanced melanoma:a randomised,double-blind,multicentre,phase 2,dose-ranging study[J].Lancet Oncol,2010,11(2):155-164.
[5]Beck KE,Blansfield JA,Tran KQ,et al.Enterocolitis in patients with cancer after antibody blockade of cytotoxic T-lymphocyte-associated antigen 4[J].J Clin Oncol,2006,24(15):2283-2289.
[6]Eigentler TK,Hassel JC,Berking C,et al.Diagnosis,monitoring and management of immune-related adverse drug reactions of anti-PD-1 antibody therapy[J].Cancer Treat Rev,2016,45:7-18.
[7]Grover S,Rahma OE,Hashemi N,et al.Gastrointestinal and Hepatic Toxicities of Checkpoint Inhibitors:Algorithms for Management[J].Am Soc Clin Oncol Educ Book,2018,38:13-19.
[8]Pagès C,Gornet JM,Monsel G,et al.Ipilimumab-induced acute severe colitis treated by infliximab[J].Melanoma Res,2013,23(3):227-230.
[9]Minor DR,Chin K,Kashani-Sabet M.Infliximab in the treatment of anti-CTLA4 antibody(ipilimumab)induced immune-related colitis[J].Cancer Biother Radiopharm,2009,24(3):321-325.
[10]Merrill SP,Reynolds P,Kalra A,et al.Early administration of infliximab for severe ipilimumab-related diarrhea in a critically ill patient[J].Ann Pharmacother,2014,48(6):806-810.
[11]de Waal Malefyt R,Figdor CG,Huijbens R,et al.Effects of IL-13 on phenotype,cytokine production,and cytotoxic function of human monocytes.Comparison with IL-4 and modulation by IFN-gamma or IL-10[J].J Immunol,1993,151(11):6370-6381.
[12]de Waal Malefyt R,Abrams J,Bennett B,et al.Interleukin 10(IL-10)inhibits cytokine synthesis by human monocytes:an autoregulatory role of IL-10 produced by monocytes[J].J Exp Med,1991,174(5):1209-1220.
[13]Fiorentino DF,Zlotnik A,Mosmann TR,et al.IL-10 inhibits cytokine production by activated macrophages[J].J Immunol,1991,147(11):3815-3822.
[14]Tian G,Li JL,Wang DG,et al.Targeting IL-10 in auto-immune diseases[J].Cell Biochem Biophys,2014,70(1):37-49.
[15]Wang B,Zhu JM,Fan YG,et al.Association of the-1082G/A polymorphism in the interleukin-10 gene with systemic lupus erythematosus:a meta-analysis[J].Gene,2013,519(2):209-216.
[16]Bertorello R,Cordone M P,Contini P,et al.Increased levels of interleukin-10 in saliva of Sjgren′s syndrome patients.Correlation with disease activity[J].Clinical & Experimental Medicine,2004,4(3):148-151.
[17]Noguchi E,Homma Y,Kang X,et al.A Crohn′s disease-associated NOD2 mutation suppresses transcription of human IL10 by inhibiting activity of the nuclear ribonucleoprotein hnRNP-A1[J].Nat Immunol,2009,10(5):471-479.
[18]Izcue A,Coombes JL,Powrie F.Regulatory lymphocytes and intestinal inflammation[J].Annu Rev Immunol,2009,27:313-338.
[19]Jiang C,Tong YL,Zhang D,et al.Sinomenine prevents the development of cardiomyopathy in diabetic rats by inhibiting inflammatory responses and blocking activation of NF-κB[J].Gen Physiol Biophys,2017,36(1):65-74.
[20]Ma Z,Chalkley RJ,Vosseller K.Hyper-O-GlcNAcylation activates nuclear factor κ-light-chain-enhancer of activated B cells(NF-κB)signaling through interplay with phosphorylation and acetylation[J].J Biol Chem,2017,292(22):9150-9163.
[21]Wang QZ,Gao HQ,Liang Y,et al.Cofilin1 is involved in hypertension-induced renal damage via the regulation of NF-κB in renal tubular epithelial cells[J].J Transl Med,2015,13:323.
[22]Müller I,Beissert S,Kulms D.Anti-apoptotic nf-κb and gain of function mutp53 in concert act pro-apoptotic in response to uvb il-1 via enhanced tnf production[J].Journal of Investigative Dermatology,2014,135(3):851-860.
[23]Schreiber S,Nikolaus S,Hampe J.Activation of nuclear factor kappa B inflammatory bowel disease[J].Gut,1998,42(4):477-484.
[24]Nikolaus S,Bauditz J,Gionchetti P,et al.Increased secretion of pro-inflammatory cytokines by circulating polymorphonuclear neutrophils and regulation by interleukin 10 during intestinal inflammation[J].Gut,1998,42(4):470-476.
[25]閆曙光,周永学,惠毅.乌梅丸及其拆方对UC大鼠IL-1、IL-10的影响[J].现代中医药,2013,33(5):110-113.
(2018-12-26收稿 责任编辑:王明)
