HPLC法同时测定真武汤中11种活性成分的含量
2019-09-10田萍马开张薇张迪文刘碧碧郭晓燕韩德恩
田萍 马开 张薇 张迪文 刘碧碧 郭晓燕 韩德恩


摘 要 目的:建立同時测定真武汤中5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸含量的方法。方法:采用高效液相色谱法。色谱柱为Phenomenex Kinetex C18,流动相为乙腈-0.2%磷酸水溶液(梯度洗脱),流速为1.0 mL/min,检测波长为285 nm(4.4~7 min,5-羟甲基糠醛)、203 nm[7~12 min,(+)-儿茶素]、233 nm(12~50 min,芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷)、200 nm(50~62.3 min,6-姜酚、8-姜酚;62.9~90 min,6-姜烯酚、茯苓酸)、222 nm(62.3~62.9 min,白术内酯Ⅱ),柱温为35 ℃,进样量为20 µL。结果:5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸检测质量浓度线性范围分别为0.62~12.47 μg/mL(r=0.999 6)、2.36~47.25 μg/mL(r=0.999 7)、200.80~4 016 μg/mL(r=0.999 7)、4.45~89.04 μg/mL(r=0.999 6)、4.28~85.54 μg/mL(r=0.999 5)、5.16~103.13 μg/mL(r=0.999 9)、5.53~110.66 μg/mL(r=0.999 9)、0.84~16.89 μg/mL(r=0.999 8)、0.60~12.04 μg/mL(r=0.999 9)、0.53~10.62 μg/mL(r=0.999 5)、1.04~20.78 μg/mL(r=0.999 7);定量限分别为0.155、0.590、1.210、1.112、1.070、0.258、0.553、0.421、0.153、0.354、0.431 μg/mL,检测限分别为0.047、0.179、0.134、0.337、0.324、0.078、0.168、0.128、0.046、0.107、0.131 μg/mL,精密度、稳定性、重复性试验的RSD均小于3%;加样回收率分别为96.06%~103.01%(RSD=2.64%,n=6)、95.11%~101.57%(RSD=2.58%,n=6)、97.22%~102.11%(RSD=1.93%,n=6)、96.43%~102.78%(RSD=2.35%,n=6)、96.42%~101.43%(RSD=2.15%,n=6)、96.86%~102.05%(RSD=2.10%,n=6)、95.32%~100.55%(RSD=1.87%,n=6)、97.04%~103.25%(RSD=2.22%,n=6)、96.78%~103.22%(RSD=2.62%,n=6)、97.04%~103.14%(RSD=2.28%,n=6)、97.08%~103.51%(RSD=2.94%,n=6)。结论:该方法准确、专属性好,可用于同时测定真武汤中11种活性成分的含量。
关键词 真武汤;高效液相色谱法;5-羟甲基糠醛;(+)-儿茶素;芍药苷;苯甲酰乌头原碱;苯甲酰次乌头原碱;苯甲酰芍药苷;6-姜酚;8-姜酚;白术内酯Ⅱ;6-姜烯酚;茯苓酸;含量测定
ABSTRACT OBJECTIVE: To establish a method for simultaneous determination of eleven active constituents in Zhenwutang decoction, such as 5-hydroxymethylfurfural, (+)-cianidanol, paeoniflorin, benzoylaconitine, benzoylhypacoitine, benzoylpaeoniflorin, 6-gingerol, 8-gingerol, atractylenolide Ⅱ, 6-shogaol and pachymic acid. METHODS: HPLC method was adopted. The separation was performed on Phenomenex Kinetex C18 column with mobile phase consisted of acetonitrile-0.2 % phosphoric acid solution(gradient elution) at flow rate of 1.0 mL/min. The detection wavelength was set at 285 nm (4.4-7 min, 5-hydroxymethylfurfural), 203 nm [7-12 min,(+)-cianidanol], 233 nm (12-50 min,paeoniflorin, benzoylaconitine, benzoylhypacoitine, benzoylpaeoni- florin), 200 nm (50-62.3 min, 6-gingerol, 8-gingerol; 62.9-90 min, 6-shogaol, pachymic acid) and 222 nm (62.3-62.9 min, atractylenolide Ⅱ). The column temperature was set at 35 ℃, and the sample size was 20 µL. RESULTS: The linear ranges of 5-hydroxymethylfurfural, (+) -cianidanol, paeoniflorin, benzoylaconitine, benzoylhypacoitine, benzoylpaeoniflorin, 6-gingerol, 8-gingerol, atractylenolide Ⅱ, 6-shogaol, pachymic acid were 0.62-12.47 μg/mL (r=0.999 6),2.36-47.25 μg/mL (r=0.999 7),200.80-4 016 μg/mL (r=0.999 7),4.45-89.04 μg/mL (r=0.999 6),4.28-85.54 μg/mL (r=0.999 5),5.16-103.13 μg/mL (r=0.999 9),5.53-110.66 μg/mL (r=0.999 9),0.84-16.89 μg/mL (r=0.999 8),0.60-12.04 μg/mL (r=0.999 9),0.53-10.62 μg/mL (r=0.999 5),1.04-20.78 μg/mL (r=0.999 7), respectively. The limits of quantitation were 0.155, 0.590, 1.210, 1.112, 1.070, 0.258, 0.553, 0.421, 0.153, 0.354, 0.431 μg/mL, respectively. The limits of detection were 0.047, 0.179, 0.134, 0.337, 0.324, 0.078, 0.168, 0.128, 0.046, 0.107, 0.131 μg/mL, respectively. RSDs of precision, stability and reproducibility tests were all lower than 3%. The average recovery rates were 96.06%-103.01%(RSD=2.64%,n=6), 95.11%-101.57%(RSD=2.58%,n=6), 97.22%-102.11%(RSD=1.93%,n=6), 96.43%-102.78%(RSD=2.35%,n=6), 96.42%-101.43%(RSD=2.15%,n=6), 96.86%-102.05%(RSD=2.10%,n=6), 95.32%-100.55%(RSD=1.87%,n=6), 97.04%-103.25%(RSD=2.22%,n=6), 96.78%-103.22%(RSD=2.62%,n=6), 97.04%-103.14%(RSD=2.28%,n=6), 97.08%-103.51%(RSD=2.94%,n=6), respectively. CONCLUSIONS: The method is accurate and specific, and suitable for simultaneous determination 11 active components of Zhenwutang decoction.
KEYWORDS Zhenwutang decoction; HPLC; 5-hydroxymethylfurfural; (+)-cianidanol; Paeoniflorin; Benzoylaconitine; Benzoylhypacoitine; Benzoylpaeoniflorin; 6-gingerol; 8-gingerol; Atractylenolide Ⅱ; 6-shogaol; Pachymic acid; Content determination
真武汤是张仲景《伤寒论》中温阳利水的代表方[1],由白芍、茯苓、白术、附子、生姜等5味中药组成,主要用于治疗肾病[2]、心力衰竭[3]等症,疗效显著。白芍中芍药苷、苯甲酰芍药苷具有抗炎、抗应激、调节免疫等作用,可用于糖尿病肾病、肾病综合征、慢性肾小球肾炎等多种肾脏疾病的治疗[4];其酚类成分儿茶素具有肾保护作用[5]。茯苓酸是茯苓的主要有效活性成分之一,具有改善脓毒症引起的急性肾损伤的作用[6]。白术中白术内酯Ⅱ能显著抑制炎症介质和炎症细胞因子的产生[7];5-羟甲基糠醛对链脲佐菌素诱导的糖尿病肾病模型大鼠具有肾保护作用,但有基因和细胞毒性[8-9]。附子水煎剂可改善微小病变肾病模型大鼠的肾脏损伤[10],苯甲酰乌头原碱、苯甲酰次乌头原碱等单酯型生物碱既是其有效成分,也是毒性成分[11]。生姜中6-姜酚、8-姜酚、6-姜烯酚对急性肾损伤和糖尿病肾损伤均具有保护作用[12-13]。以上成分均为真武汤中具有肾保护作用的活性成分。目前关于真武汤的研究,主要为测定方中一味或多味药材所含的有效成分[14-16],尚未涵盖方中所有药材有效成分或指标成分含量。而中药复方通过多成分、多靶点而发挥协同增效的作用,因此对其中单一或几种成分进行含量测定,难以全面体现其整体质量。为此,本研究采用高效液相色谱法(HPLC)测定了真武汤中5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸等11种活性成分的含量,旨在为完善其质量标准提供参考。
1 材料
1.1 仪器
2695型HPLC仪,包括二极管阵列检测器、Empower 2-Build 2154色谱工作站(美国Waters公司);AE240型十万分之一分析天平(瑞士Mettler-Toledo公司);LIBROR-160DPT型万分之一电子分析天平(日本Shimadzu公司);ULUP- IV-10T型超纯水器(四川优普超纯科技有限公司)。
1.2 药品与试剂
芍药苷对照品(中国食品药品检定研究院,批号:110736-201640,纯度:>99.0%);苯甲酰芍药苷对照品(批号:wkq16122906,纯度:>98%)、茯苓酸对照品(批号:wkq16071903,纯度:>98%)、白术内酯Ⅱ对照品(批号:wkq16060503,纯度:>98%)均购自四川维克奇生物科技有限公司;(+)-儿茶素对照品(批号:MUST- 16030812,纯度:>98%)、5-羟甲基糠醛对照品(批号:MUST- 15051212,纯度:>98%)、苯甲酰乌头原碱对照品(批号:MUST-17022805,纯度:>98%)、苯甲酰次乌头原碱对照品(批号:MUST-17022807,纯度:>98%)均购自成都曼斯特生物科技有限公司;6-姜酚對照品(批号:20171206)、6-姜烯酚对照品(批号:20171222)、8-姜酚对照品(批号:20180408)均由河南省中医药研究院马开实验室自制,采用面积归一化法检测纯度均大于98%;乙腈为色谱纯,其他试剂均为分析纯,水为超纯水。
1.3 药材
白术饮片(批号:170605CP0175,产地:浙江)、白芍饮片(批号:171102,产地:安徽)、附子饮片(黑顺片,批号:17050202,产地:四川)、茯苓饮片(批号:170602,产地:安徽)均购自河南本草国药馆;生姜购自郑州市家辉超市,经河南省中医药研究院刘杰研究员鉴定分别为菊科植物白术(Atractylodes macrocephala Koidz.)的干燥根茎、毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根、毛茛科植物乌头(Aconitum carmichaelii Debx.)的子根加工品、多孔菌科真菌茯苓[Poria cocos(Schw.)Wolf]的干燥菌核、姜科植物姜(Zingiber officinale Rosc.)的新鲜根茎。
2 方法与结果
2.1 色谱条件
色谱柱:Phenomenex Kinetex C18(250 mm×4.6 mm,5 µm);流动相:乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱(0~25 min,8%A→17%A;25~70 min,17%A→ 65%A;70~75 min,65%A;75~76 min,65%A→ 90%A;76~90 min,90%A;90~95 min,90%A→ 8%A);流速:1.0 mL/min;检测波长:285 nm(4.4~7 min,5-羟甲基糠醛)、203 nm[7~12 min,(+)-儿茶素]、233 nm(12~50 min,芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷);200 nm(50~62.3 min,6-姜酚、8-姜酚;62.9~90 min,6-姜烯酚、茯苓酸)、222 nm(62.3~62.9 min,白术内酯Ⅱ);柱温:35 ℃;进样量:20 µL。
2.2 真武汤的制备
按《伤寒论》和《方剂学》(7版)中真武汤的处方量[1,17],精密称取白芍9 g、茯苓9 g、白术 6 g、生姜 9 g、附子(黑顺片)5 g,置于同一2 000 mL 圆底烧瓶中,加水800 mL,浸泡 30 min,回流提取 2 次,每次30 min,趁热纱布滤过,合并滤液,减压浓缩至约40 mL,放置室温,加水定容至50 mL,摇匀,即得。共制备3批真武汤样品(编号:S1、S2、S3)。
2.3 溶液的制备
2.3.1 混合对照品溶液 取5-羟甲基糠醛、(+)-儿茶素、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸对照品适量,分别置于10 mL量瓶中,加甲醇溶解并定容,摇匀,得5-羟甲基糠醛、(+)-儿茶素、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸质量浓度分别为270.25、1 179.5、1 066.25、1 127.75、1 335.75、1 416.50、343.75、216.00、115.50、469.50 µg/mL的单一对照品贮备液。另取芍药苷对照品适量,置于5 mL量瓶中,分别加入上述各单一对照品贮备液适量,加甲醇定容,摇匀,得含5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸质量浓度分别为12.47、47.25、4 016、89.04、85.54、103.13、110.66、16.89、12.04、10.62、20.78 µg/mL的混合对照品溶液。
2.3.2 供试品溶液 精密量取“2.2”项下样品3 mL,置于5 mL量瓶中,加甲醇定容,摇匀,室温放置12 h,再摇匀,经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.3.3 阴性样品溶液 按“2.2”项下方法分别制备缺白芍、茯苓、白术、附子(黑顺片)、生姜的阴性样品,再按“2.3.2”项下方法分别制备各阴性样品溶液。
2.4 系统适用性试验
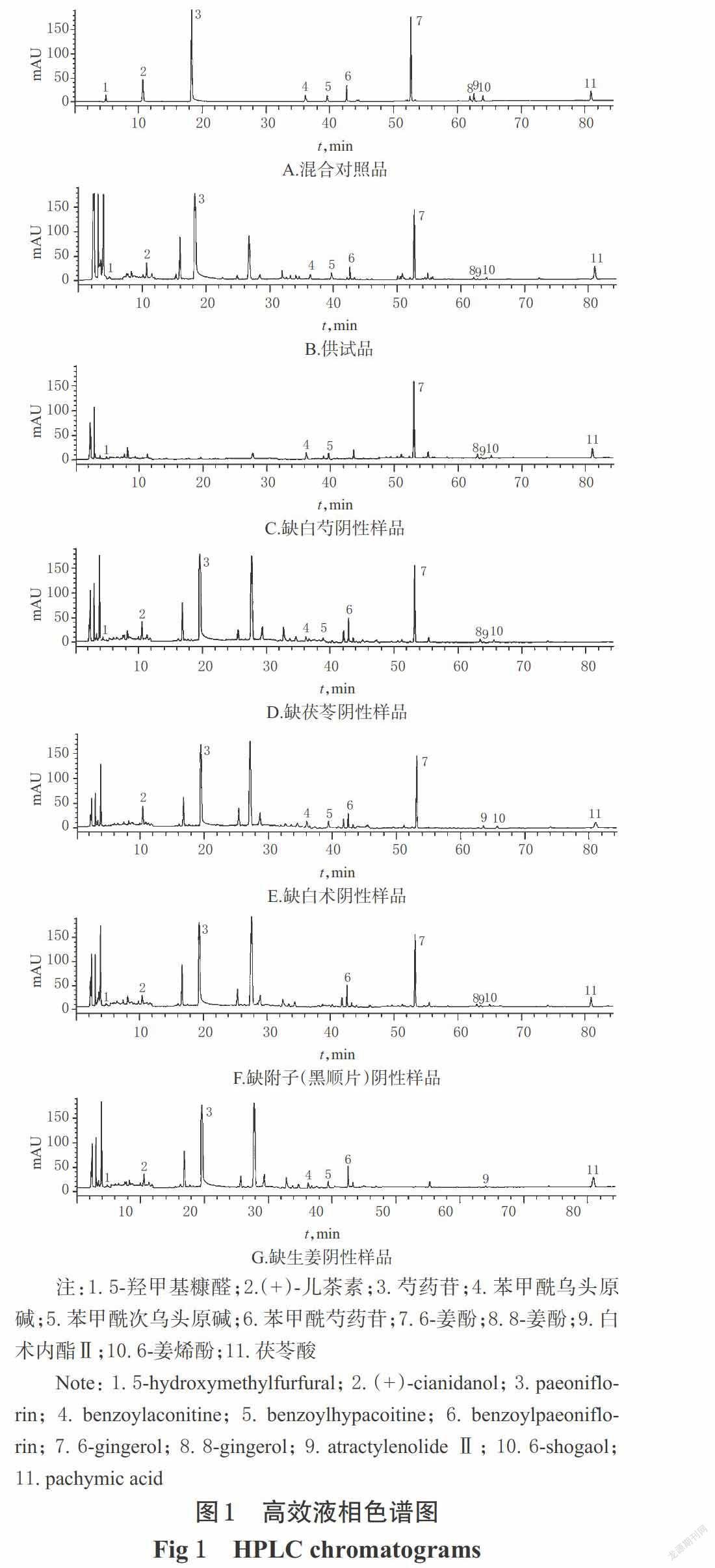
精密量取“2.3”项下混合对照品溶液、供试品溶液和阴性样品溶液各适量,按“2.1”项下色谱条件进样测定,记录色谱图,详见图 1。由图1可知,在该色谱条件下,各成分均能达到基线分离,分离度均大于1.5,理论板数以6-姜酚峰计均不低于5 000,阴性样品对测定无干扰。
2.5 线性关系考察
精密量取“2.3.1”项下混合对照品溶液0.25、0.50、1.0、2.0、4.0、5.0 mL,分别置于5 mL量瓶中,加甲醇定容,摇匀,得系列线性关系工作溶液。精密量取上述系列线性关系工作溶液各20 µL,按“2.1”项下色谱条件进样测定,记录峰面积。以各待测成分质量浓度(x,µg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,结果见表1。
2.6 定量限与检测限考察
取“2.3.1”项下混合对照品溶液适量,加甲醇倍比稀释,按“2.1”项下色谱条件进样测定,以信噪比10 ∶ 1、3 ∶ 1分别计算定量限、检测限。结果,5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸的定量限分别为0.155、0.590、1.210、1.112、1.070、0.258、0.553、0.421、0.153、0.354、0.431 μg/mL,检测限分别为0.047、0.179、0.134、0.337、0.324、0.078、0.168、0.128、0.046、0.107、0.131 μg/mL。
2.7 精密度试验
取“2.3.1”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样测定6 次,记录峰面积。结果,5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸峰面积的RSD分别为2.11%、1.78%、1.96%、2.30%、1.56%、2.28%、1.77%、1.33%、1.57%、1.96%、2.36%(n=6),表明仪器精密度良好。
2.8 稳定性试验
取“2.3.2”项下供试品溶液(编号:S2)适量,分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸峰面积的RSD分别为1.31%、0.58%、1.76%、1.64%、1.46%、1.18%、1.57%、1.38%、1.77%、1.86%、1.94%(n=6),表明供試品溶液于室温下放置24 h 内稳定性良好。
2.9 重复性试验
取样品(编号:S2)适量,共6份,按“2.3.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中11种成分的含量。结果,5-羟甲基糠醛、(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚、8-姜酚、白术内酯Ⅱ、6-姜烯酚、茯苓酸的平均含量分别为9.31、40.19、3 500.65、72.60、70.53、79.99、86.89、12.95、5.06、3.34、14.80 µg/mL,RSD分别为2.78%、2.18%、2.76%、2.04%、2.67%、1.87%、2.57%、2.08%、2.17%、2.96%、2.99%(n=6),表明本方法重复性良好。
2.10 加样回收率试验
取已知含量的“2.2”项下样品(编号:S2),共6份,每份约1.5 mL,分别加入混合对照品溶液[含5-羟甲基糠醛6.98 µg/mL、(+)-儿茶素30.24 µg/mL、芍药苷2 626.04 µg/mL、苯甲酰乌头原碱55.31 µg/mL、苯甲酰次乌头原碱53.27 µg/mL、苯甲酰芍药苷60.47 µg/mL、6-姜酚65.15 µg/mL、8-姜酚10.46 µg/mL、白术内酯Ⅱ3.88 µg/mL、6-姜烯酚2.87 µg/mL、茯苓酸11.12 µg/mL] 2 mL,按“2.3.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.11 耐用性试验
取“2.2”项下样品(编号:S2)适量,按“2.3.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件[分别以不同流动相(B)体积比例(0.15%、0.20%、0.25%磷酸水溶液)、流速(0.9、1.0、1.1 mL/min)、柱温(30、35、40 ℃)]进样测定,记录峰面积并按标准曲线法计算样品中11种成分的含量,结果见表3。结果表明,本方法可满足试验要求,提示耐用性良好。
2.12 样品含量测定
取“2.2”项下3批样品适量,按“2.3.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,平行操作3次,记录峰面积并按标准曲线法计算样品中11种成分的含量,结果见表4。
3 讨论
有研究认为,同时测定中药复方中多个成分时,因各成分的紫外最大吸收波长不同,因此需要采用波长切换法测定各成分的含量[18]。笔者参考相关文献[14-16,18-20],在190~400 nm波长范围内对11种待测成分进行全波长扫描,结果发现,在233 nm波长处芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷有较大吸收,222 nm波长处白术内酯Ⅱ有最大吸收,285 nm波长处5-羟甲基糠醛有最大吸收,200 nm波长处茯苓酸有较大吸收,200、227、280 nm波长处6-姜酚、6-姜烯酚、8-姜酚有吸收峰,203、279 nm波长处(+)-儿茶素有吸收峰;考虑到部分成分含量较低,因此在保证各待测成分检测灵敏度及基线分离的情况下,本研究采用“2.1”项下波长作为检测波长[21]。
本研究将样品滤过后直接进样与经甲醇处理后进样的色谱图进行比较。结果发现,经甲醇处理后,各成分分离度好,噪声小,故本研究将样品用甲醇进行处理后再进样分析。与此同时,本研究又比较了样品与不同体积比甲醇(1 ∶ 4、2 ∶ 3、1 ∶ 1、3 ∶ 2、4 ∶ 1)混匀后的色谱情况。结果发现,不同体积比的色谱图中峰数未有明显变化,但当样品与甲醇体积比为3 ∶ 2时待测成分峰面积最大,且基线较平稳,故笔者将样品与甲醇按体积比3 ∶ 2混匀后,分别放置2、4、6、8、10、12、14、16 h后过滤进样,发现混匀后的样品在放置12 h后过滤,其滤液不会产生白色的粉状沉淀,且各成分含量变化不大。因此本研究采用“2.3.2”项下方法处理样品。
此外,笔者比较了甲醇-水、乙腈-水等流动相系统。结果显示,乙腈的洗脱能力优于甲醇,色谱峰分离度较好,但略有拖尾,在加入磷酸溶液后峰形和分离度均有所改善,故选择乙腈-磷酸水溶液为流动相。同时,本研究还比较了乙腈-磷酸水溶液中磷酸不同体积分数(0.2%、0.3%、0.4%)对各成分与杂质峰分离度的影响。结果发现,当磷酸溶液体积分数大于0.2%时,分离度并没有随磷酸体积分数的增加得到明显的改善,因此选择乙腈-0.2%磷酸水溶液为流动相进行梯度洗脱,此时各成分与杂质峰可达到完全分离,满足相关要求[22]。
耐用性试验结果显示,当流速为0.9~1.1 mL/min、磷酸溶液体积分数为0.15%~0.25%、柱温为30~40 ℃时,虽然各成分保留时间偏差在(±0.16) min内,但样品含量的RSD均小于3%,表明其耐用性良好,能满足试验要求[22]。样品含量测定结果显示,(+)-儿茶素、芍药苷、苯甲酰乌头原碱、苯甲酰次乌头原碱、苯甲酰芍药苷、6-姜酚含量较高;5-羟甲基糠醛、白术内酯Ⅱ、8-姜酚、6-姜烯酚、茯苓酸含量较低,但因其分别为方中白术、茯苓、生姜的主要活性成分[6-7,12-13, 20],故仍将这5种成分作为真武汤质量控制的指标性成分。
综上所述,本研究所建含量测定方法准确、专属性好,可用于同时测定真武汤中11种活性成分的含量。
参考文献
[ 1 ] 张仲景.伤寒论[M].北京:人民卫生出版社,2005:27.
[ 2 ] LIANG CL,ZHANG PC,WU JB,et al. Zhen-wu-tang attenuates adriamycin-induced nephropathy via regulating AQP2 and miR-92b[J]. Biomed Pharmacother,2019. DOI:10.1016/j.biopha.2018.10.146.
[ 3 ] 李崢,李文杰,尚雪莹,等.真武汤通过SIRT1 信号通路减轻心力衰竭大鼠心肌细胞线粒体损伤及心肌细胞凋亡[J].中华中医药学刊,2018,36(5):1062-1067.
[ 4 ] 刘千红,侯亮,丘军,等.白芍总苷对 IgA 肾病患者炎性因子的影响[J].长春中医药大学学报,2018,34(3):512- 514.
[ 5 ] 王海,连燕娜,高丽萍,等.儿茶素对顺铂所致人胚肾细胞氧化损伤的影响[J].癌变·畸变·突变,2017,29(1):51- 54.
[ 6 ] CAI ZY,SHENG ZX,YAO H. Pachymic acid ameliorates sepsis-induced acute kidney injury by suppressing inflammation and activating the Nrf2/HO-1 pathway in rats[J]. Eur Rev Med Pharmacol Sci, 2017,21(8):1924-1931.
[ 7 ] 彭腾,李鸿翔,邓赟,等.白术内酯类成分及其药理作用研究进展[J].中国药房,2012,23(39):3732-3734.
[ 8 ] 赵颖,张璐欣,李越,等. 5-羟甲基糠醛的研究概况[J].医学综述,2016,22(17):3431-3434.
[ 9 ] SHUKLA R,BANERJEE S,TRIPATHI YB. Antioxidant and antiapoptotic effect of aqueous extract of Pueraria tuberosa(Roxb. Ex Willd.)DC. on streptozotocin-induced diabetic nephropathy in rats[J]. BMC Complement Altern Med, 2018. DOI:10.1186/s12906-018-2221-x.
[10] 杨金风,王长松,王媛媛,等.附子对微小病变肾病大鼠的影响[J].辽宁中医杂志,2010,37(S1):245-247.
[11] 孔小强,蒋且英,罗云,等.基于外翻肠囊模型的黄芪-附子配伍对附子6 种生物碱肠吸收的影响研究[J].中草药,2017,48(23):4928-4934.
[12] RODRIGUES FAP,SANTOS ADDC,DE MEDEIROS PHQS,et al. Gingerol suppresses sepsis-induced acute kidney injury by modulating methylsulfonylmethane and dimethylamine production[J]. Sci Rep,2018. DOI:10.1038/s41598-018-30522-6.
[13] XU Y,BAI L,CHEN X,et al. 6-Shogaol ameliorates diabetic nephropathy through anti-inflammatory,hyperlipidemic,anti-oxidative activity in db/db mice[J]. Biomed Pharmacother, 2018. DOI:10.1016/j.biopha.2017.10.084.
[14] 陳忠新,李强,戴临风,等.真武汤颗粒剂质量标准研究[J].黑龙江医药,2015,28(1):52-55.
[15] 刘碧好,白莉霞,卢瑞瑞,等.真武汤颗粒剂制备工艺研究[J].中国药师,2018,21(1):6-9.
[16] 吴俊标,贺雨,梁春玲,等.真武汤水提液 HPLC特征图谱研究及指标成分的测定[J].中国实验方剂学杂志,2014,20(18):45-49.
[17] 王付,许二平,张大伟.方剂学[M].7版.北京:中国中医药出版社,2010:253-254.
[18] 韩真真,邵长森,张元元,等. HPLC 法同时测定桂枝加芍药汤中 8 种成分的含量[J].中国药房,2019,30(6):784-788.
[19] 张金莲,谢日健,刘明贵,等.不同炮制方法对白术中白术内酯Ⅰ、Ⅱ、Ⅲ含量的影响[J].中国实验方剂学杂志,2016,22(21):15-18.
[20] 张乐,潘欢欢,刘飞,等.白术麸炒过程中 5-羟甲基糠醛的含量变化规律及其与饮片温度、颜色变化的相关性分析[J].中国实验方剂学杂志,2016,22(17):11-14.
[21] 汪东庚,刘文英,沈于兰. HPLC法测定虎杖提取物中白藜芦醇和大黄素的含量[J].中草药,2004,35(10):1126-1128.
[22] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:374-377.
(收稿日期:2019-03-25 修回日期:2019-06-19)
(编辑:陈 宏)
