桑黄提取物体内抗肿瘤作用的实验研究
2019-09-10于彩云赵晨黄芳宋爱荣
于彩云 赵晨 黄芳 宋爱荣

[摘要]目的通过检测桑黄3种提取物对H22荷瘤小鼠的抑瘤率,探讨桑黄提取物的抗肿瘤活性。方法将SPF级昆明种小鼠随机分组后,于小鼠右前肢腋窝皮下接种H22肝癌细胞,接种1 d后,分别采用桑黄3种提取物的低、中、高剂量(100、500、1 000 mg·kg-1·d-1)灌胃,以生理盐水和环磷酰胺为阴性和阳性对照,连续给药10 d。实验期间每天测定各组小鼠的体质量;给药10 d后处死小鼠测瘤质量,并计算各组抑瘤率。结果桑黄3种提取物可以增加H22荷瘤小鼠体质量。低、中、高剂量桑黄菌丝体多糖提取物对H22荷瘤小鼠的抑瘤率分别为32.87%、57.08%和68.35%;低、中、高剂量桑黄子实体多糖提取物对H22荷瘤小鼠的抑瘤率分别为44.14%、52.81%和73.69%;低、中、高剂量桑黄发酵液多糖提取物对H22荷瘤小鼠的抑瘤率分别为49.16%、50.63%和51.81%。结论桑黄3种提取物均具有较强的抗肿瘤活性,其中抗肿瘤效果最好的是桑黄子实体多糖提取物,该提取物也可以显著增加H22荷瘤小鼠体质量。
[关键词]桑黄;中草药;肝肿瘤;抗肿瘤药
[ABSTRACT]ObjectiveTo investigate the antitumor activity of Phellinus igniarius extracts by analyzing the tumor inhibition rate of three Phellinus igniarius extracts in H22 tumor`-bearing mice. MethodsSpecific pathogen`-free Kunming mice were randomly divided into groups and then inoculated with H22 hepatoma cells under the axilla of the right forelimb. On day 1 after inoculation, three Phellinus igniarius extracts were administered by gavage at a low dose of 100 mg·kg-1·d-1, a middle dose of 500 mg·kg-1·d-1, and a high dose of 1 000 mg·kg-1·d-1; the mice in the negative control group were given normal saline, and those in the positive control group were given cyclophosphamide. The course of treatment was 10 consecutive days for all groups. Body weight was measured every day, and after 10 d of administration, the mice were sacrificed to measure tumor weight, and tumor inhibition rate was calculated for all groups. ResultsThese three Phellinus igniarius extracts increased the body weight of H22 tumor`-bearing mice. The low`-, middle`-, and high`-dose mycelia polysaccharides from Phellinus igniarius had a tumor inhibition rate of 32.87%, 57.08%, and 68.35%, respectively; the low`-, middle`-, and high`-dose fruit body polysaccharides from Phellinus igniarius had a tumor inhibition rate of 44.14%, 52.81%, and 73.69%, respectively; the low`-, middle`-, and high`-dose Phellinus igniarius polysaccharides extracted from fermentation broth had a tumor inhibition rate of 49.16%, 50.63%, and 51.81%, respectively. ConclusionAll three Phellinus igniarius extracts have a strong antitumor activity, among which fruit body polysaccharides from Phellinus igniarius have the best antitumor effect and can significantly increase the body weight of H22 tumor`-bearing mice.
[KEY WORDS]Phellinus igniarius; drugs, Chinese herbal; liver neoplasms; antineoplastic agents
桑黃为担子菌门、层菌纲、非褶菌目、多孔菌科的药用真菌[1`-3]。该菌在我国中南地区通常生长在桑属植物上,因其子实体为黄褐色而得名[4`-5]。中国目前发现的桑黄类群有7种,只有生长在桑树上的才是真正的桑黄[6]。桑黄作为一种传统中药在东亚国家已经得到广泛应用[7]。桑黄味微苦,能利五脏、软坚、排毒、止血、活血、活胃止泻,民间用于治疗淋病、崩漏带下等[8`-10]。桑黄是目前国际公认的抗肿瘤效果最好的大型真菌之一[11`-13]。桑黄多糖是桑黄主要的活性成分,可以从桑黄子实体、菌丝体和发酵液中提取。目前比较桑黄不同提取物体内抗肿瘤作用的研究少见。本研究拟通过比较桑黄3种提取物对H22荷瘤小鼠的抑制率,探讨其抗肿瘤活性差异,为进一步开发和利用桑黄提供科学依据。
1材料与方法
1.1实验材料
1.1.1样品桑黄菌丝体多糖提取物、桑黄子实体多糖提取物、桑黄发酵液多糖提取物均由山东应用真菌重点实验室提供。将不同多糖提取物溶于蒸馏水制备小鼠灌胃样品。
1.1.2动物及瘤株SPF级昆明种小鼠由山东大学动物实验中心提供,体质量(19±2)g,雌雄各半;荷肝癌H22瘤株小鼠由山东省医学科学院基础微生物实验室提供。
1.1.3仪器及耗材实验所用的仪器及耗材如下:显微镜,百分之一、万分之一天平,培养皿,一次性使用无菌注射器,小烧杯,量筒,滴管,吸耳球,玻璃棒,血细胞计数板,盖玻片,载玻片,胶皮手套,脱脂棉,手术刀,解剖剪,镊子。
1.2实验方法
1.2.1分组及称体质量将66只小鼠随机装入11个笼子中,每笼6只,雌雄各半。取9笼小鼠平均分为3组,每组用一种桑黄提取物灌胃,每组3笼小鼠分别设为低剂量组(100 mg·kg-1·d-1)、中剂量组(500 mg·kg-1·d-1)和高剂量组(1 000 mg·kg-1·d-1);剩余的2笼小鼠分别设为生理盐水组(阴性对照)和环磷酰胺组(阳性对照,给予环磷酰胺20 mg·kg-1·d-1)。每天稱笼中6只小鼠体质量,并分别计算每组小鼠的平均体质量。
1.2.2肝癌细胞采集及计数用脱脂棉蘸乙醇擦拭H22种鼠腹部,以一次性注射器无菌采集其腹水,用生理盐水稀释后,取少量在显微镜下计数,使肝癌细胞密度达到2×109/L。肝癌细胞计数方法:将洁净的带有盖玻片的计数板置于显微镜下,找到视野,用滴管吸取少许瘤细胞稀释液从计数板一侧注入,使液体沿两玻片间渗入,勿使菌液流到盖玻片或两边平台上,多余的液体用吸水纸吸去,稍待片刻,先置低倍镜下观察,找到中央平台的方格网后,转换高倍镜取左上、右上、左下、右下及中央的中格进行计数。每毫升稀释液中肝癌细胞数=每小格平均细胞数×400×1 000×稀释倍数。
1.2.3接种将稀释并细胞计数后的腹水分别接种于66只小鼠右前肢腋窝皮下,每只接种0.2 mL。
1.2.4灌胃给药小鼠接种1 d后开始灌胃给药,每天每只定时灌胃给药0.2 mL,连续给药10 d。灌胃药现配现灌,以保持最佳药效。
1.2.5计算抑瘤率给药10 d后小鼠称质量后处死,剖取肝肿瘤组织,计算抑瘤率。抑瘤率=(生理盐水组平均瘤质量-样品组平均瘤质量)/生理盐水组平均瘤质量×100%。1.3统计学处理
采用SPSS 13.0软件进行统计学处理,所得计量数据以±s表示,组间比较采用单因素方差分析,以P<0.05为差异有显著性。
2结果
2.1不同剂量桑黄菌丝体多糖提取物对H22荷瘤小鼠的作用
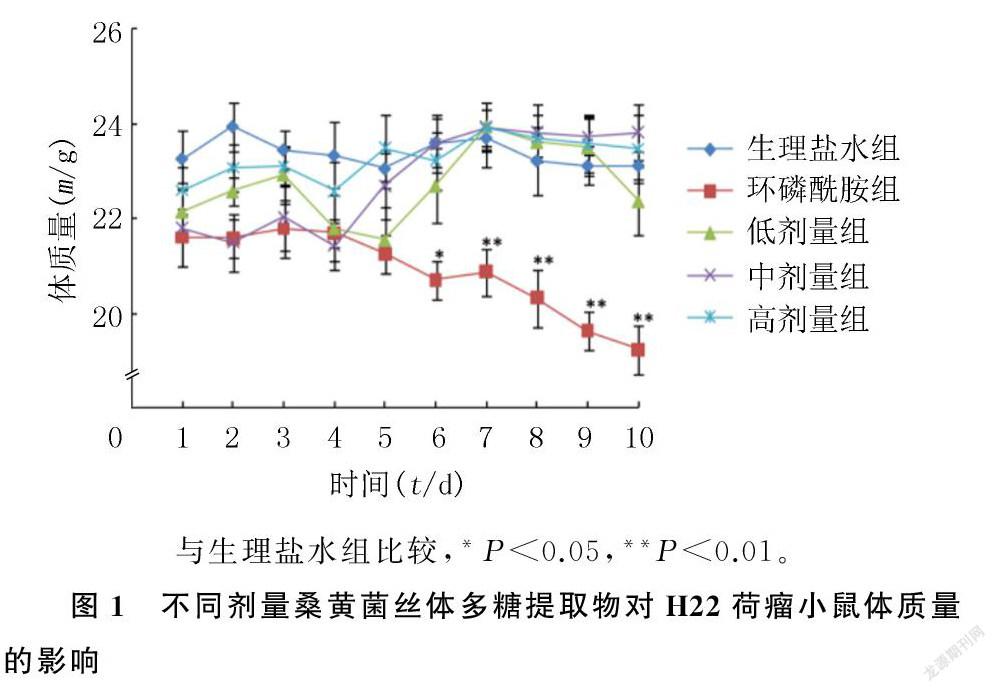
2.1.1对体质量的影响桑黄菌丝体多糖提取物低剂量组小鼠体质量在前3 d比较稳定,第4、5天虽有降低,但是从第6天开始体质量增加,第7天达到峰值;中剂量组小鼠体质量前4 d比较稳定,从第5天开始体质量急剧增加,第7天达到峰值;高剂量组小鼠体质量总体上逐渐增加,只是增量较小,比较稳定;生理盐水组小鼠的体质量总体上呈缓慢降低的趋势;环磷酰胺组小鼠体质量在前4 d很稳定,从第5天开始急剧下降,第10天降至最低。各组间体质量比较,仅环磷酰胺组在第6~10天时较生理盐水组显著下降(F=33.31~101.03,P<0.05、0.01),其他组差异均无显著性(P>0.05)。见图1。
2.1.2对肿瘤的抑制作用环磷酰胺组和桑黄菌丝体多糖提取物低剂量组、中剂量组、高剂量组的抑瘤率分别为(71.03±1.71)%、(32.87±6.25)%、(57.08±4.50)%和(68.35±2.50)%。桑黄菌丝体多糖提取物低剂量组和中剂量组的抑瘤率显著低于环磷酰胺组(F=214.91,P<0.01),而桑黄菌丝体多糖提取物高剂量组的抑瘤率与环磷酰胺组相比差异无显著性(P>0.05)。桑黄菌丝体多糖提取物对肿瘤的抑制作用呈一定的剂量效应关系,以高剂量组的抑瘤作用最强。不同剂量桑黄菌丝体多糖提取物的抑瘤率均大于30%,符合国家中医药管理局制定的治疗恶性肿瘤中药的评价标准。
2.2不同剂量桑黄子实体多糖提取物对H22荷瘤小鼠的作用
2.2.1对体质量的影响桑黄子实体多糖提取物低剂量组小鼠体质量总体上呈缓慢增加的趋势;中剂量组小鼠体质量在前4 d比较稳定,从第5天开始突然增加,第8天达到峰值;高剂量组小鼠体质量在前5 d比较稳定,从第6天开始增加,第8天达到峰值。桑黄子实体多糖提取物不同剂量组小鼠体质量均有所增加,但是增加量与剂量不呈量效关系,以中剂量组小鼠体质量增加最多。在第3~10天时,与生理盐水组相比,高剂量组、中剂量组小鼠体质量增加,环磷酰胺组小鼠体质量降低,差异均有显著性(F=22.01~149.25,P<0.05、0.01)。见图2。
2.2.2对肿瘤的抑制作用桑黄子实体多糖提取物低剂量组、中剂量组、高剂量组的抑瘤率分别为(44.19±4.81)%、(52.81±4.20)%和(73.69±2.00)%,低剂量组和中剂量组的抑瘤率显著低于环磷酰胺组(F=232.33,P<0.01),而高剂量组的抑瘤率与环磷酰胺组相比差异无显著性(P>0.05)。桑黄子实体多糖提取物对肿瘤的抑制作用呈一定的剂量效应关系,以高剂量组的抑瘤作用最强。
2.3不同剂量桑黄发酵液多糖提取物对H22荷瘤小鼠的作用
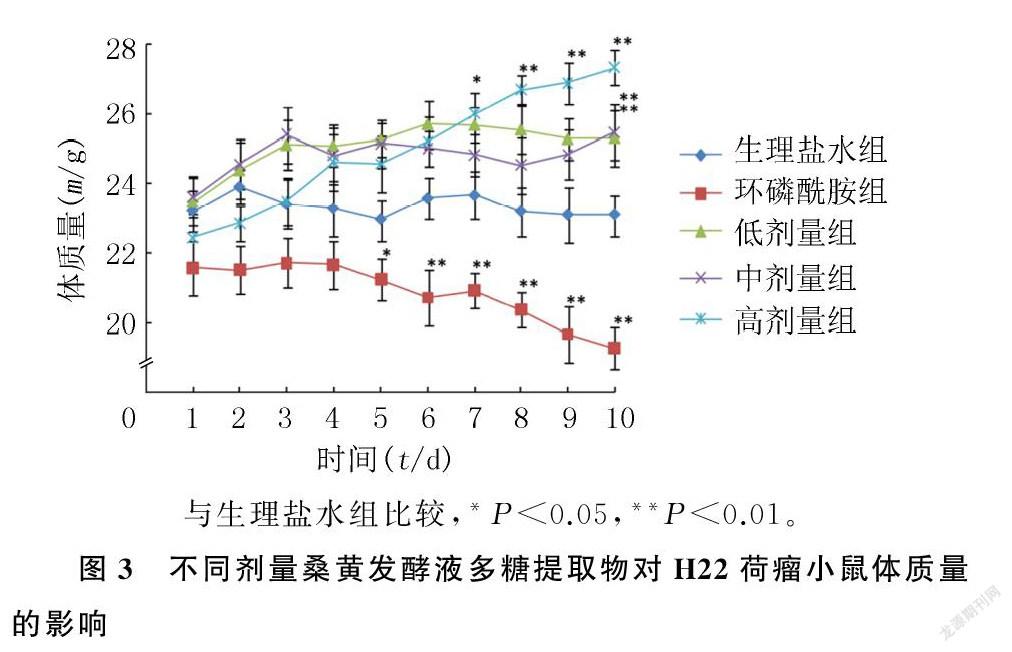
2.3.1对体质量的影响桑黄发酵液多糖提取物低剂量组小鼠体质量总体上呈缓慢增加的趋势;中剂量组小鼠体质量于第3天达到峰值,之后维持相对稳定;高剂量组小鼠体质量持续上升,于第10天达到峰值。桑黄发酵液多糖提取物增加小鼠体质量呈现一定剂量效应关系,以高剂量组小鼠体质量增加最多。各组间体质量比较,环磷酰胺组在第5~10天时较生理盐水组下降,高剂量组在第7~10天时较生理盐水组升高,中剂量组和低剂量组在第10天时较生理盐水组升高,差异均有统计学意义(F=56.25~169.05,P<0.05、0.01)。见图3。
2.3.2对肿瘤的抑制作用桑黄发酵液多糖提取物低剂量组、中剂量组、高剂量组的抑瘤率分别为(49.16±4.50)%、(50.63±4.21)%和(51.81±2.90)%,均显著低于环磷酰胺组(F=119.80,P<0.01),但桑黄发酵液多糖提取物不同剂量组间比较差异无显著性(P>0.05)。不同剂量桑黄发酵液多糖提取物的抑瘤率均大于30%,符合国家中医药管理局制定的治疗恶性肿瘤中药的评价标准。
3讨论
大量实验研究证实,桑黄对肿瘤细胞有直接抑制作用[14`-16]。桑黄可以抑制肿瘤细胞增殖[17`-19]、增强NK细胞活性[20]、缓解炎症[21],在抗氧化[22`-24]、清除自由基[25`-26]、抗肌纤维化[27`-28]、降低血糖[29]方面也有一定的作用。本实验结果表明,桑黄3种提取物不同剂量均具有明显抑制H22肝癌细胞生长的作用,其抑瘤率均大于30%,符合国家中医药管理局制定的治疗恶性肿瘤中药的评价标准。有文献报道,小鼠连续14 d以500 mg/kg剂量灌胃给予桑黄多糖,对移植性胃癌的抑制率为43.09%,对肉瘤S180的抑制率为46.07%[30]。
在本实验剂量范围内,对于同种桑黄提取物来说,抗肿瘤作用强度与剂量呈现一定的剂量效应关系,而相同剂量的不同提取物的抗肿瘤效果不同,提示桑黄3种提取物中多糖的种类和含量有差别。应瑞峰等[31]的研究结果表明,桑黄子实体多糖抗肿瘤效果(抑瘤率50%~80%)显著高于桑黄菌丝体多糖(抑瘤率20%~70%)。本研究中,抗肿瘤作用最强的是桑黄子实体多糖提取物的高剂量组,其抑瘤率为73.69%,与应瑞峰等[31]的研究结果相似。环磷酰胺虽然对肝癌的抑制效果好,但是由于其对小鼠的杀伤和毒副作用,降低了小鼠的免疫力。本文研究结果为进一步开发和利用桑黄多糖提取物提供了实验依据。
[参考文献]
[1]章灵华,肖培根. 药用真菌中生物活性多糖的研究进展[J]. 中草药, 1992,23(2):95`-99.
[2]栾英杰,侯万升. 神农本草经合注[M]. 北京:人民军医出版社, 2010.
[3]甄权,尚志钧. 药性论[M]. 合肥:安徽科学技术出版社, 2006.
[4]郭姗姗,WOLF DIETER RAUSCH. 火木层孔菌桑黄对MPP+诱导SH`-SY5Y细胞凋亡的影响[J]. 中国药物警戒, 2018,15(6):325`-328.
[5]戴玉成. 中国木本植物病原木材腐朽菌研究[J]. 菌物学报, 2012,31(4):493`-509.
[6]戴玉成,崔寶凯. 药用真菌桑黄种类研究[J]. 北京林业大学学报, 2014,34(5):1`-6.
[7]陈建华,孙捷,吕福娇,等. 桑黄发酵液中凝集素SHL24的分离与生物活性研究[J]. 微生物学通报, 2018,45(2):420`-427.
[8]张万国,胡晋红,蔡溱. 桑黄诱生γ`-干扰素与抗肝纤维化[J]. 中医药学报, 2002,30(6):22`-24.
[9]王华林,温万芬. 桑黄的药用价值研究进展[J]. 时珍国医国药, 2015,26(11):2747`-2750.
[10]包海鹰,王超儀,图力古尔. “桑黄”的本草考证[J]. 菌物学报, 2013,32(s1):70`-78.
[11]吕国英,王霄,宋婷婷,等. 两株野生桑黄液体发酵产物抗氧化活性比较[J]. 食药用菌, 2018,26(3):175`-177,183.
[12]史帧婷,包海鹰. 桑黄类真菌有效成分及功效研究进展[J]. 中国实验方剂学杂志, 2016,22(22):197`-202.
[13]陈柳萌,肖婧,李菁,等. 桑黄菌的研究进展[J]. 江西农业学报, 2007,19(5):88`-90.
[14]魏静,李金凤,温成平,等. 桑黄多糖对肝癌H22荷瘤小鼠的治疗作用[J]. 中药材, 2016,39(12):2868`-2870.
[15]胡启明. 桑黄菌丝体多糖的分离纯化、结构鉴定及生物活性研究[D]. 武汉:华中农业大学, 2013.
[16]刘燕琳,刘海燕,常金,等. 桑黄多糖对肉瘤S180细胞体内外的抑瘤作用[J]. 中国药房, 2017,28(22):3069`-3072.
[17]吕辉. 桑黄多糖及黄酮抗肿瘤活性比较研究[J]. 中医学报, 2018,33(1):27`-29.
[18]钟石,李有贵,林天宝,等. 桑黄多糖P1对肝癌HepG2细胞周期和钙调蛋白信号通路的影响[J]. 中国药理学与毒理学杂志, 2015,29(3):417`-423.
[19]丁云云,刘锋,施超,等. 桑黄化学成分及体外抗肿瘤活性研究[J]. 中国中药杂志, 2016,41(16):3042`-3048.
[20]宋爱荣,王光远,赵晨,等. 火针层孔菌(桑黄)粗多糖对荷瘤小鼠的免疫调节研究[J]. 菌物学报, 2009,28(2):295`-298.
[21]程建安,俞忠明. 桑黄水煎液对ICR小鼠体内抗炎作用的实验研究[J]. 浙江中医杂志, 2016,51(5):342`-343.
[22]王钦博,杨焱,艾连中,等. 药用真菌桑黄的抗氧化研究进展[J]. 食用菌学报, 2011,18(4):99`-104.
[23]曹春蕾,韩美玲,崔宝凯,等. 三种木层孔菌子实体不同溶剂提取物抗氧化活性的研究[J]. 菌物学报, 2013,32(5):883`-890.
[24]钱骅,赵伯涛,陈斌,等. 桑黄子实体多糖、黄酮和多酚含量与抗氧化活性相关性[J]. 食品工业科技, 2015,36(12):104`-108.
[25]郝瑞霞,周帅,杨焱,等. 不同来源的桑黄子实体醇提物中黄酮含量及生物活性的比较[J]. 食用菌学报, 2008,15(2):26`-29.
[26]闫景坤,马海乐,祝子坪,等. 桑黄菌胞内多糖的理化性质和体外抗氧化活性[J]. 食品科学, 2012,33(9):36`-40.
[27]张万国,胡晋红,蔡溱. 桑黄对实验性肝纤维化大鼠血液动力学的影响[J]. 解放军药学学报, 2002,18(6):341`-343.
[28]张万国,胡晋红. 桑黄预防大鼠肝纤维化作用的实验研究[J]. 药学服务与研究, 2002,2(2):82`-84.
[29]江湖大川,揭晓,吴丹麦,等. 桑黄活性成分的药理作用研究进展[J]. 浙江中西医结合杂志, 2018(3):215`-254.
[30]温克,陈劲,李红,等. 桑黄等四种抗癌药物抗癌活性比较[J]. 吉林大学学报(医学版), 2002,28(3):247`-249.
[31]应瑞峰,吴彩娥,黄梅桂,等. 桑黄子实体与菌丝多糖抗肿瘤活性研究[J]. 中国食品添加剂, 2017(12):57`-61.
