旱涝交替胁迫对杜鹃花生理特性的影响
2019-09-10李畅苏家乐刘晓青何丽斯肖政陈尚平
李畅 苏家乐 刘晓青 何丽斯 肖政 陈尚平
摘要:以对旱涝交替胁迫敏感性不同的2个杜鹃花品种为材料,通过对其旱涝交替胁迫下光合参数、丙二醛(MDA)含量、细胞膜相对透性、渗透调节物质及保护酶活性等的测定,研究旱涝交替胁迫对杜鹃花生理特性的影响。结果表明,旱涝交替胁迫下,2个杜鹃花品种叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、水分利用率(WUE)、PSII最大光化学效率(Fv/Fm)均较处理前显著下降。随着旱涝交替胁迫时间的延长,MDA含量、细胞膜相对透性、脯氨酸(Pro)含量呈上升趋势,可溶性糖含量、POD、CAT活性则先上升后下降。与抗性强的杜鹃花品种状元红相比,敏感品种琉球红在旱涝交替胁迫下Pn、Tr、Gs、WUE、Fv/Fm叶绿素含量下降幅度大,SOD、POD、CAT活性、Pro和可溶性糖含量增加幅度小,MDA含量、细胞膜相对透性增加幅度大。状元红在旱涝交替胁迫下能保持叶绿素含量的稳定,维持一定水平的净光合速率和水分利用率,保持膜系统处于相对完好的状态,能保持较高的抗氧化酶活性以清除活性氧,保持较高的脯氨酸含量以维持渗透调节系统的稳定性是其抗性强的部分原因。
关键词:杜鹃花;旱涝交替胁迫;生理特性
中图分类号:S685.21
文献标识码:A
文章编号:1000-4440(2019)02-0412-08
旱涝胁迫是植物生长发育中最常遇到的逆境胁迫之一,近年来,中国旱涝灾害频繁发生,特别是长江中下游地区,夏季“旱涝并存、旱涝急转”现象发生频次呈上升趋势,旱涝交替胁迫给植物的正常生长带来更大程度的影响,经济损失巨大[1-2]。旱涝灾害交替发生使得将耐旱与耐涝一并研究极有必要,以探明植物本身对旱涝交替胁迫下的反应,寻求解决植物水分胁迫的2个极端处理的统筹方案,逐步实现植物旱涝双抗目标。研究结果表明,植物的抗旱性和抗涝性均是受多因素控制、非常复杂的性状,各因素之间还存在交叉作用[3-7]。原生质体脱水是植物遭受旱害的核心,液相中含氧量少(即根際缺氧)则是涝害的核心问题,2种胁迫均引发植物形态和生理生化变化[8-9]。不同的植物在对旱、涝胁迫的响应及抗性机制上亦存在差异。
杜鹃花是杜鹃花科(Ericaceae)杜鹃属(Rhodo-dendron)植物的泛称,其在中国栽培历史悠久,是深受国人喜爱的十大传统名花之一。随着城市的发展,杜鹃花在园林绿化中应用面积逐年增加[10]。但,杜鹃花根系细且分布浅,对水分反应十分敏感,在野外生长、园林绿化及室内观赏栽培中,其生长最常受到环境中旱涝因素的影响,故研究其在旱、涝交替胁迫下如何发挥体内的响应机制尤为重要11-12]。目前,针对杜鹃花在水分胁迫下的生理特性研究主要集中在特定逆境下某个或某几个种类上,且对涝害研究报道极少,对旱涝交替胁迫下杜鹃花生理特性更是缺乏探究[2-1]。故本试验以对旱涝交替胁迫敏感性不同的杜鹃花为材料,探讨旱涝交替胁迫下2类杜鹃花种质在光合系统、抗氧化酶系统、渗透调节系统等方面的差异,在生理生化水平上解释杜鹃花对旱涝交替胁迫的生理机制,以期为旱涝双抗型杜鹃花种质的开发提供参考,为探讨增强杜鹃花耐涝抗旱性的有效途径和寻找克服或缓解杜鹃花旱涝危害的方法提供理论依据和技术指导。
1 材料与方法
1.1 试验材料
选取对水分胁迫响应差异较大的2个杜鹃花品种琉球红和状元红为试验材料[17]。其中琉球红为旱涝水分胁迫敏感型,状元红为忍耐型。
1.2 试验方法
试验在智能玻璃温室中进行,选用生长势一致、健壮的3年生实生苗进行盆栽试验,每盆1株,塑料盆直径18cm,高16cm。盆土由泥炭和珍珠岩3:1(体积比)混合配成,最大田间持水量55.07%。于2014年7月进行旱涝交替胁迫:先进行重度干旱胁迫处理,即土壤水分含量为最大田间持水量的30%士5%[13],处理时先浇透水后使土壤水分自然消耗,待达到重度干旱胁迫标准后,采用称质量补水法将土壤水分含量控制在设定范围内,重度干旱胁迫时长为15d;干旱处理15d后进行旱后的淹水胁迫处理,采用盆栽淹水法,即将花盆置入大的塑料周转箱中,淹水过土面2~3cem,定时补水以保证水位,持续20d。试验10盆为1个处理,重复3次,随机排列。
1.3 测定项目与方法
分别于胁迫处理前(CK,0d)、干旱胁迫15d、旱后淹水胁迫3d和旱后淹水胁迫20d进行光合特性和叶绿素荧光参数的测定,并同时于上午采集植株上部成熟叶片进行生理指标的测定。
1.3.1 光合参数测定采用Li-6400便携式光合分析仪进行测定。分别于晴天上午9:00-11:00,选取植株上部未被遮挡的成熟叶,在饱和光照度下完成60min的光诱导后,控制光合有效辐射(PAR)为800 μumol/(m2·s),开放气路测定叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)等光合参数。每个测定重复5次,取平均值。并根据公式WUE=Pn/Tr,计算瞬时水分利用率(WUE)。
1.3.2 叶绿素荧光参数测定采用PAM-2100便携式荧光仪(德国Walz公司产品)进行测定。选取待测植株上部功能叶,经过30min充分暗适应,用小于0.05 μmol/(m2·s)的测量光照射叶片,测得初始荧光(Fo),随后施加饱和脉冲光[8000μmol/(m2·s),0.8s],测得最大荧光(Fm)。并由Fo、Fm计算暗适应叶片PSII最大光化学效率(Fv/Fm)[18]。
1.3.3 生理指标的测定叶绿素含量的测定采用乙醇丙酮混合液浸提法[19],丙二醛(MDA)含量的测定采用硫代巴比妥酸法[20],细胞膜相对透性的测定采用电导仪法[20],游离脯氨酸含量的测定采用酸性茚三酮法[20],可溶性糖的测定采用蒽酮比色法[20]超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性的测定采用试剂盒法,试剂盒由南京建成生物有限公司提供[21]。oooooo所需上清液均按李合生[20]的方法制备,按试剂盒说明书操作、比色,运用试剂盒提供的公式计算出SOD、POD、CAT活性。
1.4 数据分析
所有测定结果取平均值+标准差,采用SPSS 18.0软件进行单因素方差分析,使用最小显著差数法(LSD)比较差异显著性,使用Excel 2003绘制图表。
2 结果与分析
2.1 旱涝交替胁迫对杜鹃花叶片光合参数及水分利用率的影响
2.1.1 净光合速率
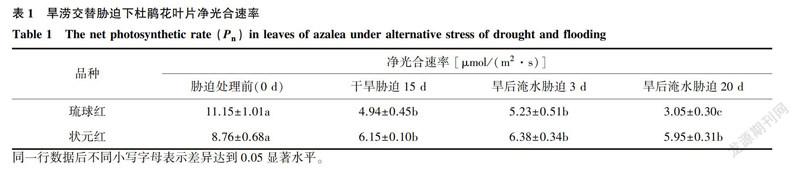
由表1可以看出,旱涝交替胁迫下,2个杜鹃花品种叶片的净光合速率均较CK显著下降。其中,千旱胁迫15d,琉球红和状元红分别较CK降低了55.70%和29.79%,旱后淹水胁迫20d则分别较CK降低了72.64%和32.07%。琉球红P。下降幅度远大于状元红。说明旱涝交替胁迫显著抑制了杜鹃花叶片的碳同化能力,且对水分胁迫敏感的琉球红受抑制程度更高。
2.1.2 气体交换参数
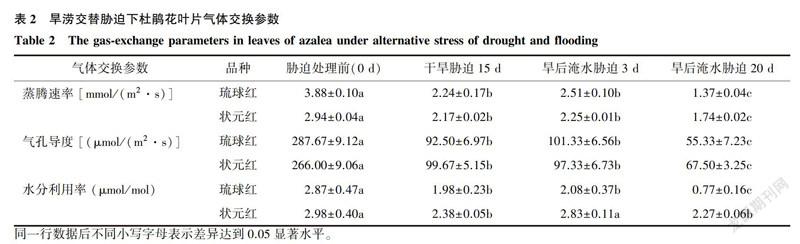
旱涝交替胁迫下2个杜鹃花品种叶片蒸腾速率、气孔导度以及水分利用率的变化如表2所示。除旱后淹水胁迫3d处理下的状,元红的WUE外,旱涝交替胁迫下2个杜鹃花品种的Tr、Gs、WUE均显著低于处理前(CK);均在旱后淹水胁迫20d达到最小值,其中琉球红和状元红Tr,较CK分别降低了64.68%和40.82%,Gs较CK分别降低了80.77%和74.62%,WUE较CK分别降低了73.17%和23.82%。同一处理下3个指标的下降幅度均是琉球红>状元红。说明旱涝交替胁迫抑制了杜鹃花叶片水分的蒸腾和利用效率,气孔开度变小,使得体内水分运输和代谢减缓,且随胁迫时间的延长,对水分胁迫敏感的杜鹃花琉球红受到的抑制作用更加明显。
2.2 旱涝交替胁迫对杜鹃花叶片叶绿素荧光参数及叶绿素含量的影响
2.2.1 叶绿素荧光参数
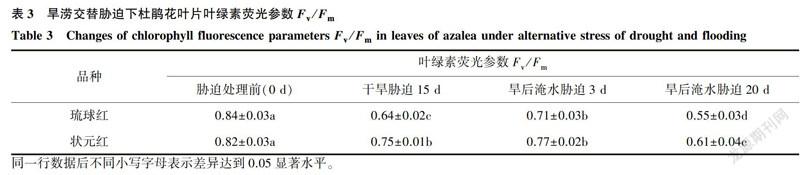
最大光化学效率Fv/Fm可反映PSII反应中心捕获激发能的效率与利用能力[22]。如表3所示,2个杜鹃花品种处理前Fv/Fm值分别为0.84、0.82,这与Genty等l23]报道的Fv/Fm在非胁迫条件下比较恒定,一般介于0.80~0.85相吻合,说明这2个杜鹃花品种生长状态良好,未受胁迫,也从侧面说明了其他荧光指标的可靠性。旱涝交替胁迫下,2个杜鹃花品种随着胁迫时间的延续Fv/Fm均呈现先显著下降后小幅度升高最后又显著下降的趋势,均与CK差异显著。相同处理条件下,琉球红Fv/Fm下降幅度大于状元红;旱后淹水胁迫20d,Fv/Fm降至最低,其中琉球红Fv/Fm仅为对照的65.48%。说明旱涝交替胁迫下,杜鹃花PSII反应中心受到损伤,且随胁迫时间的加长,PSII反应中心的损伤加大;同时也说明状元红较琉球红而言,在旱涝交替胁迫处理下能维持较强的光化学活性。
2.2.2 叶绿素含量
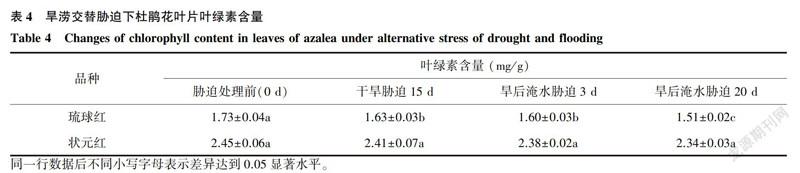
对叶绿素含量的测定结果显示,琉球红叶片叶绿素含量低于状元红(表4)。旱涝交替胁迫下,2个杜鹃花品种叶片叶绿素含量均呈现下降趋势,但下降的幅度琉球红>状元红。旱涝交替胁迫下琉球红叶片叶绿素含量均显著低于处理前,而状元红叶绿素含量与处理前差异不显著。
同一胁迫处理条件下,琉球红叶绿素含量相对值(即处理/对照)低于状元红。说明琉球红叶片的叶绿素在干旱胁迫15d就开始迅速降解,而状元红叶片叶绿素基本不降解,也说明了琉球红较状元红对水分胁迫反应敏感。
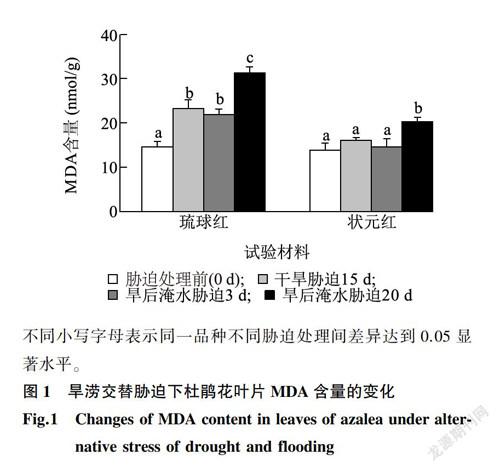
2.3 旱涝交替胁迫对杜鹃花叶片MDA含量和细胞膜相对透性的影响
2.3.1 MDA含量
MDA含量的变化可以在一定程度上反映植物体内自由基的动态和细胞的受损程度,在衡量植物对逆境条件反应的强弱中广泛应用[14]。由图1可以看出,随着旱涝交替胁迫时间的延长,2个杜鹃花品种MDA含量变化均呈现在千旱胁迫下增加,旱后淹水胁迫初期略有下降,旱后淹水末期上升的趋势。琉球红各处理MDA含量均较处理前显著升高,而状元红则在旱后淹水胁迫末期与处理前差异显著。相同处理条件下对水分胁迫敏感的杜鹃花琉球红MDA上升的幅度大于抗性强的状元红。旱后淹水胁迫20d,琉球红MDA含量为处理前的2.15倍,而状元红则为1.46倍。说明对水分胁迫敏感的琉球红叶片细胞膜系统受到损伤的程度高于抗性强的状元红。
2.3.2 细胞膜相对透性
逆境条件下,植物叶片细胞膜相对透性常用叶片的相对电导率来表示。如图2所示,旱涝交替胁迫下2个杜鹃花品种叶片的相对电导率變化趋势与MDA相同。琉球红各处理相对电导率均较处理前显著升高,而状元红则在干旱胁迫15d以及旱后淹水胁迫末期与处理前差异显著。同样,相同处理条件下对水分胁迫敏感的琉球红相对电导率上升的幅度大于抗性强的状元红。在旱后淹水胁迫20d时,琉球红相对电导率为处理前的1.77倍,而状元红则为1.39倍。说明对水分胁迫敏感的琉球红细胞膜透性受到的伤害大于抗性强的状元红。
2.4 旱涝交替胁迫对杜鹃花叶片有机渗透调节物质含量的影响
2.4.1 脯氨酸含量
脯氨酸是生物体氮代谢过程中产生的具有生物活性的次生代谢物质,作为重要的渗透调节物质,在逆境条件下,植物体内脯氨酸的含量可迅速增加,以增强植物对干旱、湿涝等逆境胁迫的抗性,故其含量的高低是植物抗逆性强弱的指标之一[24]o如图3所示,旱涝交替胁迫下2个杜鹃花品种脯氨酸含量均随胁迫时间的延长而增加,均与处理前差异显著。其中,抗性较强的状元红在相同处理条件下脯氨酸较处理前增加的幅度明显高于琉球红。在旱后淹水胁迫20d,琉球红脯氨酸为处理前的1.86倍,而状元红则为2.21倍。说明随着旱涝交替胁迫的持续,状元红体内积累了更多的脯氨酸以增强其抗水分胁迫的能力。
2.4.2 可溶性糖含量
可溶性糖是植物体内的重要的有机渗透调节物质之一。如图4所示,随着旱涝交替胁迫时间的延长,2个杜鹃花品种叶片可溶性糖含量均呈现先较处理前显著增加后降低的趋势。在相同处理条件下对水分胁迫敏感的琉球红可溶性糖含量上升的幅度均小于抗性强的状元红,下降幅度则大于状元红。旱后淹水胁迫初期,琉球红和状元红可溶性糖含量均达到最大值,分别为处理前的1.29倍和1.71倍。旱后淹水胁迫末期琉球红可溶性糖含量迅速下降,显著低于处理前,而状元红可溶性糖含量虽然也呈下降趋势.但仍显著高于处理前可溶性糖含量。可见,旱涝交替胁迫下2个杜鹃花品种均可通过增加自身有机渗透调节物质的含量来抵御逆境,且增加量上以抗性强的状元红居高。
2.5 旱涝交替胁迫对杜鹃花叶片抗氧化酶活性的影响
2.5.1 SOD活性
如图5所示,旱涝交替胁迫下2个杜鹃花品种SOD活性变化呈现不同趋势。对水分胁迫敏感的杜鹃花琉球红SOD活性均较处理前降低,除了旱后淹水胁迫3d,其他处理SOD活性均与处理前差异显著。状元红SOD活性则随胁迫时间的延长呈现先增加后降低的趋势,在旱后淹水胁迫3d SOD活性达到最大,为处理前的1.22倍。说明旱涝交替胁迫下,对水分胁迫忍耐性较强的杜鹃花状元红在干旱胁迫和旱后淹水胁迫初期SOD活性显著提高以清除活性氧,在旱后淹水胁迫后期状元红细胞膜虽受到一定的损伤但未超过SOD活性的忍耐限度,SOD仍具有较高的活性来清除氧自由基。
2.5.2 POD活性如图5所示,2个杜鹃花品种叶片在旱涝交替胁迫下POD活性变化趋势一致,均随胁迫时间的增加呈现先上升后下降的趋势,均在旱后淹水胁迫初期(旱后淹水3d)达到最大值,之后显著下降。说明随着旱涝交替胁迫时间延长(旱后淹水20d),POD活性受到了抑制。在相同处理条件下对水分胁迫抗性强的状元红POD活性上升的幅度大于敏感型的琉球红,下降幅度则小于琉球红,且状元红在旱涝交替胁迫试验时间内POD活性均显著高于处理前,说明抗性强的状元红在旱涝交替胁迫下亦具有较高的POD活性以清除氧自由基,以增强对旱涝交替胁迫的适应性。
2.5.3 CAT活性
如图5所示,2个杜鹃花品种叶片在旱涝交替胁迫下CAT活性变化趋势一致,均随着旱涝交替胁迫时间的延长呈现先显著上升,在旱后淹水3d达到最大值,之后显著下降的趋势。相同处理条件下,琉球红CAT活性上升幅度低于状元红,旱后淹水3d,琉球红CAT活性达到最大值,较处理前上升了28.31%,低于状元红(39.13%)。旱后淹水20d,琉球红CAT活性下降的幅度(27.21%)大于状元红(22.50%),但与处理前差异不显著,说明在旱涝胁迫后期,细胞膜受到损伤,2个杜鹃花CAT活性下降,但未超过CAT活性的忍耐限度。水分胁迫下,抗性强的状元红亦通过增强CAT活性来抵御过量的活性氧自由基造成的伤害。
3 讨论
有关水分胁迫下植物光合生理特性的研究已有大量报道,逆境胁迫均导致光合作用下降[25-27]其中气孔关闭,致使气孔导度下降是涝害下绝大多数植物光合速率降低的主要原因;而叶绿体片层结构受损,使叶绿素含量下降、光系统II活力下降则是干旱下光合作用下降的主因[28-29]。但由于光合作用对水分胁迫响应存在复杂性,受植物本身基因型、水分胁迫程度的强弱以及其他环境因素的制约,得出的结论不尽相同[29-31]。本研究中,旱涝交替胁迫下,杜鹃花叶片的Pn、Tr、Gs、WUE、Fv/Fm均显著下降,这与多数研究结果一致[21,30-32]同时,叶片叶绿素含量也呈下降趋势,下降趋势与Pn,相似。说明在旱涝交替胁迫下,气孔因素与非气孔因素均在2个杜鹃花品种的光合抑制中起作用。当然,关于旱涝交替胁迫下杜鹃花在光合限制中是气孔因素还是非气孔因素在先,尚有待于设置更细化的時间变量以及胁迫强度来证实。研究中,状元红叶片Pn、Tr、Gs、WUE、Fv/Fm和叶绿素含量较对照的下降幅度均小于琉球红,说明在胁迫下保持叶绿素含量的稳定,维持一定水平的净光合速率,有效保持PSII功能的相对完整性和相对较高的水分代谢能力,是旱涝双抗型杜鹃花品种状元红抗性强的原因之一。
从遗传角度看,植物的抗渗透胁迫功能是一种数量性状,是由多基因控制的综合反映,例如,在旱涝胁迫下,植物在遭受胁迫时膜脂过氧化导致MDA积累,膜流动性降低,膜透性增强,同时植物体内会通过积累一些可溶性糖、脯氨酸等可溶性物质来进行渗透调节[33]。本研究中,旱涝交替胁迫下,MDA含量和细胞膜相对透性较对照升高,可溶性糖含量随胁迫时间先上升后下降,脯氨酸含量持续增加,这与前人研究结果相似[21,31]。相同胁迫条件下,状元红MDA含量和细胞膜透性增加的幅度显著低于琉球红,可溶性糖、脯氨酸含量增加幅度大,说明水分胁迫下抗性强的杜鹃花品种受到膜质过氧化伤害小,可积累较多的有机渗透调节物质,来调节植物细胞内渗透压与外界平衡,维持渗透平衡和体内水分,以减轻胁迫所造成的伤害。
水分胁迫可诱导活性氧离子积累,导致植物体内活性氧代谢系统失去平衡,而植物在长期进化过程中形成了包括SOD、POD和CAT在内的膜脂抗氧化酶防御系统,可清除活性氧,以维持细胞膜的稳定性,保护细胞免受膜脂过氧化作用引起的伤害[11,21,31]。本研究中,3种抗氧化酶对旱涝交替胁迫的响应存在差异,说明杜鹃花在旱涝交替胁迫危害下各氧化酶防御系统之间存在协同作用的同时又有复杂的内在关系。相同胁迫条件下,琉球红抗氧化酶活性上升的速度和幅度小于抗性强的状元红,下降幅度大于抗性强的状元红,说明在旱涝交替胁迫下,抗性强的杜鹃花品种通过保持膜系统处于相对完好的状态,保持较高的抗氧化酶活性而增强植株的抗水分胁迫能力。
综上所述,旱涝交替胁迫对杜鹃花叶片光合系统、抗氧化酶系统、渗透调节系统产生不同程度伤害,抗性弱的杜鹃花品种琉球红受抑制程度更大;同时,杜鹃花也会通过一系列的生理特性的改变来主动适应逆境,以使旱涝胁迫对杜鹃花的抑制损伤降到最低。旱涝双抗型杜鹃花品种状元红在胁迫下能保持叶绿素含量的稳定,维持一定水平的净光合速率,保持膜系统处于相对完好的状态,能保持较高的抗氧化酶活性以清除活性氧,较高的脯氨酸含量以维持渗透调节系统的稳定性是其抗性强的部分原因。因此,实际生产中可根据旱涝交替胁迫下光合系统抗氧化酶系统、渗透调节系统指标来选育旱涝双抗性杜鹃花品种,并可通过提高杜鹃花叶片的Pn、叶绿素含量、脯氨酸含量、抗氧化酶活性等来提高旱涝交替胁迫条件下杜鹃花的耐受性。
参考文献:
[1]吴志伟.长江中下游夏季风降水“旱涝并存、旱涝急转"现象的研究[D].南京:南京信息工程大学,2006.
[2]闪丽洁,张利平,张艳军,等.长江中下游流域旱涝急转事件特征分析及其与ENSO的关系[J].地理学报,2018,73(1):25-40
[3]赖金莉,李欣欣,薛磊,等.植物抗旱性研究进展[J].江苏农业科学,2018,46(17):23-27.
[4]谢宏伟,徐庆国,李阳.黑麦草高温胁迫抗性与抗旱性遗传育种研究进展[J].作物研究,2011,25(1):89-94.
[5]何静丹,文仁来,田树云,等.抽雄期干旱胁迫与复水对不同玉米品种生长及产量的影响[J].南方农业学报,2017,48(3):408-415.
[6]张丽丽,徐碧玉,刘菊华,等.MaASRI基因通过乙烯途径提高拟南芥抗旱性的作用机制[J].江苏农业学报,2018,34(3):511-519.
[7]生利霞,王倩,孟祥毅,等.植物耐涝分子机理研究进展[J].分子植物育种,2017,15(7):2823-2828.
[8]王忠.植物生理学[M].北京:中国农业出版社,2000.
[9]甄博,郭相平,陆红飞,等.分蘖期旱涝交替胁迫对水稻生理特性的影响[J].灌溉排水学报,2017,36(5):36-40.
[10]刘晓青,苏家乐,李畅,等.杜鹃在园林中的应用[J].现代园林,2013,10(10):37-40.
[11]张长芹.杜鹃花[M].北京:中国建筑工业出版社,2003.
[12]李波,吴月燕,崔鹏.水分胁迫对2种基因型杜鹃生理生化特性的影响[J].浙江农业学报,2011,23(5):988-994.
[13]柯世省,杨敏文.水分胁迫对云锦杜鹃抗氧化系统和脂类过氧化的影响[J].园艺学报,2007,34(5):1217-1222.
[14]黄承玲,陈训,高贵龙.3种高山杜鹃对持续干旱的生理响应及抗旱性评价[J].林业科学,2011,47(6):48-55.
[15]李畅,苏家乐,刘晓青,等.干旱胁迫对鹿角杜鹃种子萌发和幼苗生理特性的影响[J].西北植物学报,2015,35(7):1421-1427.
[16]高晓宁,赵冰,刘旭梅,等.4个杜鹃花品种对干旱胁迫的生理响应及抗旱性评价[J].浙江农林大学学报,2017,34(4):597-607.
[17]胡肖肖,唐字力,贾梅,等.干旱胁迫对13个杜鹃品种生理特性的影响[J].江苏农业科学,2017,45(6):101-105.
[18]KOOTEN O V,SNELJ F H.The use of chlorophyll fluorescence nomenclature in plant stress physiology[J].Photosynthesis Research,1990,25:147-150.
[19]李畅,苏家乐,刘晓青,等.一品红不同品种叶片叶绿素荧光特性比较[J].园艺学报,2009,36(10):1519-1524.
[20]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2006.
[21]白鹏,冉春艳,谢小玉.干旱胁迫对油菜蕾薹期生理特性及农艺性状的影响[J].中国农业科学,2014,47(18):3566-3576.
[22]PAPAGEORGIOU E,GOVINDJEE G C.Chlorophyll a fluorescence:a signature of photosynthesis[J].Jourmal of Plant Physiology,2016,163(6):689-690.
[23]GENTY B,BRIANTAISJ M,BAKER N R.The relationship be-
tween the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochimica Biophysica Acta,1989,990:87-92.
[24]周军,武金翠,杜宝明,等.4种藤本植物的抗旱性比较[J].江苏农业学报,2016,32(3):674-679.
[25]尤超,沈虹,张营营,等.油桃生理特性对水分胁迫的响应[J].江苏农业科学,2018,46(16):98-101.
[26]吴正花,喻理飞,严令斌,等.三叶木通叶片解剖结构和光合特征对干旱胁迫的响应[J].南方农业学报,2018,49(6):1156-1163.
[27]孔晓君,王恒,庄美琪,等.水分胁迫对茶树叶片二氧化碳响应的影响[J].山东农业科学,2018,50(5):55-58,63.
[28]SHARP R E,POROYKO V,HEJLEK L G,et al.Root growth maintenance during water deficits:physiology to functional genomics[J].Journal of Experimental Botany,2004,55(407):2343-2351.
[29]柯世省,杨敏文.水分胁迫对云锦杜鹃光合生理和光温响应的影响[J].园艺学报,2007,34(4):959-964.
[30]张斌斌,马瑞娟,蔡志翔,等.3个桃砧木品种对淹水的光合生理响应特征[J].西北植物学报,2013,33(1):146-153.
[31]路之娟,張永清,张楚,等.不同基因型苦荞苗期抗旱性综合评价及指标筛选[J].中国农业科学,2017,50(17):3311-3322.
[32]刘广勤,朱海军,周蓓蓓,等.旱涝胁迫对薄壳山核桃光合特性和叶绿体超微结构的影响[J].江苏农业学报,2012,28(6):1429-1433.
[33]SAKRARR K,DAS A.Changes in antioxidative enzymes and antioxidnats in relation to flooding tolerance in rice[J].Journal ofPlant Biology,2000,27(3):307-311.
