M342抗除草剂基因CAPS标记的开发与应用
2019-09-10程丽胡茂龙浦惠明龙卫华高建芹陈锋周晓婴张维陈松张洁夫
程丽 胡茂龙 浦惠明 龙卫华 高建芹 陈锋 周晓婴 张维 陈松 张洁夫





摘要:M342是利用EMS诱变定向选育获得的甘蓝型油菜抗磺酰脲类除草剂新种质。通过M342抗性基因与敏感型油菜的ALS基因序列分析结果表明,M342的BnALS3基因存在1处SNP突变,导致编码的蛋白质第556位色氨酸突变为亮氨酸,该突变导致基因序列对BsrDI内切酶消化的差异。为此设计了8条引物,从中筛选到引物对SU54F/SU58R在不同油菜品种中可以特异性扩增出目的片段,该片段经BsrDI酶切分型正确,从而开发了检测M342中抗性基因BnALS3R的CAPS标记。运用该标记对除草剂敏感型油菜纯合抗性油菜及杂合抗性油菜BnALS3的基因型进行验证,并应用该标记对F、BC分离群体进行检测。结果表明,该标记验证的基因型结果与测序结果一致。F分离群体有Als3Als3、Als3als3、als3als3 3种基因型,BC分离群体有Als3als3、als3als3 2种基因型,与表型鉴定结果一致,遵循单基因遗传分离规律,表明该标记可以应用于抗性基因的检测。CAPS标记的获得为抗除草剂油菜的分子标记辅助选择育种奠定了基础。
关键词:油菜;磺酰脲类除草剂;乙酰乳酸合酶;酶切扩增多态性序列(CAPS)标记
中图分类号:Q789
文献标识码:A
文章编号:1000-4440(2019)02-0241-07
有效治理田间杂草是油菜实现机械化、轻简化生产的一个重要环节,化学除草是目前控制农田杂草最有效的手段。磺酰脲(Sulfonylurea,SU)类除草剂因其具有高效低量,对动物无害,高选择性,土壤残留期短等优点被应用于水稻(Oryza sativa)、小麦(Triticum aestium L)、玉米(Zea mays)等单子叶作物田间杂草的防除”。油菜(Brassica napus L.)为双子叶植物,对商业化的磺酰脲类除草剂敏感,选育抗SU类除草剂的油菜新品种,拓宽现有SU类除草剂的应用范围,是油菜田间杂草治理经济有效的途径。
SU类除草剂属于乙酰羟基酸合酶(AHAS)抑制剂类除草剂,作用靶标是AHAS。AHAS也叫乙酰乳酸合酶(ALS),是植物支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)生物合成过程中的关键酶。除SU类外,ALS类除草剂还包括咪唑啉酮类(Imidazolino-nes,IMIl)、三唑嘧啶磺酰胺(Triazolopyrimidines,TZ)、嘧啶水杨酸类(Pyrimidyloxy-benzoates,PB)和磺酰氨羧基三唑啉酮类(Sulfonlyaminocarbonyl-tri-azolinones,SCT)等。这类除草剂的杀草机理是除草剂分子与ALS形成复合物阻断底物进入酶活性位点通路,抑制ALS活性,导致支链氨基酸合成受阻,生物体内蛋白质合成被破坏,使植物失绿、黄化,最后逐渐死亡。植物产生抗性是由于其ALS基因发生了若干碱基位点的突变,造成编码蛋白质氨基酸残基位点变异,从而改变除草剂与ALS的结合方式产生抗性。在已发现的抗性突变体中,主要涉及8个ALS氨基酸位点突变,这8个位点分别是Ala122、Pro197、Ala205、Asp376、Arg377、Trp574、Ser653、Gly654[以拟南芥(Arabidopsisthaliana)的ALS氨基酸位置计算],其中对SU类除草剂产生抗性的氨基酸突变位点主要有Pro197、Ala205和Trp574。在油菜中,Swanson等通过诱变油菜小孢子获得了对IMI类除草剂具有抗性的油菜P1和P2。P1的抗性突变位点是BnALSI的Ser653Asp,P2的抗性突变位点是BnALS3的Trp574Leu。Magha等在培养油菜原生质体后代时发现突变体RCS-5对SU类和IMI类除草剂具有抗性,但未揭示突变位点。有研究者在大豆(Glycinemax)和油菜轮作的试验田中发现1株抗IMI类除草剂油菜M9,并揭示了M9的突变位点为BnALSI的Ser653Asp。浦惠明等利用EMS诱变和定向选育技术,获得了抗SU类除草剂的甘蓝型油菜突变体M342。M342在苯磺隆推荐使用质量浓度下无任何药害症状,仍能正常生长。胡茂龙等进一步通过分子生物学技术克隆得到M342抗性基因,突变位点为BnALS3的Trp574Leu。根据该突变体BnALS3的突变位点,开发检测油菜抗SU类除草剂性状的分子标记,通过标记快速区分油菜中抗性基因的基因型,指导油菜抗性育种,加快选育进程。
酶切扩增多态性序列(Cleaved amplified poly-morphic sequence,CAPS)是通过设计特异性引物扩增出目的片段,然后通过限制性内切酶消化PCR产物,电泳检测不同大小的酶切片段来检测基因型的技术。CAPS标记是PCR和RFLP(Restrictionfragment length polymorphism)的有机结合,该方法快速直观,避免了RFLP分析中膜转印这一繁琐步骤,又能保持RFLP分析的精确度,且是共显性标记,已广泛应用于靶基因突变导致的抗性植株的检测。然而,在油菜中利用CAPS标记检测抗除草剂的突变基因还鲜见报道。本研究以M342抗性突变体为材料,开发能快速准确检测抗性基因BnALS3R基因型的CAPS标记,为油菜抗除草剂分子辅助选择育种奠定基础。
1 材料与方法
1.1 试验材料与试剂
M342、M294-2等纯合抗性材料是由江苏省农业科学院经济作物研究所油菜研究室在EMS诱变体库中通过非选择性除草剂大群体定向筛选或通过与M342杂交回交转育获得,宁油20号,N131、D1-2、D3-1等敏感材料,MICMS双低恢复系N221、N340和N341由本研究室保存。
高保真性DNA聚合酶KOD-Plus及PCR試剂购自东洋纺(上海)生物科技有限公司,克隆载体pEASY-1购自北京全式金生物技术有限公司。DNA分子量标准、普通TaqDNA聚合酶、dNTPMixture、10XExTaq Buffer PCR、PCR产物平末端加A试剂盒均购自TaKaRa生物工程有限公司(中国大连)。大肠杆菌E.coli DH5a由本实验室保存。引物合成、DNA测序均由南京金斯瑞生物科技有限公司完成。BsrDI限制性内切酶(NEB)购于南京伟沃生物科技有限公司。苯磺隆除草剂为江苏省激素研究所股份有限公司生产的10%苯磺隆可湿性粉剂。
1.2 CAPS标记开发
利用EMS诱变和定向选育技术,我们获得了甘蓝型油菜抗SU类除草剂突变体M342,该突变体是BnALS3基因起始密码子第一个核苷酸下游的+1667位点单碱基G突变为T,导致第574位色氨酸突变为亮氨酸(以拟南芥的ALS氨基酸位置计算)。随后,运用PrimerPremier5分析了M342和野生型油菜N131之间酶切位点的差异,发现野生型油菜N131的BnALS3基因+1667位点的碱基G与其上游+1662至+1666的5个碱基构成的核苷酸序列“GCAATG”是限制性内切酶BsrD I的识别剪切位点。为明确该序列在多个敏感型油菜品种中的保守性,设计了引物对A1(表1),采用CTAB法对敏感型油菜宁油20号、N221、N340和N341提取DNA,PCR克隆4个油菜品种的BnALS3基因。PCR反应体系包含1.0μlDNA模板、2.0μl10x酶反应缓冲液、1.2μl25mmol/LMgSO4、2.0μl2mmol/LdNTPs.0.8μl1U/LKOD-PlusTaq酶、13.0μlH20。反应程序94C预变性5min;94C变性30s,55C退火30s,72C延伸2min,35个循环;72C延伸5min。按照试剂盒使用说明书对PCR产物进行平末端加A后,用1%(质量体积比)的琼脂糖凝胶电泳回收纯化,回收片段连接pEASY-T1载体,转化大肠杆菌DH5ar,挑取阳性克隆测序。
甘蓝型油菜AC基因组有3个ALS功能基因,其中C基因组上的BnALSI和A基因组上的BnALS3在核酸和蛋白水平同源性达98%,为了避免不同油菜品种BnALSI对抗性基因检测的干扰,设计引物对A2,同样对宁油20号、N221、N340和N341的BnALSI基因进行克隆、测序。利用DNA-MAN V6软件分析M342、N131、宁油20号、N221、N340和N341的BnALSI、BnALS3基因序列差异,在BnALS3基因+1662~+1667序列的两端设计了8条引物(表1),正反引物分别锚定在BnALSI、BnALS3核苷酸差异序列上,以期特异性扩增BnALS3基因片段。接着以M342的5个单株,上述5种除草剂敏感型油菜(N131、宁油20号、N221、N340和N341)以及M342的5个单株为父本与上述5种除草剂敏感型油菜为母本杂交的F,为材料,提取油菜基因组DNA,使用上述8条引物组合成的16对引物进行扩增。反应体系如下:20ngDNA,0.5μmol/L引物,1x酶反应缓冲液,1.5mmoL MgCl,0.2mmol/LdNTP,0.5UTaq酶。PCR扩增程序为:94C预变性5min;94C变性30s,55C退火30s,72C延伸45s,共35个循环;72C延伸5min,4C保存。PCR产物一部分纯化测序,一部分用限制性内切酶进行酶切,25.0μl酶切反应体系包括:PCR产物5.0μl,10x酶反应缓冲液2.5μl,内切酶0.5μl,水17.0μl。65C下反应3~5h。用1.5%(质量体积比)的琼脂糖凝胶检测酶切产物。
1.3 CAPS标记的验证
对抗性油菜M294-2、敏感型油菜D1-2和抗性油菜M305、M306与敏感型油菜D42.D162杂交的F,及亲本种子进行萌发。7d后,取适量幼苗提取DNA,并用1%(体积质量比)的琼脂糖凝胶电泳和分光光度计检测DNA浓度和纯度。引物对SU54F/SU58R扩增出目的片段,并用BsrD I进行酶切,验证CAPS标记。DNA提取、PCR反应、酶切分型方法同方法1.2。
1.4 应用CAPS标记检测油菜分离群体中BnALS3R的基因型
用MICMS双低恢复系N221与M342配制F播种F套袋自交后得到F群体,F单株分别与N221进行回交获得BC群体。当年秋季种植F、BC分离群体材料,待油菜生长至3到5叶期,喷施质量浓度为45g/hm(a.i)的苯磺隆鉴定分离群体中各单株除草剂抗性喷药前取适量F、BC分离群体单株和亲本的叶片保存于-20C,用于DNA提取。利用引物对SU54F/SU58R扩增出目的片段,并用BsrD I酶切分型。DNA提取,PCR反应、酶切分型方法同方法1.2。
2结果与分析
2.1 油菜抗磺酰脲类除草剂基因BnALS3R的CAPS标记
利用A1引物PCR克隆获得了敏感型油菜宁油20号、N221、N340和N341的BnALS3基因序列。序列比对发现,在+1662~+1667位点的6个核苷酸序列均为“GCAATG",与野生型油菜N131相同,表明该序列在敏感型油菜中具有高度保守性。16对引物分别对多个油菜品种进行PCR扩增,多次PCR,扩增结果表明,有些引物对无PCR产物,有些引物对PCR非特异扩增出多个条带,不利于进行酶切反应。其中引物对SU54F/SU58R能特异性扩增出目的条带,该条带经测序发现属于BnALS3基因片段,在敏感型和抗性油菜中存在G/T突变位点。
PCR产物经BsrDI酶切后显示,抗磺酰脲类除草剂油菜M342的5个单株均为只有1条766bp的条带,敏感型油菜N131、宁油20号、N221、N340和N341均为含有570bp.196bp2条条带,F均为含有766bp、570bp和196bp3条条带(圖1)。田间苗期油菜喷施苯磺隆后,未发现M342及杂交F,单株死亡,但5种敏感型油菜喷药20d后全部死亡。上述结果表明,从16对引物筛选出的引物对SU54F/SU58R可以作为抗磺酰脲类除草剂基因BnALS3R的CAPS标记引物,该CAPS标记可以准确检测出油菜种质资源中是否含有抗磺酰脲类除草剂基因BnALS3R。
2.2 CAPS标记在油菜抗磺酰脲类除草剂基因BnALS3R中的验证
利用CAPS标记对不同油菜的抗性基因
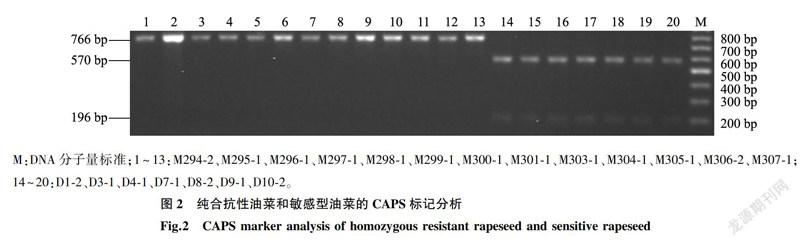
BnALS3R进行检测,结果表明M294-2、M295-1、M296-1、M297-1、M298-1、M299-1、M300-1、M301-1、M303-1、M304-1、M305-1、M306-2、M307-1是纯合抗性油菜,酶切产物只有1条分子量为766bp的条带;D1-2、D3-1、D4-1、D7-1、D8-2、D9-1、D10-2是敏感型油菜,酶切产物分别有570bp、196bp的2条条带(图2),该CAPS标记的检测结果与测序结果一致。
纯合抗性油菜M305、M306的CAPS标记检测结果表明只有1条766bp的条带,敏感型油菜D42、D162的酶切结果显示570bp和196bp2条条带(图3),均与其基因型结果一致。分别将M305、M306与D42、D162进行杂交,杂交后代F,基因型是杂合型,以F,幼苗的DNA为模板,扩增片段酶切后分别有766bp、570bp和196bp3条条带,与预期结果一致(图3)。
2.3 应用CAPS标记检测油菜分离群体BnALS3R的基因型
利用CAPS标记技术对F、BC群体进行检测,结果表明F群体CAPS标记呈现3种基因型条带(图4),即酶切产物为766bp1条条带,为抗磺酰脲类除草剂Als3Als3纯合抗性植株,如单株4~8;酶切产物为766bp、570bp和196bp3条条带,为Als3als3杂合抗性植株,如单株9~18;酶切产物为570bp和196bp2条条带,为als3als3纯合敏感植株,如单株19~23,CAPS标记分析结果与抗磺酰脲类除草剂基因BnALS3R基因型测序结果一致。BC群体CAPS标记分析呈现2种基因型条带(图5),即酶切产物为766bp、570bp和196bp3条条带,为杂合抗性Als3als3植株,如单株4~13;酶切产物为570bp和196bp2条条带,为敏感als3als3植株,如单株14~23。以上2个群体CAPS标记结果与苗期喷施苯磺隆表型鉴定结果一致,并且F和BC群体的CAPS标记结果遵循孟德尔单基因遗传分离规律,因此该CAPS标记可以有效地检测分离群体BnALS3R的基因型。
3 讨论
传统的育种方式主要是根据表型进行选择,而环境条件、基因间互作、基因型等多种因素会影响对植株的选择,育种周期较长。分子标记辅助育种技术可以提高育种的准确性和效率,在农业育种中发挥重要的作用。理想的分子标记能在广泛的遗传背景下有效追踪目标基因,重复性高。CAPS标记技术将PCR扩增和酶切反应相结合,具有操作简便、结果稳定可靠等优点,已广泛用于植物抗除草剂基因的检测。运用CAPS标记技术,Massa等检测了阿披拉草(Apera spica-renti)ALS基因Pro197突变体。Yu等对野麦草(Hordeum lepo-rinum Link.)ALS基因Pro197突变体基因检测,随后对硬直黑麦草(Lolium rigidum Gaud.)ALS基因Pro197、Trp574突变体进行基因分型。邓维运用CAPS标记快速检测播娘蒿(DescurainiasophiaL.)ALSI或ALS2的Pro197、Asp376和Trp574突变体。然而,由于在播娘蒿中ALSI、ALS2基因同源性达到了96.4%,设计的引物可同时扩增出ALSI、ALS2,但酶切无法明确区分Pro197突变体究竟是ALSI还是ALS2基因位点的突变。甘蓝型油菜是由白菜型油菜和甘蓝天然杂交形成的异源四倍体,包括A、C基因组,基因组内3个具有催化功能的ALS基因核酸序列高度同源,尤其是ALSI和ALS3,同源性达到98%,这为开发检测抗SU类除草剂油菜抗性基因BnALS3R的分子标记增加了难度。本研究通过克隆比对BnALSI和BnALS3序列差异设计出8条引物,从组合的16对引物中筛选出1对引物(SU54F/SU58R)能特异扩增出不同油菜品种中与BnALSI高度同源的BnALS3R基因片段,且酶切分型正确,为利用抗性基因进行油菜抗除草剂分子标记辅助选择育种奠定了基础。
目前,国内外至今还未有培育出商业化的抗SU类除草剂油菜品种的公开报道,主要原因是缺少抗性种质。因此,筛选鉴定具有生产应用价值的抗SU类除草剂油菜新种质成为迫切需要。Magha等发现突变体RCS-5对SU类和IMI类除草剂具有抗性,但未揭示抗性位点。Li等通过筛选EMS突变后代群体鉴定出几株抗苯磺隆突变体,其突变位点为BnALS3第197位Pro突变为Ser/Leu。曲高平等报道在3x10*株的EMS诱变M2群体中筛选到K1、K4、K5共3株苯磺隆抗性突变体,随后揭示了突变体K1、K4均为BnALS3第535位碱基C突变为碱基T导致BnALS3第197位Pro突变为Ser,K5为BnALSI第544位碱基C突变为碱基T导致BnALSI第197位Pro突变为Ser,并开发了SNP标记用于检测3株突变体基因。通过定向选育方法,我们筛选到抗SU类除草剂油菜M342,该突变体是BnALS3第1667位碱基G突变为碱基T导致第574位Trp突变为Leu,这为抗除草剂油菜种质创新和品种选育奠定了基础。本研究根据BnALS3基因Trp574突变位点的SNP,开发了油菜抗sU类除草剂性状的CAPS标记,该标记在分离群体中可以准确地鉴定纯合抗性油菜、纯合敏感油菜及杂合抗性油菜BnALS3R的基因型。同時,该标记是根据基因的核苷酸突变特性设计的功能性基因标记,能直接反映植株的抗性,不存在由于遗传交换而造成的错误鉴定,极大地提高了抗性基因的选择效率。利用该标记可以在油菜任何时期鉴定抗性基因纯合型单株以及优良性状的敏感单株,淘汰其他单株,这样不仅可以节约田间育种成本,而且可以大大提高抗除草剂油菜品种的选择进程。
參考文献:
[1]张敏恒.磺酰脲类除草剂的发展现状、市场与未来趋势[J].农药,2010,49(4):235-245.
[2] MCCOURT J A,DUGGLEBY R G. Acetohydroxyacid synthase
and its role in the biosynthetic pathway for branched-chain aminoacids[J]. Amino Acids,2006,31(2):173-210.
[ 3] MCCOURT J A,PANG S S,KING-SCOTT J,et al. Herbicide-
binding sites revealed in the structure of plant acetohydroxyacidsynthase[J]. Proceedings of the National Academy of Sciences ofthe United States of America,2006,103(3):569-573.
[4] SADA Y,UCHINO A. Biology and mechanisms of sulfonylurea re-sistance in Schoenopletiella juncoides,a noxious sedge in the rice
paddy fields of Japan[ J]. Weed Biology and Management,2017,17(3):125-135.
[5] DENG W,YANG Q,ZHANG Y Z,et al. Cross-resistance pat-
terns to acetolactate synthase (ALS )-inhibiting herbicides offlixweed (Descurainia sophia L. )conferred by different combina-tions of ALS isozymes with a Pro- l97-Thr mutation or a novel Trp-574-Leu mutation [ J]. Pesticide Biochemistry & Physiology ,2017,136:41-45.
[6] LEE H,RUSTGIS,KUMAR N,et al. Single nucleotide mutation in the barley acetohydroxy acid synthase (AHAS)gene confers re-sistance to imidazolinone herbicides[J]. Proceedings of the Na-tional Academy of Sciences of the United States of America,2011,108(21):8909-8913.
[7] HU M L,PU H M,KONG L N,et al. Molecular characterization
and detection of a spontaneous mutation conferring imidazolinoneresistance in rapeseed and its application in hybrid rapeseed pro-duction[ J]. Molecular Breeding,2015,35(1):46.
[8] LI J,LI M,GAO X X,et al. A novel amino acid substitution
Trp574Arg in acetolactate synthase (ALS)confers broad resistanceto ALS-inhibiting herbicides in crabgrass (Digitaria sanguinalis )[J]. Pest Management Science,2017,73(12):2538-2543.[9] TRANELP J,WRIGHTT R,HEAP I M. Mutations in herbicide-
resistant weeds to ALS inhibitors[ DB/OL]. [ 2018-09-15]. ht-tp:// www.weedscience.com/ Mutations/ MutationDisplayAll.aspx.
[ 10] SWANSON E B,COUMANS M P,BROWNG L,et al. The char~-
acterization of herbicide tolerant plants in Brassica napus L. after invitro selection of microspores and protoplasts[J]. Plant Cell Re-ports,1988,7(2):83-87.
[ 11] SWANSON E B,HERRGESELL M J,Amoldo M,et al. Micro-
spore mutagenesis and selection:Canola plants with field toleranceto the imidazolinones [ J ]. Theoretical and Applied Genetics,1989,78(4):525-530.
[12] MAGHA M I,GUERCHE P,BREGEON M,et al. Characteriza-
tion of a spontaneous rapeseed mutant tolerant to sulfonylurea andimidazolinone herbcides[ J]. Plant Breeding,2010,111 (2):132-141.
[13]高建芹,浦惠明,戚存扣,等.抗咪唑啉酮油菜种质的发现与鉴定[J].植物遗传资源学报,2010,11(3):369-373.
[14]胡茂龙,浦惠明,高建芹,等.油菜乙酰乳酸合成酶抑制剂类除
草剂抗性突变体M9的遗传和基因克隆[J].中国农业科学,2012,45(20):4326-4334.
[15] 浦惠明,胡茂龙,高建芹,等.一种基于ALS靶酶的抗除草剂油
菜定向选育方法:CN 103070068A [P]. 2013-05-01.
[16] 胡茂龙,浦惠明,龙卫华,等.一种甘蓝型油菜抗磺酰脲类除草剂基因及其应用:CN103266118A [P]. 2013-08-28.
[17] WEILAND J J,YU M H. A cleaved amplified polymorphic se-quence (CAPS )marker associated with root-knot nematode resist-ance in sugarbeet[ J]. Crop Science,2003,43(5):1814-1818.
[ 18] LIU WT,YUANGH,DUL,et al. A novel Pro197Glu substitu-tion in acetolactate synthase (ALS)confers broad-spectrum resist-ance across ALS inhibitors[ J]. Pesticide Biochemistry & Physiolo-gy,2015,117:31-38.
[19] MASSA D,KRENZ B,GERHARDS R. Target-site resistance to ALS- inhibiting herbicides in Apera spica-venti populations is con-ferred by documented and previously unknown mutations [ J ] .Weed Research,2011,51(3):294-303.
[20]任海,吕小红,杜萌.多抗水稻分子标记辅助育种方法[J].江苏农业科学,2017 ,45(19):154-158.
[21]周丽霞,吴翼,肖勇. 基于SSR分子标记的油棕遗传多样性分析[J].南方农业学报,2017,48(2):216-221.
[22]孙大元,周丹华,张景欣,等.广谱抗源H4中2个主效抗病基因的单基因系构建及评价[J].江苏农业学报,2017,33(1):1-5.
[23]邓琳,余小刚,姜朵,等.棉花分子育种研究进展[J].山东农业科学,2017,49(5):144-150.
[24]王亚琦,孙子淇,郑峥,等.作物分子标记辅助选择育种的现状与展望[J].江苏农业科学,2018 ,46(5):6-12.
[25] YU Q,NELSON J K,ZHENG M Q,et al. Molecular characterisation of resistance to AI S-inhibiting herbicides in Hordeum lepori-num biotypes[ J]. Pest Management Science,2007,63(9):918-927.
[26] YU Q,HAN H P,POWLES S B. Mutations of the ALS gene endowing resistance to ALS-inhibiting herbicides in Lolium rigidumpopulations[ J]. Pest Management Science,2008,64(12):1229- 1236.
[27]鄧维.抗苯磺隆播娘蒿抗性机理及抗性突变对乙酰乳酸合成酶功能影响[ D].北京:中国农业大学,2017.
[28] LIHT,LIJJ,ZHAO B,et al. Generation and characterization of tribenuron-methyl herbicide-resistant rapeseed (Brasscia napus )for hybrid seed production using chemically induced male sterility[ J]. Tag. theoretical & Applied Genetics. theoretische Und Ange-wandte Genetik,2015,128(1):107-118.
[29]曲高平,孙妍妍,庞红喜,等.甘蓝型油菜EMS突变体库构建
及抗除草剂突变体筛选[J].中国油料作物学报,2014,36(1):25-31.
[30]孙妍妍,曲高平,黄谦心,等.甘蓝型油菜抗苯磺隆突变体ALS基因分析与SNP标记[J].中国油料作物学报,2015,37(5):589- 595.
