隆突性皮肤纤维肉瘤的影像学特征
2019-09-07史志涛陈月芹赵凡徐景景王唯伟
史志涛,陈月芹,赵凡,徐景景,王唯伟
济宁医学院附属医院影像科,山东济宁 272029;*通讯作者 王唯伟 1027070940@qq.com
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是一种来源于真皮及皮下间叶组织的中间性纤维组织细胞性肿瘤,约占所有软组织肿瘤的1%[1];临床常表现为隆起于皮肤表面的无痛性结节或肿块,表面多呈紫红色,常被误诊为良性病变而仅行单纯肿物切除术,导致局部复发,甚至转化为多形性未分化肿瘤而危及生命。因此,准确、全面地认识DFSP的影像学表现可以减少误诊和术后复发,对DFSP患者具有重要意义。本研究回顾性分析30例DFSP患者的影像学特征,以提高其诊断准确性。
1 资料与方法
1.1 研究对象 收集2008年1月-2018年3月济宁医学院附属医院经病理证实的DFSP患者30例,其中男9例,女21例;年龄8~72岁,平均(47.2±16.6)岁。所有患者临床表现为缓慢生长的无痛、质硬的结节或肿块,病程4个月~40年,16例肿块表面呈红色或紫红色,6例肿块近期出现局部疼痛,8例出现轻压痛,10例病灶近期稍增大或明显增大;23例原发,7例复发。
30例患者中,13例行超声检查;9例行CT检查,其中1例行CT增强扫描;13例行MRI检查,其中5例行增强扫描,1例行动态增强扫描;2例同时行超声、CT检查,3例同时行超声、MRI检查。
1.2 仪器与方法
1.2.1 超声检查采用GE E8或三星UGEO WS80A超声诊断仪,线阵探头频率7~12 MHz。
1.2.2 CT检查 采用Siemens SOMATOM Definition双源CT先行常规轴位平扫,管电流250 mAs,管电压120 kV,层厚5 mm;CT增强扫描对比剂采用碘海醇(300 mg/ml),剂量85 ml,注射流速3 ml/s。
1.2.3 MRI检查 采用Siemens MAGNETOM Verio 3.0T超导型MR扫描仪,体部正交线圈或四肢关节专用线圈,平扫:FSE序列;T1WI:TR 500~700 ms,TE 12~18 ms;T2WI:TR 1800~4000 ms,TE 70~90 ms;脂肪抑制T2WI序列:TR 2000~4500 ms,TE 70~100 ms,激励次数2;层厚5 mm,层间距1 mm,视野160~400 mm,矩阵256×256。增强扫描对比剂采用钆喷酸葡胺,剂量0.1 mmol/kg,以2~3 ml/s经肘静脉推注。
1.3 病理检查 所有患者均行手术切除病灶,常规石蜡切片、HE染色及免疫组化检查。
1.4 图像分析 所有图像由2名影像科副主任医师采用双盲法进行分析,意见不一致时协商统一。观察肿瘤的部位、形态、大小、瘤内回声/密度/信号及瘤周浸润情况,采用Adler分级进行超声血流信号分级,①0级:未见明显血流信号;②1级:星点状血流或抑制血管;③2级:较丰富的血流,短棒状或条状血流2~3支;④3级:血流丰富,可见4支或以上血管向病灶内延伸或交织成网。
2 结果
2.1 病灶部位、形态、大小 30例患者中,病灶位于腹盆壁13例,胸壁6例,乳房3例,头颈部3例,大腿4例,肩部1例;11例病灶呈类圆形,3例梭形,16例不规则形,其中13例呈多个结节融合而成的“多结节融合征”改变,11例呈较大肿块外缘见小结节凸向皮肤的“子结节外突征”(图1A);肿瘤长径为1.2~10.1 cm,平均(4.5±2.6)cm。
2.2 超声表现 13例行超声检查,其中11例瘤内呈不均匀低回声(图2A),2例回声尚均匀;9例边界清晰,4例边界不清;11例行彩色多普勒血流显像检查(图2B),血流信号Adler分级:1级1例,2级4例,3级6例。
2.3 CT表现 9例行CT检查,CT平扫均呈稍低信号,7例密度均匀,2例不均匀,CT值约16~37 Hu;9例均沿周围皮肤浸润生长并呈“皮肤尾征”(图1B),9例肿瘤向脂肪浸润生长,呈“脂肪尾征”,3例沿浅筋膜浸润生长,呈“筋膜尾征”;1例增强扫描呈不均匀较明显强化。
2.4 MRI表现 13例行MRI检查,其中11例T1WI呈低信号,1例呈等信号,1例(长径>5 cm)呈混杂低信号(其内见小片状高信号区);8例肿瘤T2WI呈混杂高信号,其内可见条片状低信号区,呈“双低信号征”(T1WI及T2WI均呈低信号)(图4A、B),2例较大的肿瘤(长径>5 cm)出现坏死、囊变;5例呈T2WI均匀高信号;增强扫描4例呈不均匀明显强化,1例动态增强扫描呈明显均匀强化,时间-信号强度曲线呈速升-缓降型,肿块周边见纡曲血管影(图3B~D);12例见“脂肪尾征”(图2C),9例见“皮肤尾征”(图3A),9例见“筋膜尾征”(图4C)。
2.5 病理结果 30例病理均诊断为DFSP,镜下见梭形肿瘤细胞围绕裂隙样血管呈车辐状或席纹状排列(图2E),免疫组化检查示30例CD34均呈阳性(图2F)。
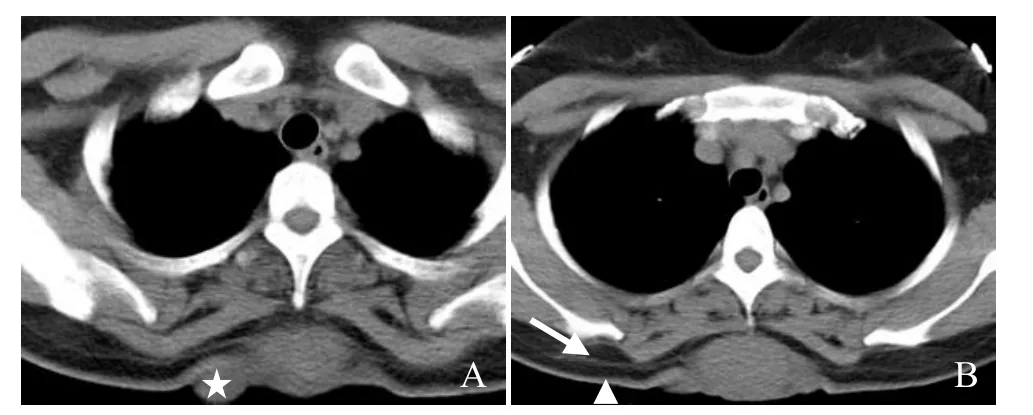
图1 女,37岁,胸背部DFSP。CT平扫示肿块呈均匀等密度,CT值约37 Hu,肿块外缘可见凸向皮肤的“子结节”(星号,A);病变沿周围皮肤浸润生长并呈“皮肤尾征”(箭头),向脂肪内浸润生长而呈“脂肪尾征”(箭,B)

图2 女,58岁,腰背部DFSP。二维超声示类圆形肿块,内部回声强弱相间,后方回声稍增强(A);彩色多普勒血流显像示肿块内血流丰富,Adler分级为3级(B);T1WI呈等信号,肿瘤向邻近脂肪内浸润呈“脂肪尾征”(箭,C);T2WI呈混杂高信号,其内见斑片状低信号区(箭,D);病理镜下肿瘤细胞(箭头)呈编织状或车辐状环绕血管裂隙(箭)排列(HE,×200,E);免疫组化示CD34呈阳性(F)
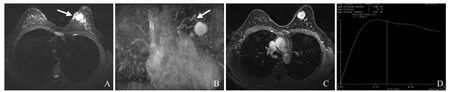
图3 女,32岁,左乳内DFSP。T2WI呈明显高信号,肿瘤沿皮肤浸润并呈“皮肤尾征”(箭,A);最大密度投影示瘤周可见纡曲的供血血管(箭,B);DCE-MRI示病灶呈明显持续强化(C);DCE-MRI生成的病灶时间-信号强度曲线呈速升-缓降型(D)
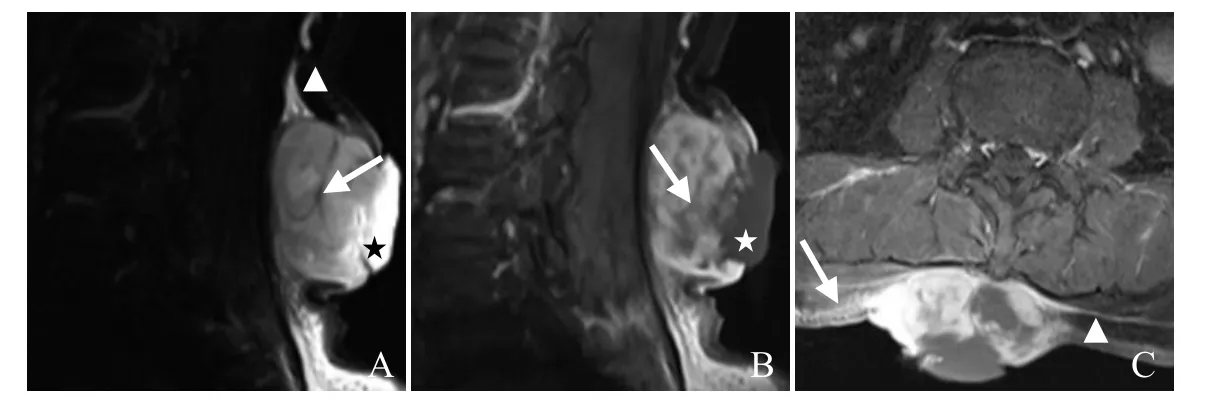
图4 女,63岁,腰背部DFSP。T2WI呈混杂高信号,可见“结节外突征”,后缘见囊状高信号影(星号),瘤内见条状低信号影(箭),可见“脂肪尾征”(箭头,A);增强扫描呈不均匀强化,其内见条状强化低信号影(箭),囊变区未强化(星号,B);横断位增强图像示肿瘤沿皮肤及浅筋膜浸润,呈“皮肤尾征”(箭)“筋膜尾征”(箭头,C)
3 讨论
3.1 DFSP的临床及病理表现 DFSP的好发年龄为20~50岁,男性发病率稍高于女性[2],本组患者平均年龄为(47.2±16.6)岁,但女性多于男性。DFSP病灶好发于躯干及四肢,其次为头颈部,发生于乳房者较罕见[3],本组24例发生于躯干或四肢,3例发生于头颈部,3例发生于乳房。2013年WHO软组织肿瘤分类将DFSP归于纤维母细胞/肌纤维母细胞肿瘤,中间性(偶见转移性)[4];病理镜下可见大量梭形肿瘤细胞呈席文状或车辐状环绕血管裂隙排列,核分裂象少见,90%的DFSP患者免疫组化CD34呈阳性[5]。本组经病理证实的30例患者CD34均呈阳性。DFSP治疗以手术为主,但术前常因定性为良性肿瘤行局部切除而导致复发,局部复发率高达20%~60%[6];本组30例患者中,7例为复发;因此重视术前诊断,并在此基础上采取广泛切除术(切缘>3 cm),可将复发率降低至0%~30%[7]。
3.2 DFSP的影像学表现 超声可以方便、无创地获取肿瘤声像图,但难以判定形态不规则或浸润范围较深的肿瘤边界;CT可以通过多平面重组和容积成像对肿瘤进行精确定位,但对瘤内成分的分辨率欠佳;MRI能较好地显示瘤内成分及瘤周浸润情况,但对于瘤内血流显示不如超声直观,对于偶发钙化的显示亦不如CT明确。DFSP在超声、CT及MRI图像上均有一定的特征性,在术前诊断上可以相互补充,但既往对上述影像特征的综合分析报道较少,本研究结合文献总结其影像学特征为,①部位、形态特征:本组30例肿瘤均位于表浅的皮肤及皮下组织,不同程度地隆起于皮肤表面,与张九龙等[8]的研究相仿,这种生长方式间接反映其病理起源,具有一定的特征性。本组13例肿瘤呈“多结节融合征”,11例呈“子结节外突征”,为DFSP较为特征性的形态改变,较何涌等[9]报道的发生率低,可能与超声对上述形态特征检出率低有关。②瘤周浸润特征:CT平扫、FS-T2WI及增强图像上均可较清晰地显示DFSP瘤周浸润情况,21例肿瘤向脂肪浸润生长,呈“脂肪尾征”,最多见;其次,18例沿周围皮肤浸润生长并呈“皮肤尾征”;12例沿浅筋膜浸润生长,呈“筋膜尾征”,最少见。上述3种征象均为DFSP较为特异性的改变。与郑晓涛等[10]的研究结果不同,本组患者“脂肪尾征”发生率最高,而非“皮肤尾征”,其原因可能是两者均为小样本研究,存在一定的抽样误差;但“脂肪尾征”对术前诊断仍极为重要性,该征象表明肿瘤不仅向周围皮肤浸润,更有深部脂肪浸润的可能,手术范围应包含该区域。③回声/密度/信号特征:本研究中,11例呈不均匀低回声,内部可见不规则条带状强回声与弱回声相间隔,病理基础为呈弱回声的肿瘤细胞及呈强回声的纤维基质比例不同、相间排列,与赵海娜等[11]的研究相仿。本研究发现,本组8例瘤内可见条片状T1WI及T2WI低信号区,呈“双低信号征”,病理基础为肿瘤内聚集成团的纤维基质成分,是判断DFSP为纤维组织来源肿瘤的重要依据,既往研究鲜有对此特征进行阐述。本组患者9例行CT平扫,其中7例呈均匀等密度,对于肿瘤实质及纤维基质的显示无明显特异性。本组2例瘤内见囊变、坏死,1例瘤内见出血灶,发生率较低,且均位于体积较大的肿瘤内(长径>5 cm),与张朝晖等[12]的研究结果相仿。④彩色多普勒超声特点:本组11例行彩色多普勒检查,多表现为较丰富的血流,其中6例Adler 3级,4例Adler 2级,1例Adler 1级。⑤增强特点:CT增强扫描1例,MRI增强扫描4例,均呈不均匀明显强化,1例MRI动态增强扫描呈明显均匀持续强化,时间-信号强度曲线呈速升-缓降型,其病理基础可能与肿瘤内存在编织状排列的梭形细胞、胶原纤维及细小毛细血管网有关,对比剂进入瘤灶内后流速缓慢,而形成“快进-慢出”的强化特点,MIP图像示肿块周边可见纡曲血管影,再次印证肿瘤血供丰富。
3.3 鉴别诊断 DFSP需与发生于皮下表浅部位的其他软组织肿瘤相鉴别。①皮肤纤维瘤:病变位于真皮内,好发于四肢、肩背部,依据其乏血供及CD34阴性的特点可与DFSP相鉴别;②韧带样纤维瘤病:好发于皮下或肌间隙,以沿肌肉长轴方向生长为主,可见“树根征”及“瘢痕征”;③恶性黑色素瘤:MRI特征性表现为T1WI呈高信号,T2WI呈低信号,脂肪抑制序列信号不减低;④乳腺癌:本组3例DFSP发生于乳腺,应注意与乳腺癌相鉴别;乳腺癌多发生于腺体内,部分累及皮肤或真皮,且动态增强图像多呈速升速降型。
总之,出现以下影像特征应考虑DFSP的可能:肿瘤部位表浅,隆起于皮肤表面,形态呈“多结节融合及子结节外突征”,以“脂肪尾征”“皮肤尾征”“筋膜尾征”向周围浸润,瘤内回声不均,出现“双低信号征”,超声血流丰富,CT、MRI强化明显且不均匀,动态增强扫描呈快进慢出型。由于本研究为回顾性分析,仅1例行MRI动态增强扫描,缺乏灌注成像、动态增强及扩散加权成像等功能成像对鉴别诊断价值的探讨,今后将积累更多资料进一步研究。
