对乳头状甲状腺癌临床分子靶标的筛选
2019-09-06杨迟晖孟磊俊宫丽平曾乃燕
杨迟晖, 张 晶, 孟磊俊, 宫丽平, 常 庆, 张 泓, 曾乃燕
(1.上海交通大学医学院病理生理学系,上海 200025;2.上海交通大学医学院附属瑞金医院北院检验科,上海 201801;3.上海交通大学附属儿童医院检验科,上海 200040;4.首都医科大学基础医学院,北京 100054;5.上海健康医学院附属嘉定区中心医院中心实验室,上海 201800)
甲状腺癌是内分泌系统中最常见的恶性肿瘤,我国女性近年来发病率更明显增加,以平均每年20.1%的速度上升,在最常见癌症中位于第5位[1]。甲状腺癌病理分类主要为分化型甲状腺癌、甲状腺髓样癌、低分化型甲状腺癌和未分化甲状腺癌。其中,分化型甲状腺癌包括乳头状甲状腺癌(papillary thyroid cancer,PTC),其约占甲状腺癌的84%;以及滤泡状甲状腺癌,约占甲状腺癌的11%[2-3]。不同类型的甲状腺癌,其生物学特性、临床表现、诊断、治疗及预后均有所不同。甲状腺癌的传统治疗方法包括甲状腺切除、放射性碘治疗和术后长期促甲状腺激素抑制治疗[4]。通常滤泡上皮来源的甲状腺癌(如PTC)有比较好的疗效和生存率,但其中有小部分甲状腺癌恶性程度很高,表现为局部侵袭、容易复发和远端转移。一旦发生肿瘤远端转移,患者的10年生存率可从85%~92%下降为10%~40%[5-6]。
近年来,分子水平的研究发现,甲状腺癌特征性基因改变包括原癌基因突变 (如BRAF和RAS基因等)和染色体重排基因突变 (如RET/PTC1、RET/PTC3和PAX8/PPARG等),因此甲状腺癌分子发病机制可能涉及多种信号通路 (如MAPK和PI3K/AKT等),其中以BRAF突变最为常见[7-8]。有研究发现,BRAF V600E突变存在于大多数典型的PTC和几乎所有的鞋钉型PTC中,但不存在于未分化甲状腺癌和低分化型甲状腺癌中[9]。BRAF V600E突变可能与甲状腺癌的原发肿瘤腺外侵袭、淋巴结及远端转移、血管浸润、高分期等侵袭性肿瘤特征相关,但与肿瘤复发间的相关性仍有争议[10-15]。
鉴于目前对于甲状腺癌的分子机制尚不明确,临床上缺乏诊断治疗的分子靶点。因此,本研究拟通过靶向二代测序 (next generation sequencing,NGS),对比分析52个实体瘤相关基因在石蜡标本PTC 组织与癌旁组织(normal adjacent tissue,NAT)中的基因突变,从而鉴定这些病例的肿瘤特异性基因改变。此外,由于NF-κB信号通路及其目的基因是细胞内多条信号传递途径的调控基因,具有控制细胞周期、凋亡、生长、组织侵袭性和炎症发生的作用,并在很多癌症的发生、发展中起着重要作用[16-17],但在甲状腺癌中的作用和临床意义研究甚少。本研究通过对NF-κB目的基因在PTC组织与NAT中的表达进行对比分析,探讨NF-κB信号通路相关基因与PTC发生、发展间的相关性。最后将以上分子水平检测结果与临床数据结合,进一步分析可用于甲状腺癌临床诊断治疗的肿瘤特异性分子靶点。
资料与方法
一、研究对象
收集20例2013年在上海交通大学医学院附属瑞金医院北院接受全甲状腺切除术的PTC患者的手术样本和临床数据。患者的年龄在27~68岁之间,平均年龄为(46±13)岁,包括7例男性和13例女性(见表 1)。

表1 患者的基本信息
二、方法
1.标本收集:收集术后石蜡包埋(formalin-fixed paraffin-embedded,FFPE)的甲状腺组织,每个蜡块切取 4~6片 10 μm厚的切片。经苏木精-伊红(hematoxylin-eosin,HE)染色的切片由病理医师进行组织学鉴定,并标记肿瘤区域。FFPE切片经常规二甲苯脱蜡和梯度酒精水化后,根据HE片的标记区域,按文献[18]的方法分离PTC组织与NAT,分别置于1.5 mL离心管中。
2.核酸提取:取上述离心管中组织各一半(相当于2~3片FFPE组织量),分别用于DNA和RNA提取。使用RecoverAllTMTotal Nucleic Acid Isolation Kit(Thermo Fisher Scientific,美国)试剂盒提取FFPE组织中的RNA;用蛋白酶K消化组织后,使用TIANamp FFPE DNA(天根生物,北京)试剂盒进行DNA提取。用Qubit 3.0荧光分光光度计(Thermo Fisher Scientific,美国)测定核酸质量和纯度后,于-80℃下冻存待用。
3.cDNA合成和定量反转录PCR(quantitative reverse transcription PCR,qRT-PCR): 用 DNA-free Kit DNase Treatment and Removal Reagents(Thermo Fisher Scientific,美国)处理 RNA中残留的DNA,用 SuperScript®Ⅲ First-Strand Synthesis SuperMix(Thermo Fisher Scientific,美国)在 20 μL 反应体系中 (详细参见试剂说明书)进行cDNA合成。以PPIA作为内参基因,对10个NF-κB信号通路相关基因进行相对定量分析。引物设计详见表2,序列由上海生工生物公司合成。PCR反应体积为10 μL,包括 2× SsoFast Evagreen Supermix (BioRad,美国)5 μL,cDNA 模板 1 μL,上下游引物(20 μmol/L)各0.2 μL,无核酸酶水 3.6 μL。 以无 DNA 模板的反应体系(只加无核酸酶水)作为阴性对照。所有样品进行双孔复孔检测,取循环阈值(Cycle threshold,Ct)的平均值,用靶基因与内参基因的比值(ΔCt)来计算每个靶基因的相对表达量。PCR反应条件为,95℃30 s,95 ℃ 5 s,57 ℃ 20 s,共 40~50 个循环;熔解曲线为 95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。
4.免疫组织化学 (免疫组化):FFPE组织切取3 μm厚的白片,按照参考文献[19]的方法进行脱蜡、抗原修复、抗体孵育和显色。CD44抗体(15675-1-AP,1∶200)、Cyclin D2 抗体 (10934-1-AP,1∶200)和 Bcl-2 抗体 (12789-1-AP,1∶100) 购自日本 Proteintech公司。由病理医师在显微镜下根据细胞染色强度评估蛋白的表达水平,结果用无表达(-)、弱阳性(+)、阳性(++)和强阳性(+++)表示。 用宁波江丰公司KF-pro-005扫描仪在40倍镜下进行全片扫描,获得数字图像并保存。
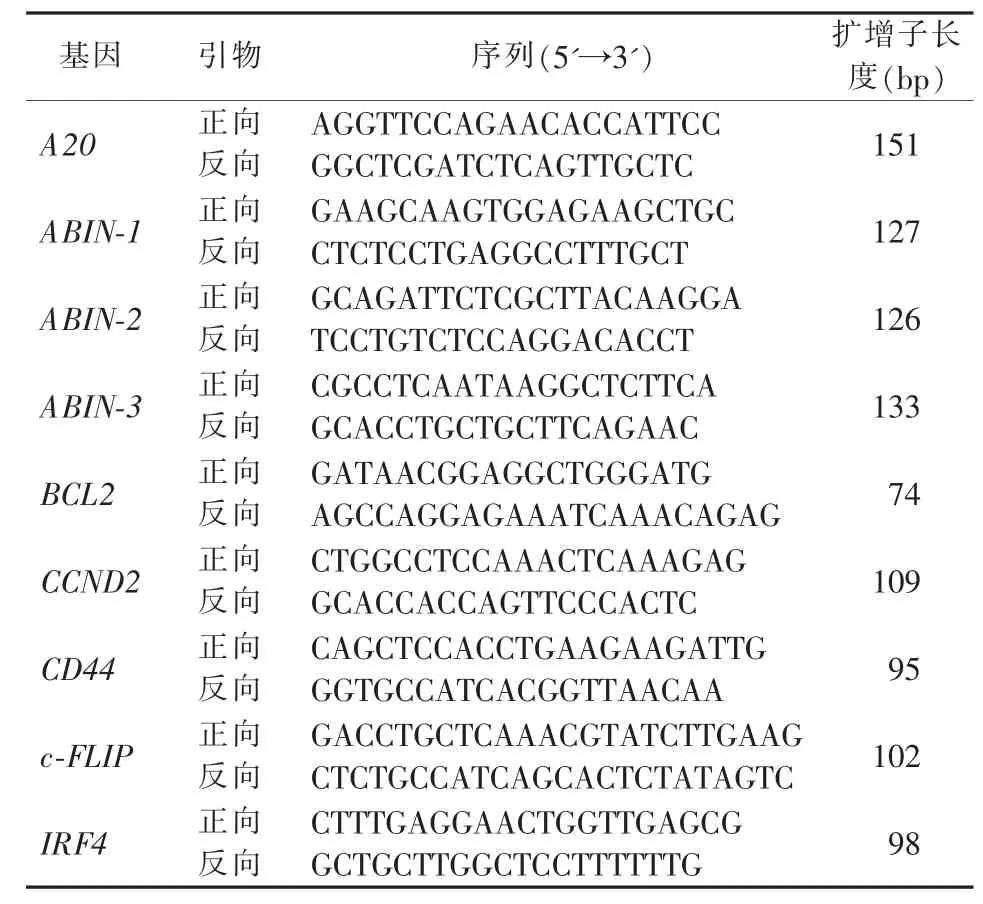
表2 实时荧光定量PCR的引物序列
5.靶向NGS和数据分析:采用美国Thermo Fisher Scientific公司Oncomine Focus Assay试剂盒,对随访发现有复发或转移及DNA提取质量高的1号、5号、8号、10号和16号病例成对的PTC和NAT的DNA进行测序分析,并对PTC组织混合样品(即不包含2号和6号的混合样本)和NAT混合样品 (即不包含2号、6号、11号、15号和18号的混合样本),以及有转移的周围淋巴结混合样本(即为2号、6号、11号和13号的混合样本)和无转移的淋巴结混合样本(即为2号、6号和11号的混合样本)进行比较分析。主要步骤包括文库构建、模板制备及上机测序。以20 ng DNA为起始模板进行扩增建库。用AMPure XP Reagent(Beckman Coulter,美国)纯化后,用 Ion Library TaqMan Quantitation Kit试剂盒(Thermo Fisher Scientific,美国)对产物进行定量检测,将产物稀释至50 pmol/L,置于Ion Chef(Thermo Fisher Scientific,美国)上进行模板制备后,将制备好的Ion 520芯片置于Ion S5测序仪(Thermo Fisher Scientific,美国)中进行测序,在 Ion Reporter(https://ionreporter.thermofisher.com)上以人类基因19为参考基因并按“Oncomine Focus-520-w2.3-DNA-Single Sample” 工作程序进行数据分析。采用等位基因突变频率≥1%的筛选模式,筛选的基因异常包括小片段插入或删除、错义突变、未翻译区变异(untranslated regions variants,UTR)和剪接位点变异。
6.实时荧光定量 PCR (real-time quantitative PCR,qPCR)检测BRAF V600E突变:用武汉友芝友医疗科技公司 “人类基因V600E突变检测试剂盒(PCR-荧光探针法)”对17例病例FFPE组织提取的DNA中的V600E突变进行检测。每个样本在2个反应管中分别进行BRAF V600E反应和质控反应的检测(按试剂盒说明书操作)。结果判定标准为,当 V600E PCR 反应的 Ct值<38,且 ΔCt(V600E PCR Ct值与质控PCR Ct值的差值)<9时,认为该样本有V600E突变;当V600E PCR Ct值≥38或无Ct值时,认为该样本无V600E突变。
7.统计学处理:采用SPSS 22软件进行统计分析,通过t检验对NF-κB目的基因在癌组织和NAT中的表达进行比较,P<0.05时认为差异有统计学意义。

图1 NF-κB信号通路相关基因在PTC及NAT中的mRNA水平表达分析
结 果
一、NF-κB信号通路相关基因在乳头状甲状腺癌中的异常表达
20例PTC患者中14例发生了肿瘤淋巴结浸润。在5年的随访过程中,有5例患者经超声检查发现异常肿大淋巴结,定义为复发,其中2例经再次接受手术,并经病理证实为PTC颈淋巴结转移(见表 1)。
通过qRT-PCR成对分析了20例患者PTC和NAT中的NF-κB信号通路相关基因表达水平,包括 NF-κB 目的基因 IRF4、BCL2、CD44、c-FLIP、CCND2、IκBα、A20 及 ABIN 家族基因(ABIN-1、ABIN-2、ABIN-3),其中A20及ABIN家族同时也是NF-κB信号通路的重要负调控基因。结果显示,PTC中的 CD44、CCND2 表达量显著高于 NAT (P<0.05);而PTC中的BCL2表达量有低于NAT的趋势,但差异尚无统计学意义。其他基因的表达水平在PTC与NAT间差异无统计学意义(见图1)。此外,分析结果表明,在有淋巴结转移和无淋巴结转移的PTC间,各NF-κB目的基因的表达量差异均无统计学意义(见图 2)。
对于在mRNA水平上有明显变化的基因,进一步在蛋白水平上进行免疫组化分析。由于甲状腺肿瘤体积小,其中9例在完成RNA表达检测后无剩余组织可供免疫组化分析。对其他11例样本(7例男性和4例女性)的免疫组化分析结果显示,PTC中的CD44及Cyclin D2表达量明显高于NAT,在PTC中其表达为强阳(+++),而在NAT中表达为弱阳(+)。其中2例病例的PTC中,BCL2无表达或呈弱阳性(-/+),而在其NAT中表达为阳性或强阳性(++/+++);1例的 PTC中 BCL2表达量明显高于NAT;而在另8例中,PTC与NAT间的BCL2表达差异无统计学意义(见表3、图3)。因此,免疫组化分析结果显示,在PTC组织中CD44和Cyclin D2的表达显著升高,与其mRNA水平结果一致;在部分病例PTC组织中BCL2的表达低于NAT,但在蛋白和mRNA水平上其差异表达均无统计学意义。

图2 有和无淋巴结转移患者的PTC组织中NF-κB信号通路相关基因mRNA水平表达分析

表3 免疫组化分析检测CD44、Cyclin D2和BCL2蛋白在PTC和NAT中的表达
二、对比鉴定乳头状甲状腺癌的肿瘤特异性基因变异
对1号、5号、8号、10号和16号病例,以及混合的PTC样本和混合的淋巴结样本的PTC组织和NAT进行52个实体瘤靶向基因的NGS分析。结果显示,ALK、BRAF、FGFR4和 KIT在所有 5个病例中都有突变,MYC和FGFR3在4个病例中有突变,CTNNB1、DDR2、EGFR、ERBB3 和 HRAS 在 3 个病例中有突变。GNA11在1号和8号中存在突变;7个基因在单一的病例中检测到突变。在混合的PTC样本(PTC和NAT)中检测到的突变基因包括ALK、BRAF、FGFR4、KIT、MYC 和 MET。 在混合的淋巴结样本中同样存在 ALK、BRAF、FGFR4、KIT和MYC基因突变,另外还检测到DDR2基因突变,但未检测到MET基因突变(见图4)。

图3 CD44、Cyclin D2及BCL2蛋白在PTC与NAT中的表达
对每个基因的具体突变位点进行分析,发现ALK基因突变主要为 D1529E (rs1881421)和I1461V (rs1670283),都同时存在于PTC和NAT中,因此属于胚系突变;而8号病例PTC组织中检测到2个位于剪接位点的ALK点突变,分别是splisite_3’c.3450+1G>A 和 splisite_5’c.3360-1G>A,但在该病例的NAT中没有检测到,因此为肿瘤特异性突变,即体细胞突变。在各病例中检测到的FGFR4 基因突变都基本为 P136L (c.407C>T,rs376618),该突变属于胚系突变。KIT基因在5号、10号、16号、混合的PTC样品和混合的淋巴结样品中均检测到属于胚系突变的插入突变 (c.67+4951T>TA,rs11407544);而在8号病例的PTC组织中发现有一个剪接位点突变(splicesite_5’c.1648-1G>A,rs121913234),在 NAT 中未发现,为体细胞突变;此外,5号和8号病例中还存在其他点突变,如 G424S、A502T、Q514K、V559A、T574I、D579N、V643I和A814T等,均为体细胞突变。MYC基因在4个病例和混合的淋巴结的PTC和NAT中都检测到 了 3’UTR 区 域 的 点 突 变 (c.1415A >G,rs2070583),为胚系突变;然而只在混合的PTC样品中有点突变(c.1415A>G,rs2070583),为体细胞突变;5号病例的T73I突变为体细胞突变。FGFR3在1号病例中的G90V和8号病例中的N718S突变为胚系突变;而在5号和16号癌组织中的不同点突变(如R640Q和S104F)都属于体细胞突变。
NGS结果显示,BRAF V600E突变存在于所有病例中,但在5号、8号和10号病例中,仅在其PTC组织中出现(见图4)。当用qPCR方法检测V600E突变时,结果显示17个病例中有14例存在V600E突变,其中9例为体细胞突变(64%),4例为胚系突变(29%)(见表 4)。这些结果说明,BRAF V600E 突变在PTC病例中出现的频率很高(82%),但并非都是体细胞突变,也可为胚系突变(见表4)。
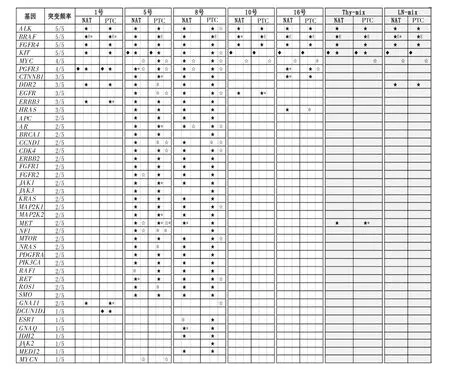
图4 靶向NGS对比分析PTC和NAT中实体瘤相关基因的突变情况
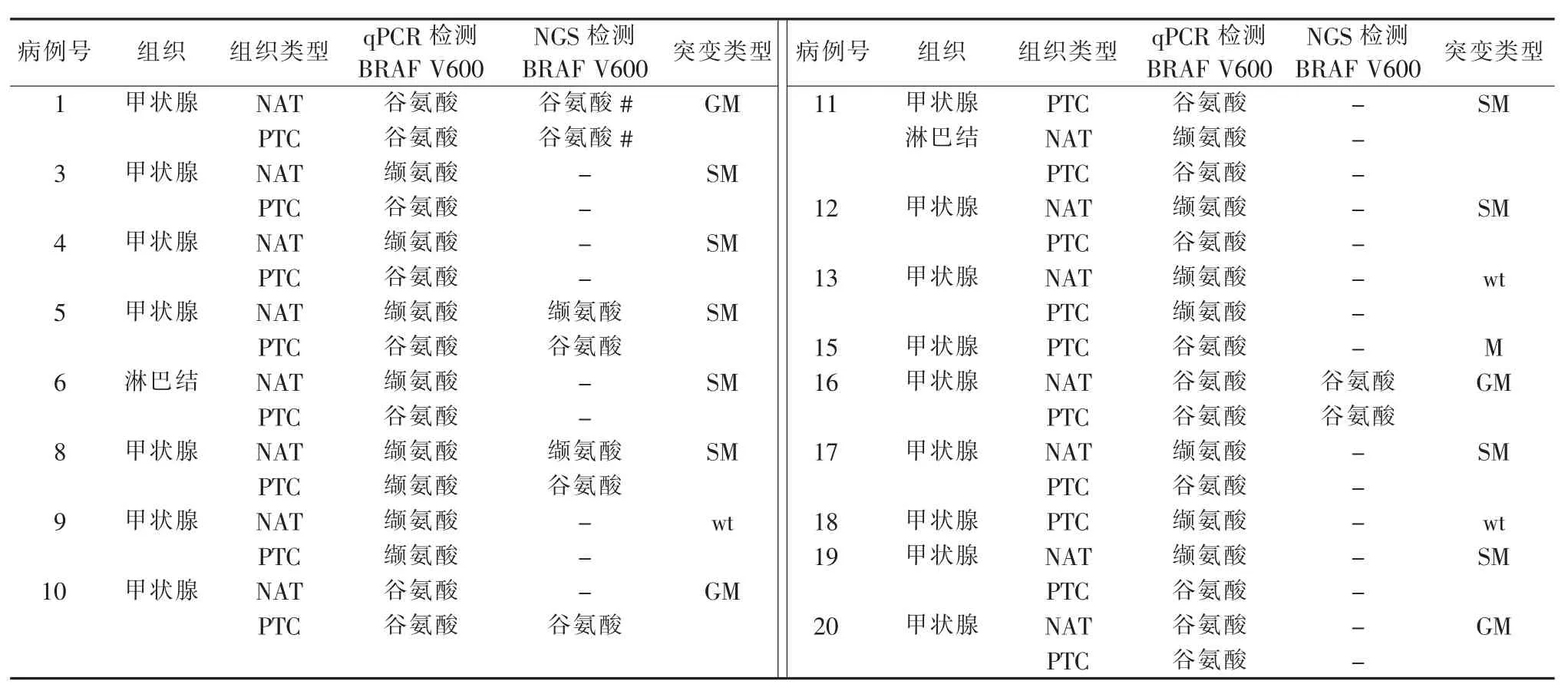
表4 靶向NGS和qPCR对比分析PTC和NAT中的BRAF V600E基因突变情况
讨 论
NF-κB信号通路主要参与炎症反应,并在淋巴造血系统肿瘤中起重要作用,但在甲状腺癌的研究中少有提及。因甲状腺癌可能与其炎症反应有一定联系,因此本研究着重对比检测了NF-κB的目的基因及一些调节基因在PTC组织与NAT中的表达水平有无差异,以探讨这条信号通路是否在PTC中起作用。
一、NF-κB信号通路相关基因在PTC中的表达及意义
本研究通过qRT-PCR检测和免疫组化检测,分析了NF-κB信号通路相关基因在PTC患者的肿瘤组织和NAT中的表达情况,发现NF-κB目的基因中的CD44和CCND2在PTC组织中的表达显著高于NAT。此前,Takano等[20]也在甲状腺细针穿刺标本中发现,CD44在甲状腺癌中的表达明显高于正常甲状腺组织。目前研究认为,CD44主要负责调节相邻细胞以及细胞与细胞外基质之间的黏附和连接[21]。CD44可增强乳腺癌、结肠直肠癌、卵巢癌等癌细胞的侵袭性[22-25],但在PTC中研究很少。而CCND2在细胞周期调节、分化和恶性转化中起关键作用[26]。研究发现,CCND2在睾丸癌、结肠癌、胃癌、多发性骨髓瘤中高表达,且与肿瘤进展及预后不良有关[27-30];而在乳腺癌、肺癌、前列腺癌及胰腺癌中呈现低表达[31],但在PTC中尚未见任何报道。
因此,本研究首次对比分析了NF-κB的重要靶点基因在PTC临床FFPE样本的肿瘤组织与NAT中的表达情况,并首次发现PTC的发生、发展可能与CD44及CCND2基因的异常高表达相关。但这2个基因在PTC发生、发展中的作用机制有待进一步研究。
二、PTC中的BRAF突变检测
为全面了解本研究所用PTC病例的分子背景和可能涉及的分子机制,本研究用NGS详细检测了与实体瘤密切相关的52个基因的突变情况,这些基因涵盖了目前研究报道的在甲状腺癌中可能起作用的基因。
BRAF突变是甲状腺癌中被研究最多的分子靶点,据报道,在40%~45%的PTC中均可检测到BRAF基因突变[32-34]。这种突变还会导致负责碘更新和代谢的基因的表达减少,从而降低甲状腺肿瘤对放射碘治疗的反应[35-37]。因此,本研究着重对比分析了BRAF基因突变,尤其是V600E突变在PTC及NAT中的存在情况。NGS和qPCR检测结果都表明,PTC病例中存在高频的V600E突变,且并非都是体细胞突变,也可以是胚系突变。在用NGS和qPCR同时检测V600E的验证实验中,发现2种方法检出结果的相符率达80%;而其差异在于,NGS检测到8号病例PTC组织中的V600E突变未在qPCR检测中发现;而qPCR检测到10号病例NAT中的V600E未在NGS检测中发现,提示对于极低丰度突变,NGS和qPCR平台的检测灵敏度都受到了很大挑战,这种情况下两者同时检测可提高阳性检出率。
三、PTC中的酪氨酸激酶基因突变检测及意义
除了BRAF基因突变在所有病例(5/5)中出现外,MAPK信号通路的重要基因如 HRAS(3/5)、KRAS(2/5)、NRAS(2/5)及 RET(2/5)的突变也在本研究中高频出现,提示该信号通路与PTC的发生、发展密切相关,该通路抑制剂可能适用于靶向治疗带有这些基因突变的PTC患者。另外,一些受体酪氨酸激酶/生长因子信号转导中的重要基因,包括ALK、FGFR4、FGFR3和 KIT, 也在本研究的 5例PTC患者中被检测到高频突变。
ALK基因在多种恶性肿瘤中异常存在。在本研究中检测到的2个ALK基因的胚系突变rs1881421和rs1670283,在淋巴瘤和神经母细胞瘤中也有发现[38]。但8号病例中2个位于剪接位点的肿瘤特异性 突 变 (splisite_3’c.3450+1G>A 和 splisite_5’c.3360-1G>A)在以往研究中未见报道,其在肿瘤中的发生频率和临床意义有待进一步研究。
FGFR家族受体在发育、分化、细胞存活和细胞迁移中发挥关键作用[39-41]。FGFR4在本研究的单个病例和混合样品中都检测到突变,但这个共同的突变 (rs376618)为胚系突变,尚无与疾病相关的报道。因此,FGFR4基因在PTC中是否起作用尚待进一步研究。在本研究5例患者的4例中检测到该家族另一成员FGFR3的点突变,既有胚系突变,也有体细胞突变,其中N718S为胚系突变,被报道与乳腺癌有关[42]。提示FGFR3在PTC肿瘤发生、发展中可能起作用,但该基因的具体变异位点存在很大个体差异,因此在临床应用时需对每例患者的具体突变位点进行分析鉴定。
KIT可促进细胞生长和生存[43]。临床发现KIT突变与黑素瘤、急性白血病及胃肠瘤的发生密切相关[44-45]。本研究检测到KIT的一个主要共同突变为胚系突变性质的插入突变 (c.67+4951T>TA,rs11407544),目前尚无临床相关性的报道。但在病例8中发现的剪接位点体细胞突变(rs121913234),之前曾被报道可致胃肠道间质瘤[46],并与伊马替尼或其他KIT抑制剂类药物的敏感性相关[43]。另在单独病例中还检测到KIT基因各种错义突变。因此,提示KIT基因很可能是PTC发生、发展中一个非常重要的作用基因,并在临床诊治中具有指导意义。
上述结果表明,许多酪氨酸激酶基因在PTC发生、发展过程中成为了突变靶点。目前,一些酪氨酸激酶抑制剂可用于治疗携带这些突变的患者。美国食品药品监督管理局已经批准了一种多个靶点的酪氨酸激酶抑制剂——乐伐替尼,用于治疗放射性碘难治性分化型甲状腺癌[47]。因此,以后对这些基因的临床检测可作为PTC患者个体化治疗的依据。
四、PTC中的其他重要基因突变及意义
MYC基因编码一种核磷蛋白,在细胞周期、凋亡和细胞转化中起作用;在子宫内膜癌、胃癌及淋巴造血系统都存在MYC的各种突变[48]。本研究大多数的病例中,其为胚系突变,而其他突变可能是体细胞突变,但尚无数据显示该突变位点与PTC有关联。而部分病例中发现的一些错义突变,如T73I,在非霍奇金淋巴瘤、恶性黑素瘤、成神经细胞瘤、食道癌和恶性淋巴瘤等肿瘤中均有报道[49]。最近有研究发现,二甲双胍作用于PTC细胞后,可通过哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)的抑制来降低c-MYC和Cyclin D1的表达,从而影响甲状腺癌细胞的生长和迁移[50]。可见,MYC基因很可能在PTC进程中起作用,而MYC的靶向药物将来可用于治疗携带MYC基因突变的甲状腺癌患者。
此外,在本研究行NGS测序分析的5例患者中,5号病例有35个突变基因,8号病例有40个突变基因,数量远多于其他3个病例,其中有23个基因突变都仅出现在这2个病例中。除了在PTC中有报道过的相关基因,如 KRAS、HRAS、NRAS、MAP2Ks、PIK3CA、RET 等外, 甚至包括 ERBB2、BRCA1等乳腺癌常见的基因突变,提示这2例患者基因中存在很大的肿瘤负荷。分析临床数据发现,这2例患者均为女性。5号病例43岁,在甲状腺手术1年半后进行超声检查,发现有双侧乳腺低回声结节样病灶。8号病例31岁,甲状腺切除半年后复发。这些随访结果和复发转移情况说明,这2例患者的肿瘤基因突变负荷与其不良预后有关。提示临床除了对单个药物靶点基因进行检测外,还可以通过NGS对患者的整体肿瘤负荷进行检测,从而进行预后判断。
总之,本研究结果提示,PTC患者的BRAF、RAS、ALK、FGFRs、KIT 和 MYC 等基因存在肿瘤特异性突变,此外CD44、CCND2基因高表达可能与PTC的发生、发展相关。临床检测这些基因的突变或表达情况,将有助于提供精准治疗PTC的分子靶点依据。此外,同时利用NGS和qPCR平台检测可提高BRAF V600E突变的临床检出率。但由于本研究的样本量有限,结果尚需通过更多病例样本的检测分析来验证和修订。
致谢:本研究感谢上海交通大学基础医学院公共技术平台和上海交通大学医学院附属瑞金医院北院病理科提供的技术支持;浙江玉安康瑞生物科技有限公司提供的技术和经费支持。
