天然产物Salvianolic Acid A与黄嘌呤氧化酶相互作用的酶动力学和分子对接研究
2019-09-05张婧妍刘亚婷唐红进
张婧妍,刘亚婷,唐红进
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
痛风,作为一种严重影响公共健康的代谢性疾病,是由机体内嘌呤代谢紊乱和/或尿酸排泄减少引起的一种晶体性关节炎,临床主要表现为高尿酸血症和尿酸盐结晶沉积所致的炎症性反应[1]。持续性的高尿酸血症是痛风发生的前兆和潜在诱因,更是其他一些慢性疾病如高血压、冠心病、代谢综合症以及肥胖症等发生与发展的危险因素[2-3]。黄嘌呤氧化酶(Xanthine Oxidase,XO),广泛分布于人体肝、肠、心、肺等组织细胞中,是参与机体内嘌呤代谢通路中一种重要的氧化还原酶类[4-5]。XO可催化次黄嘌呤氧化生成黄嘌呤,并进一步催化黄嘌呤生成尿酸;同时还伴随着大量超氧阴离子、过氧化氢等活性氧(Reactive Oxygen Species,ROS)的产生[6]。XO是机体内调控尿酸合成的关键酶,是痛风及高尿酸血症治疗的直接药物靶点之一[7]。XO抑制剂可通过抑制XO活性而阻断尿酸生成,进而降低血尿酸水平。目前,治疗高尿酸血症和痛风并没有特效药,临床使用的代表性药物分别为别嘌呤醇(Allopurinol)、非布索坦(Febuxostat)、托匹司他(Topiroxostat)(结构见图1a~图1c)。这些药物在使用过程中伴有明显的毒副作用[8-11],如肝损伤、渐进性肾衰竭、抑制骨髓造血功能、高血压等心血管问题、胃肠不适以及过敏反应等,这些不良反应极大地限制了该类药物在临床的长期应用[12]。因此,亟需寻找高效低毒的新型XO抑制剂,为痛风及高尿酸血症等相关疾病的治疗提供更有效途径。
天然产物一直都是治疗各类疾病药物的重要源泉,如川芎嗪、紫杉醇等药物。研究表明,丹酚酸类成分通过多种作用机制而发挥药理作用,如抑制血小板聚集、抗血栓形成、防止动脉粥样硬化斑块形成、抑制细胞内源性胆固醇合成、清除自由基、减少自由基对机体的损伤而产生保护作用等[13]。研究基于前期药物筛选的基础[14],通过酶动力学实验探讨了活性天然产物丹酚酸A(Salvianolic Acid A,SAA)(结构见图1d)对XO的体外抑制效应,并运用分子对接方法阐明了SAA与XO之间的结合特性。
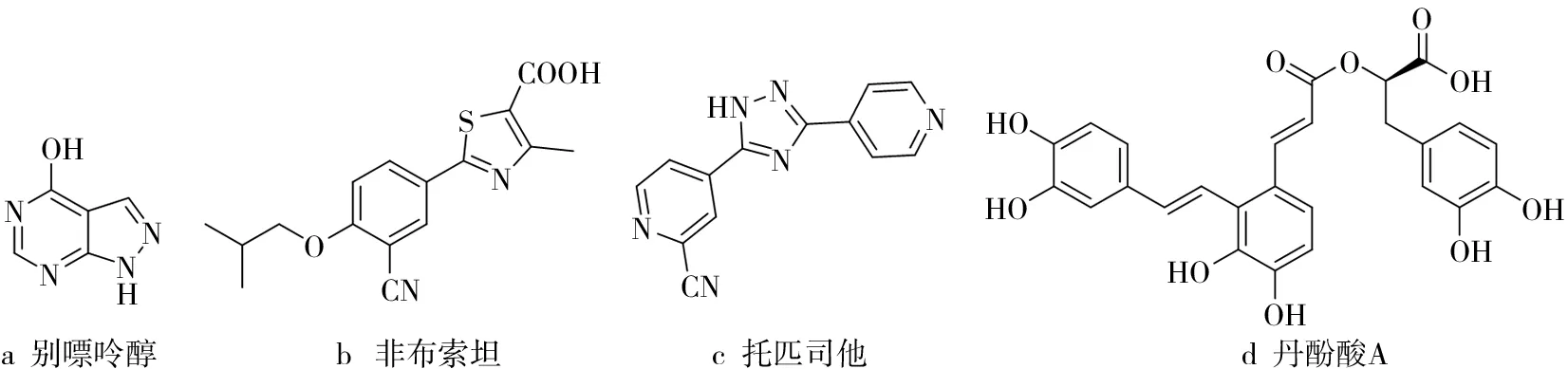
图1 部分已报道XO抑制剂化学结构
1 材料与方法
1.1 实验材料
化合物SAA购买于国家药品和生物制品检定所(纯度>99%);XO(来源于牛奶,E.C.1.1.3.22)、黄嘌呤、别嘌呤醇和DMSO购买于Sigma-Aldrich公司(USA)。其他所有化学试剂和溶剂均为分析纯,且实验用水均为超纯水。
1.2 实验方法
(1)XO抑制活性实验。用75 mM的磷酸缓冲液(PB,pH 7.4)配制浓度分别为0.08 U/mL和0.48 mM的XO和黄嘌呤工作液,置于冰上保存,待用。用DMSO溶解供试药物配制为10 mM的储备液,实验前用PB稀释至不同浓度(0~500 μM),样品溶液中DMSO含量小于0.1%。在96孔板上加入不同浓度的待测样品溶液100 μL,再加入0.08 U/mL的XO溶液50 μL,并以相同体积的PB作为空白对照,以别嘌呤醇(由10 mM的储备液经PB稀释至所需浓度)作为阳性对照,在酶标仪上37 ℃孵育3 min,每组平行设置4个复孔。随后,向各孔中加入0.48 mM的底物黄嘌呤50 μL以启动反应。使用酶标仪(Thermo Multiskan Go v1.01.10,Thermo Fisher Scientific,USA)记录吸光度值,在波长295 nm处每隔15 s读数一次,共计7 min。抑制率通过如下公式进行计算:
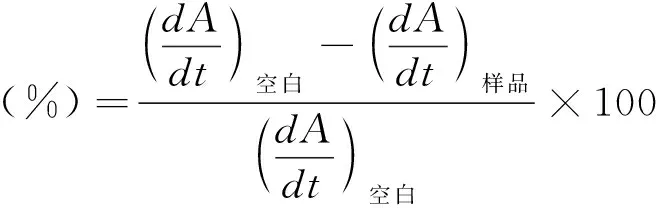
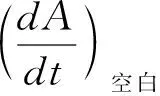
(2)XO抑制可逆性分析。在96孔板上加入100 μL不同浓度的待测样品溶液(0、50 μM、100 μM),再加入50 μL不同浓度的XO溶液(0.01 U/mL、0.025 U/mL、0.05 U/mL、0.10 U/mL),并以相同体积的PB作为空白对照,在酶标仪上37 ℃孵育3 min,每组平行设置4个复孔。随后,加入0.48 mM的底物黄嘌呤50 μL以启动酶反应。使用酶标仪在波长295 nm处记录吸光度值,每隔15 s读数一次,共计5 min。以酶反应速率(v,ΔA/min)对不同浓度的XO溶液作图,用于判断化合物SAA对XO的抑制可逆性。
(3)XO抑制类型分析。在96孔板上加入100 μL不同浓度的待测样品溶液(0、50 μM、75 μM、100 μM),再加入50 μL一定浓度的XO溶液(0.08 U/mL),并以相同体积的PB作为空白对照,在酶标仪上37 ℃孵育3 min,每组平行设置4个复孔。随后,加入50 μL不同浓度的底物黄嘌呤(0.08 mM、0.12 mM、0.16 mM、0.20 mM)以启动酶反应。使用酶标仪在波长295 nm处记录吸光度值,每隔15 s读数一次,共计5 min。通过酶反应速率的倒数(1/v(ΔA/min))对不同浓度的底物黄嘌呤的倒数作图,获得Lineweaver-Burk Plots方程。酶抑制类型通过双倒数方程进行计算,Ki值代表化合物与游离酶结合时的抑制速率常数,可通过双倒数方程二次计算获得。
(4)XO失活动力学分析。在体系中先加入不同浓度的待测样品溶液(100 μL,5 μM、25 μM、40 μM、80 μM)和底物黄嘌呤(50 μL,0.48 mM),随后再加入一定浓度的酶溶液(50 μL,0.08 U/mL)。立即混合均匀后置于酶标仪上37 ℃孵育,在波长295 nm处记录吸光度值,每隔3 min读数一次,计30 min,随后每隔10 min读数一次,共计180 min。每组实验平行设置4个复孔。通过XO相对活性对混合体系反应时间作图,用于评价化合物SAA介导下的酶失活动力学进程。
(5)分子对接实验。分子对接实验通过分子计算模拟软件AutoDock v4.2完成。XO/水杨酸的晶体复合物结构从RCSB蛋白数据库下载获得,其PDB编号为1FIQ。小分子化合物的3D化学结构通过Chem3D Pro 14.0绘制,对运用分子计算软件SYBYL X-2.0的标准Tripos力场对小分子化合物进行能量最优化处理(能量梯度收敛标准0.005 kcal·mol-1、最大迭代次数为10 000,并为小分子添加Gasteiger-Hückel电荷),并使用AutoDock工具进行小分子配体可旋转键的搜寻与定义。大分子蛋白结构通过多肽链缺失残基和末端残基修补、除去水分子、添加氢原子、添加Gasteiger电荷以完成大分子的准备过程。Grid盒子大小被定义为60 Å×60 Å×60 Å,且中心为0.375 Å,以覆盖整个蛋白分子的催化活性中心位点。拉马克遗传算法(Lamarckian Genetic Algorithm,LGA)用于对接过程运算,且运行100次,其他参数设置取默认值。取对接结合能量最低且具有最高百分频率的簇类分析(Cluster Analysis,rsmd 2.0 Å)后的构象用于配体-蛋白复合物结合模式分析,并使用Pymol对SAA-XO复合物构象进行作图。
2 结果及分析
2.1 SAA对XO抑制活性评价
通过体外酶抑制活性实验进行化合物SAA对XO抑制活性评价,结果如图2所示。由图2可以看出,与阳性对照药Allopurinol(IC50=3.07±0.08 μM)相比,SAA浓度依赖性抑制XO活性,随着化合物浓度的升高,酶抑制活性也不断增强,且其IC50值为65.49±0.94 μM。因此,实验结果表明,化合物SAA是潜在的XO抑制剂,可作为痛风及高尿酸血症治疗的药物先导物,有待于进一步研究开发。
2.2 SAA对XO抑制可逆性判断
为了进一步探讨化合物SAA对XO的抑制是否为可逆性抑制过程,进而绘制了不同待测物浓度下的酶反应体系的反应速率动力学方程,如图3所示。由图3可以看出,所有直线均通过原点,且随着抑制剂SAA浓度不断增加,直线斜率呈现不断降低的趋势;如果为非可逆性抑制,则不同待测物浓度下的曲线不相交于坐标轴原点位置,这与文献报道的黄酮类化合物木犀草素(Leteolin)对XO的抑制表现出相似的性质[15]。由此表明,化合物SAA通过可逆性抑制XO来表现出酶的抑制效应。
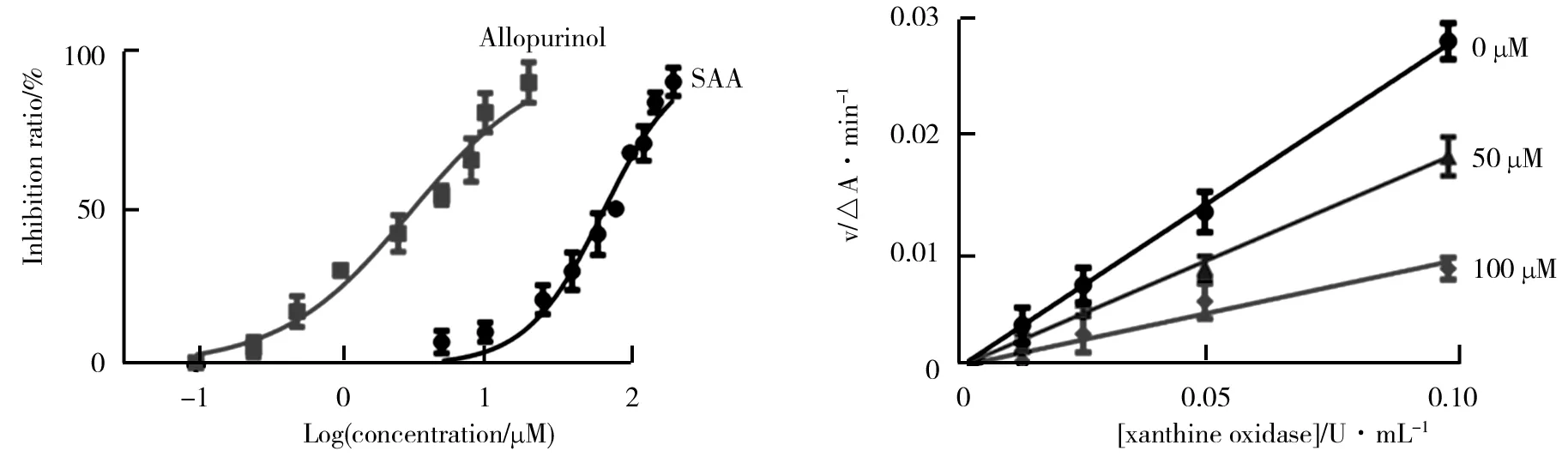
图2 化合物SAA对XO抑制活性评价图3 化合物SAA对XO抑制可逆性分析
2.3 SAA对XO抑制类型判断
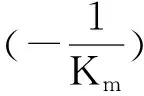
2.4 SAA对XO失活动力学分析
通过测定化合物SAA对XO抑制作用时间进程来探讨酶失活动力学过程,研究结果如图5所示。由图5可知,在不同浓度SAA(5 μM、25 μM、40 μM、80 μM)存在下,XO相对活性随着与SAA孵育时间的增加(0~180 min)并没有发生显著变化,而是维持在一个相对恒定的抑制活性处。当化合物SAA浓度为5 μM,与酶初始活性相比,XO的相对活性约为92%;当抑制剂SAA浓度为最大待测浓度80 μM时,在测定时间180 min内,酶的相对活性约为初始活性的25%。这表明化合物SAA能够相对容易地结合于XO活性位点,与酶发生相互作用或诱导该酶二级结构构象发生改变,使酶活性得到快速抑制,并在较短时间内失活,从而介导酶的快速抑制失活动力学过程。
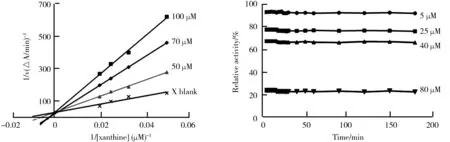
图4 化合物SAA对XO抑制类型Lineweaver-Burk Plots分析图5 化合物SAA对XO失活动力学分析
2.5 分子对接模拟
分子对接被广泛用于分析小分子配体与蛋白相互作用的结合机制。XO(PDB Code:1FIQ)由A、B、C 3条亚基构成,其中包含3个活性结构域,分别为A链中的Fe/S中心结构域、B链中的FAD结构域和C链中的钼蝶呤结构域[16]。化合物SAA与XO对接结果如图6所示。首先,蛋白原始配体水杨酸被重新对接到XO活性中心,并产生0.51 Å的RMSD值,重新对接的配体构象与晶体复合物原始构象保持相对一致(如图6b所示),表明所建立的对接方法具有可靠性。SAA对接进入XO活性口袋,其口袋由关键氨基酸残基Leu648、Glu802、Ser876、Glu879、Arg880、Phe914、Phe1009、Thr1010、Val1011、Leu1014、Pro1076等组成。由图6c可以观察到,化合物SAA结构中1,2-二芳基乙烯基团伸入到活性口袋最里端的疏水性区域,位于钼蝶呤(Mo-pt)结构域处,由残基Leu648、Arg880、Phe914、Phe1009、Val1011、Phe1013和Pro1076等组成,而结构中3,4-二羟基芳基丙酸基团则游离于活性口袋袋口处,表明疏水相互作用对于配体SAA结合于XO和复合物构象稳定性的维系有着非常重要的作用。同时可以看出,化合物SAA结构中的游离羟基分别与残基Gln767、Asn768、Arg880、Thr1010生成了4个氢键相互作用,这表明氢键相互作用对于维持SAA-XO复合物构象稳定性也有着不可缺少的作用。此外,潜在的芳香π-π堆积作用也可以被观察到,如化合物SAA结构中的芳香苯环与残基Phe914直接形成face-to-face的π-stacking效应,与残基Phe1009之间产生了face-to-edge的π-π相互作用。
由此可见,化合物SAA可结合于XO活性位点处,二者在结合过程中所产生的疏水相互作用和氢键作用对于SAA-XO复合物构象发挥着极为重要的稳定性维系作用。
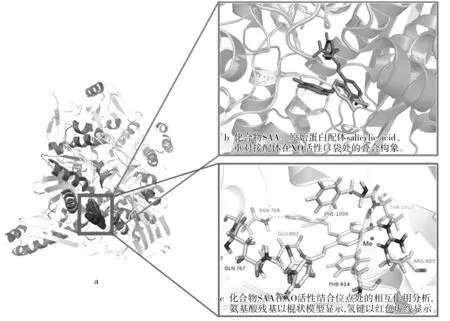
图6 化合物SAA与XO(PDB Code:1FIQ)分子对接结果
3 结论
综上所述,天然产物SAA表现出潜在的XO抑制活性,其IC50值为65.49±0.94 μM。化合物SAA通过竞争性且可逆性抑制XO,使其快速失活,并表现出浓度依赖性。同时,通过分子对接对SAA-XO结合构象分析,有理由推断,化合物SAA可以与底物竞争性结合于XO的活性中心。如果SAA浓度较低,则酶活性被轻度抑制。随着SAA浓度不断增加,SAA可能通过诱导酶二级结构构象发生变化,阻止底物进入活性位点,从而表现出较强的酶抑制效应。因此,天然产物SAA可作为新型XO抑制剂备选化合物,用于抗痛风及高尿酸血症药物先导物进行后续研究开发。
